Содержание
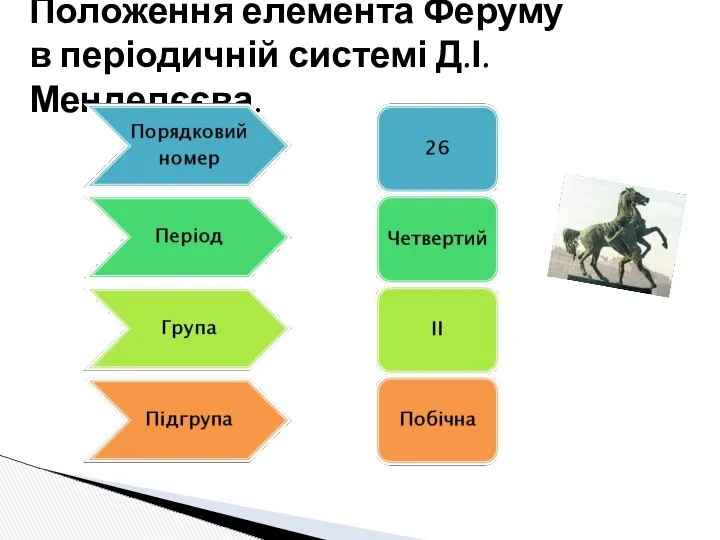
- 2. Положення елемента Феруму в періодичній системі Д.І. Менделєєва.
- 3. Дописати електронну формулу 1s2 2s2 2р6 3s2 3р6…. Будова атома Феруму
- 4. Які електрони для елементів головних підгруп являються валентними? А які електрони для елементів побічних підгруп являються
- 5. Валентні електрони атомів елементів побічних підгруп розприділяються на останньому і передостанньому рівнях. Запам’ятай!
- 6. Для Феруму характерні два основні ступені окиснення: +2, +3. Fe0 –2e = Fe+2 Fe0 –3e =
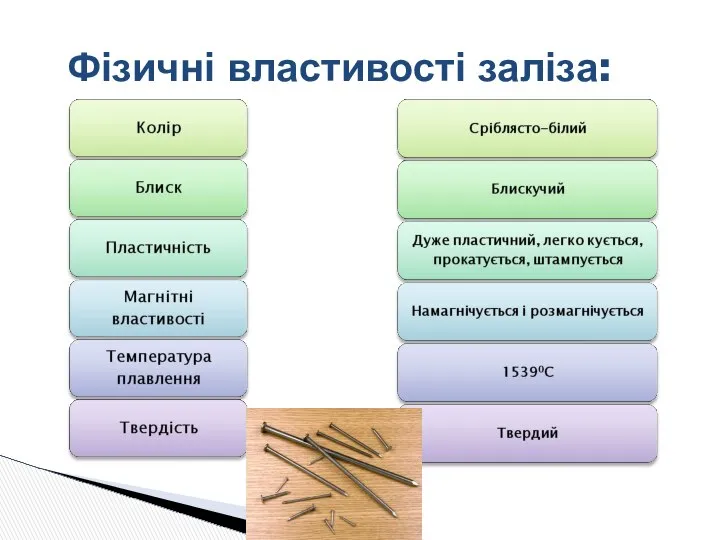
- 7. Фізичні властивості заліза:
- 8. Fe +3 +2 +2, +3 O2, H2O CI2, HNO3 S, Cu2+, p.HCI, p.H2 SO4
- 9. Fe + CI2 = Fe + S = Fe + HCI = Fe + O2 =
- 10. Взаємодія з простими речовинами -неметалами 1) З киснем. 0 0 +2, +3 -2 +2 -2 +3
- 11. 0 0 +2 -2 Fe + S —>FeS електронний баланс Fe0 – 2e- —> Fe2+ S0
- 12. Хімічні властивості заліза Взаємодія з складними речовинами 1) З водою. +2, +3 3Fe0 + 4H2O —>
- 13. Метали Взаємодіють з кислотами коли: 1. Метал знаходиться в ряду активності металів до водню. 2. Повинні
- 14. 3) З солями. Дослід: здійснити реакцію між порошком заліза і розчином купрум (II) хлориду В якому
- 15. Метали Взаємодіють з розчинами солей коли: 1. Кожний метал витісняє із розчинів солей всі інші метали,
- 16. Сполуки Феруму :
- 17. +2 +2 FeO —>Fe(OH)2 Даний оксид проявляє основний характер. Які реакції підтверджують основний характер оксидів? +3
- 18. 1) 2FeCI2 + CI2 = 2FeCI3 2) FeCI3 + 3NaOH = Fe(OH)3 + 3NaCI 3) 4Fe(OH)2
- 19. На йони Fe2+ +2 +3 +2 FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL червона кровяна сіль синій осад
- 21. Скачать презентацию















![На йони Fe2+ +2 +3 +2 FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1400268/slide-18.jpg)
 Этиленовые, олефины, непредельные алкены
Этиленовые, олефины, непредельные алкены Химия вокруг нас
Химия вокруг нас Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции
Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции Диазины. Характеристика диазинов. (Лекция 8)
Диазины. Характеристика диазинов. (Лекция 8) Презентация по химии Металлы
Презентация по химии Металлы  Презентация по химии Углерод
Презентация по химии Углерод Физика древесины
Физика древесины Органическая химия Скорость химических реакций
Органическая химия Скорость химических реакций Анилин. Физические свойства
Анилин. Физические свойства Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Аммиак
Аммиак Mechanistic insights into the aminolysis of 3,4-epoxysulfolane
Mechanistic insights into the aminolysis of 3,4-epoxysulfolane Презентация по Химии "Изучение характеристик мороженого как продукта питания" - скачать смотреть
Презентация по Химии "Изучение характеристик мороженого как продукта питания" - скачать смотреть  Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды
Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин)
Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин) Простые вещества, металлы
Простые вещества, металлы Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан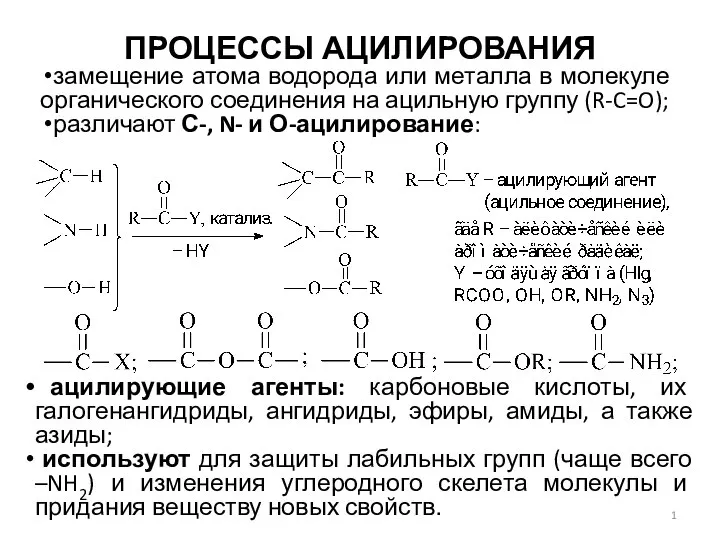 Процессы ацилирования
Процессы ацилирования Основные классы неорганических соединений
Основные классы неорганических соединений Значение теории химического строения А.М.Бутлерова
Значение теории химического строения А.М.Бутлерова  Антиоксидантная защита мозга
Антиоксидантная защита мозга Водород. Получение водорода
Водород. Получение водорода Буферные растворы. Буферная емкость
Буферные растворы. Буферная емкость Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization Неорганическая химия Сероводород
Неорганическая химия Сероводород