Содержание
- 2. Физико-химические свойства белков Молекулярная масса; Амфотерность; Наличие заряда, электрофорез; Растворимость, свойства белковых растворов Денатурация
- 3. Белки – амфотерные электролиты. Заряд белковой молекулы. Знак и величина заряда Б молекулы зависят от особенностей
- 4. ИЭТ – тот pH среды, при котором белок находится в изоэлектрическом состоянии. Заряд равен 0. ИЭТ
- 5. Методы разделения белков по заряду 1. Электрофорез – движение заряженных частиц в электрическом поле. Скорость движения
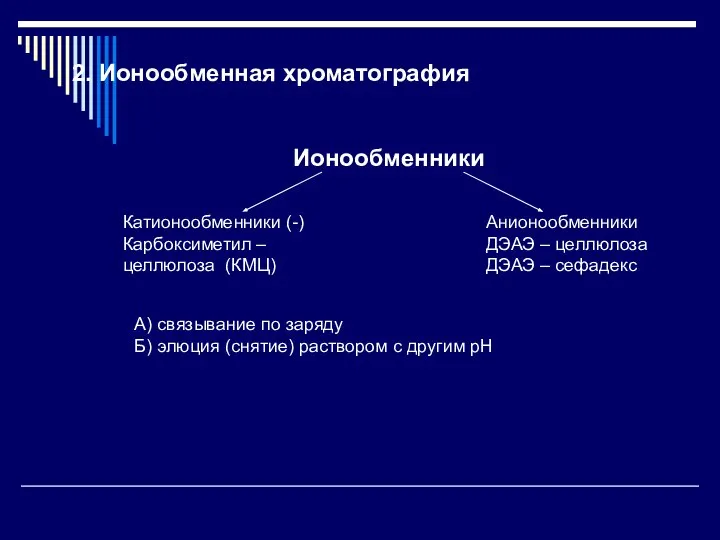
- 6. 2. Ионообменная хроматография Ионообменники Катионообменники (-) Карбоксиметил – целлюлоза (КМЦ) Анионообменники ДЭАЭ – целлюлоза ДЭАЭ –
- 7. 3. Изоэлектрическое фокусирование (электрофокусирование, изотахофорез) pH = pJ остановка движения О.Вестерберг амфолины (полиаминополикарбоновые кислоты)
- 8. Молекулярная масса белков Зависит от: Особенностей первичной структуры; Наличия четверичной структуры; Массы небелковой части (простой белок
- 9. Методы определения молекулярной массы белков Расчетные Вискозиметрические Осмометрические Оптические Гравиметрические (ультрацентрифугирование) Гельфильтрация Электрофорез (ЭФ) Ультрафильтрация
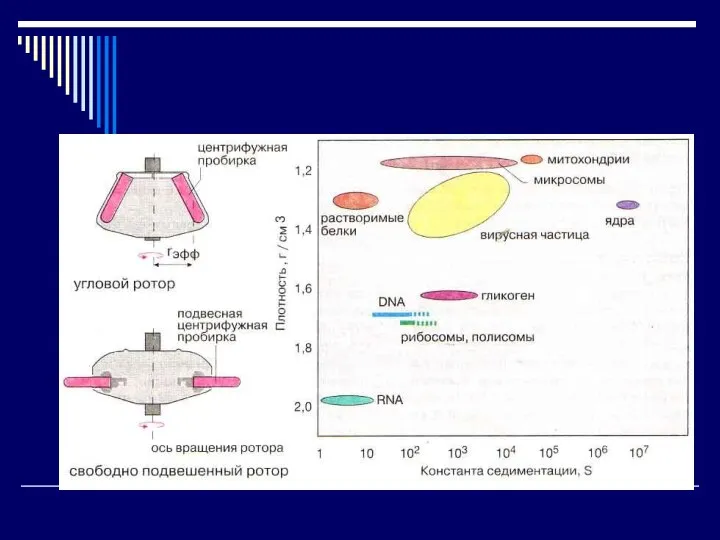
- 10. Методы определения (разделения) белков по массе Ультрацентрифугирование – гравиметрический метод 1913г. - Думанский, 1923г. – Сведберг
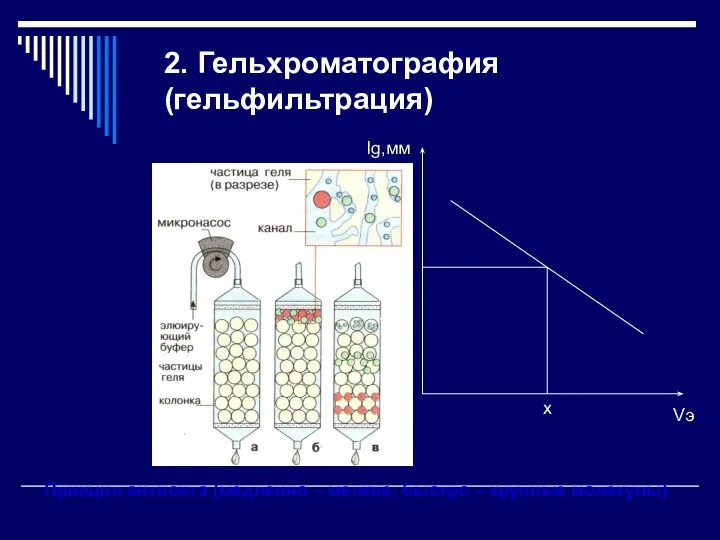
- 12. 2. Гельхроматография (гельфильтрация) Принцип антисита (медленно – мелкие, быстро – крупные молекулы)
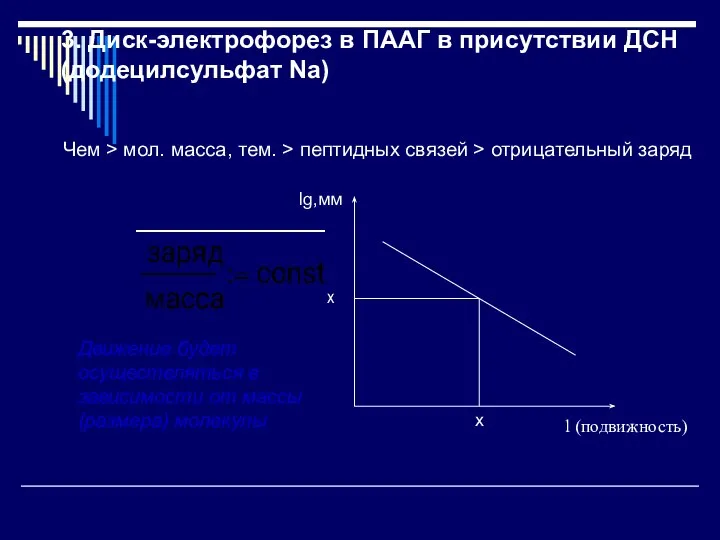
- 13. 3. Диск-электрофорез в ПААГ в присутствии ДСН (додецилсульфат Na) Чем > мол. масса, тем. > пептидных
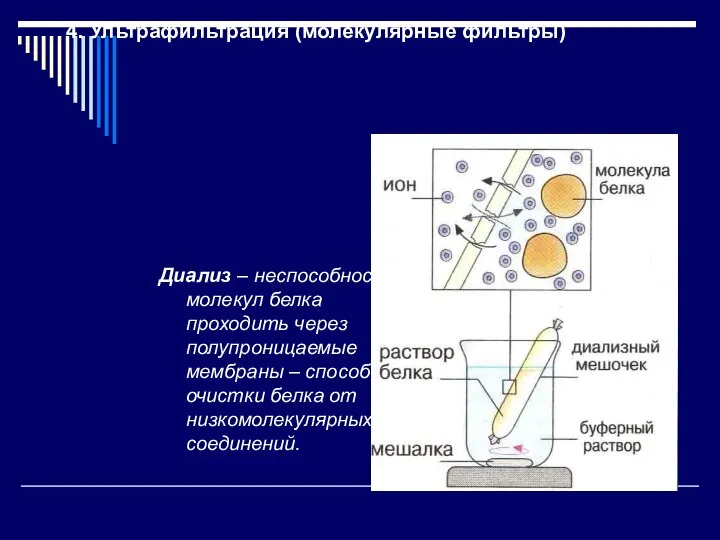
- 14. 4. Ультрафильтрация (молекулярные фильтры) Диализ – неспособность молекул белка проходить через полупроницаемые мембраны – способ очистки
- 15. Растворимость Зависит от: АК состава (чем больше полярных групп, тем больше растворимость) Особенностей организации молекулы (Г>Ф)
- 16. Влияет на растворимость: Ионная сила раствора: С – концентрация b - валентность 1. Концентрация нейтральных солей
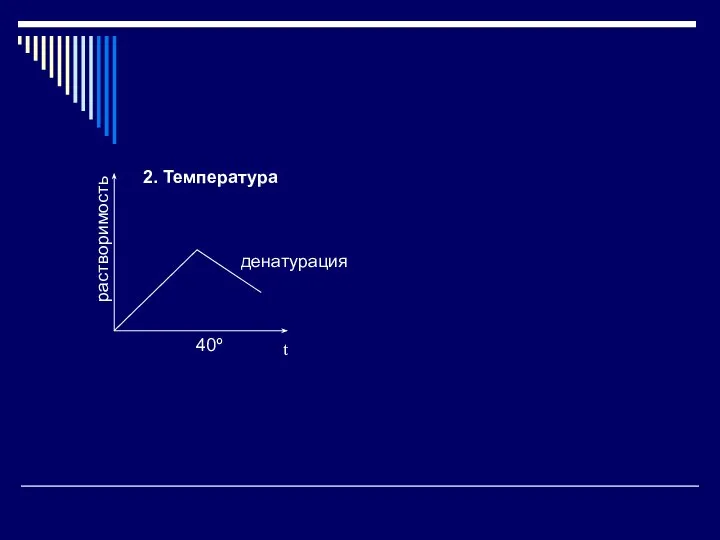
- 18. 2. Температура
- 19. Методы фракционирования по растворимости: Изоэлектрическое осаждение Высаливание Осаждение водоотнимающими средствами (спирт, ацетон на холоду по Кону)
- 20. Свойства белков в растворе Медленно дифундируют Не проходят через полупроницаемые мембраны Опалесцируют Рассеивают свет Способны к
- 21. Нативный белок – белок с неизменной структурой и свойствами. Факторы денатурации: Физические (t, давление, УЗ) Химические
- 22. Химическая (ковалентная) модификация 1) Фосфатная модификация 2) Ацетатная модификация 3) Метилирование 4) Аминирование 5) АДФ-рибозилирование Химическая
- 23. Гомогенизация – разрушение ткани, клеток Экстракция – извлечение белка различными растворителями (вода, слабые солевые растворы) Разделение
- 24. Классификация белков По форме (Г и Ф) По степени сложности (простые и сложные) По растворимости (и
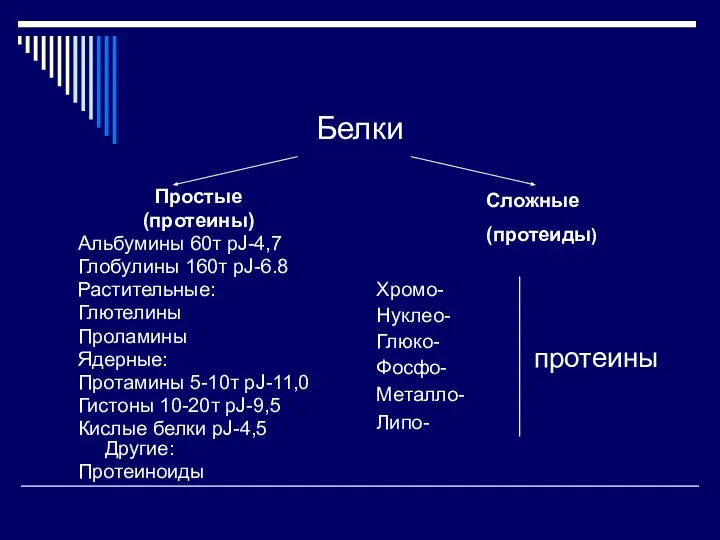
- 25. Белки Простые (протеины) Альбумины 60т pJ-4,7 Глобулины 160т pJ-6.8 Растительные: Глютелины Проламины Ядерные: Протамины 5-10т pJ-11,0
- 26. А – Н2О и крепкие солевые растворы >50%, 100% уменш. Г – н/р Н2О растворимы в
- 27. Сложные белки Хромопротеиды - окрашенные белки (chroma – краска) Гемопротеиды – Нв, миоглобин, каталаза, пероксидаза, цитохромы
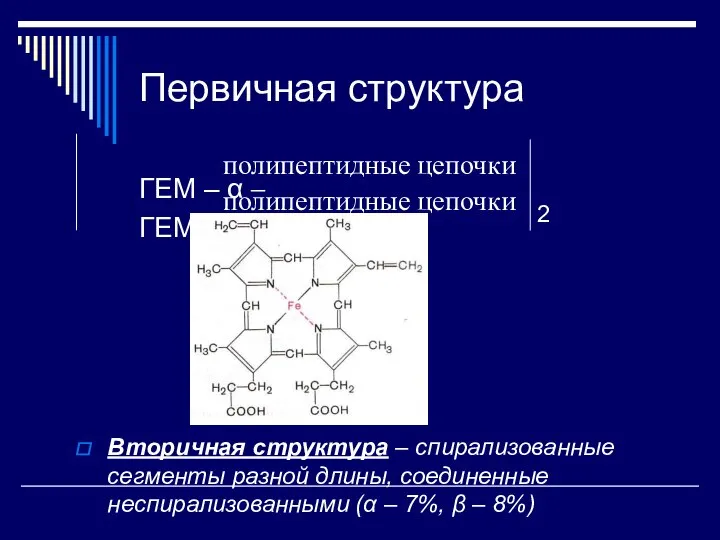
- 28. Первичная структура ГЕМ – α – ГЕМ – β – 2 Вторичная структура – спирализованные сегменты
- 29. Третичная структура – формирование субъединиц, внутри каждой образуется «гидрофобный» карман, в котором располагается Гем, который удерживается
- 30. Четверичная структура – похожа на тетраэдр, субъединицы расположены попарно Между б и в – силы Ван
- 31. Производные гемоглобина Схема образования производных гемоглобина
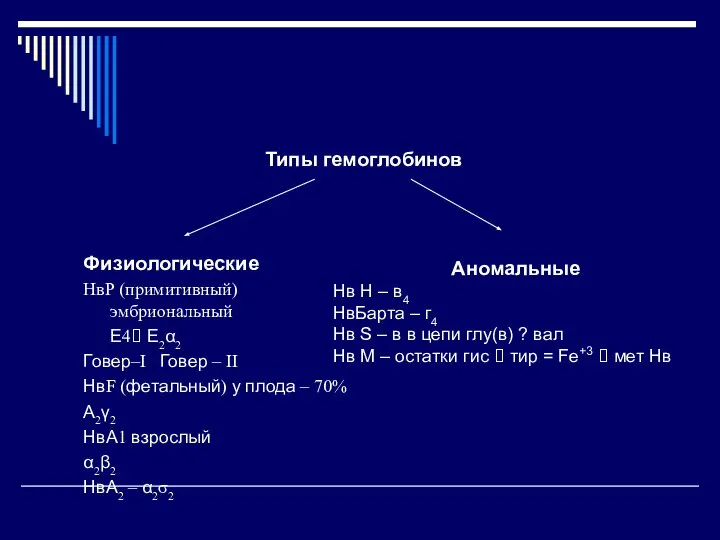
- 32. Типы гемоглобинов Физиологические НвР (примитивный) эмбриональный Ε4? Е2α2 Говер–I Говер – II НвF (фетальный) у плода
- 33. Кровь взрослого человека НвА1 - 95 – 96% НвА2 – 2-3% НвF – 0,1 – 2%
- 34. Фосфопротеиды Небелковая часть – фосфорная кислота Постоянный фосфопротеид – казеин молока Временные фосфопротеиды – фосфатные модификации
- 36. Скачать презентацию
























 Отравляющие и высокотоксичные вещества раздражающего и пульмонотоксического действия
Отравляющие и высокотоксичные вещества раздражающего и пульмонотоксического действия Весы. Камни Весов
Весы. Камни Весов Фазовые и агрегатные состояния полимеров
Фазовые и агрегатные состояния полимеров Выполнение упражнений по теме Галогены
Выполнение упражнений по теме Галогены Открытие водорода
Открытие водорода Использование активных методов обучения на уроках химии
Использование активных методов обучения на уроках химии «Дело или занятие, не содержащее трудностей, недостойно ума человека» У. Ченнинг Урок-исследование Учитель: И
«Дело или занятие, не содержащее трудностей, недостойно ума человека» У. Ченнинг Урок-исследование Учитель: И Химия: классификация химических реакций
Химия: классификация химических реакций Ионные равновесия в растворах
Ионные равновесия в растворах Физико-химия поверхностных явлений. Основы адсорбционной терапии
Физико-химия поверхностных явлений. Основы адсорбционной терапии Электрические поля в фотосинтетических мембранах
Электрические поля в фотосинтетических мембранах Вода как среда и участник протекания биохимических процессов в организме
Вода как среда и участник протекания биохимических процессов в организме Презентация по Химии "Классификация ядов" - скачать смотреть
Презентация по Химии "Классификация ядов" - скачать смотреть  Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар
Капиллярлық құбылыстардың дамуына үлес қосқан ғалымдар БЕЛКИ, ИХ СТРУКТУРА, СВОЙСТВА. БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ. Лепешенко Т.И. ГБОУ НПО РО ПУ № 61 Г. Новошахтинск Ростовской обла
БЕЛКИ, ИХ СТРУКТУРА, СВОЙСТВА. БИОЛОГИЧЕСКИЕ ФУНКЦИИ БЕЛКОВ. Лепешенко Т.И. ГБОУ НПО РО ПУ № 61 Г. Новошахтинск Ростовской обла Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно
Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно Каменск Уральский техникум торговли и сервиса
Каменск Уральский техникум торговли и сервиса Ювелирное дело как вид ДПИ
Ювелирное дело как вид ДПИ Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно
Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно Амінокислоти
Амінокислоти Практическое применение метанола
Практическое применение метанола Галогены. Применение галогенов и их соединений
Галогены. Применение галогенов и их соединений Металлы. XV раздел Недрагоценные металлы и изделия из них. Перемещение через таможенную границу
Металлы. XV раздел Недрагоценные металлы и изделия из них. Перемещение через таможенную границу Актиний
Актиний Кремний и его соединения
Кремний и его соединения Fuel cells
Fuel cells Влияние культуры знаний на отношение к курению. Исследовательская работа.
Влияние культуры знаний на отношение к курению. Исследовательская работа.