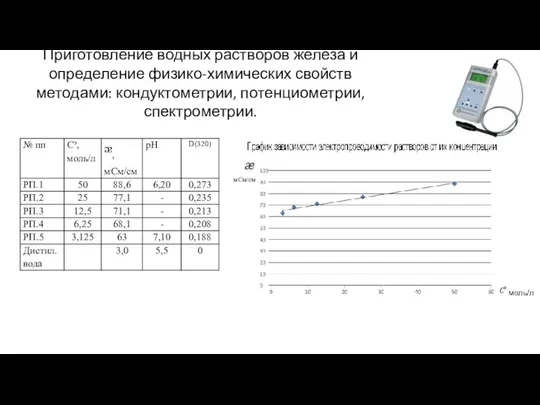
Приготовление водных растворов железа (III) и определение концентрации трилонолометрическим методом.
Окисление железа
(II):
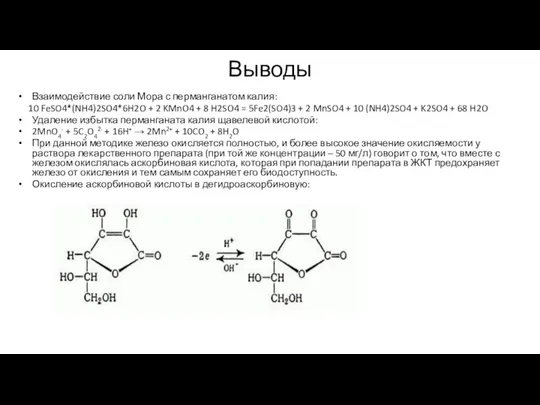
H2S2O8 + 2 FeSO4 = Fe2(SO4)3 + H2SO4
С6Н4(ОН) СООН + FeCl3 =>сине-фиолетовый комплекс
Трилон Б
Комплекс трилона Б с Fe(III)
Погрешность измерения:
Р1 = 10,6%
Р2 = 3,6%
РП = 16%
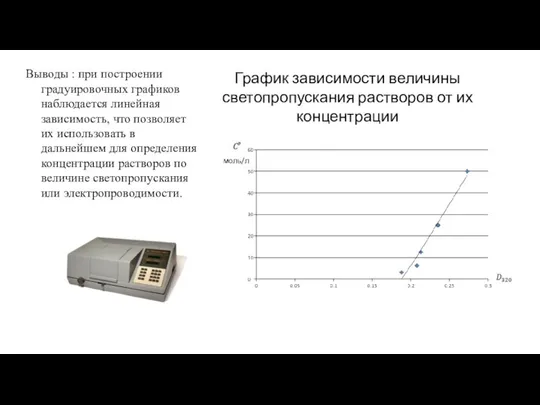
Большая погрешность в измерении концентрации железа в растворе лекарственного препарата обусловлена присутствием аскорбиновой кислоты, которая не позволила до конца окислить железо персульфатом.
Комплекс Fe с салициловой кислотой




 Строение соединений d-элементов
Строение соединений d-элементов Aлканы. Определение. Общая формула класса углеводородов
Aлканы. Определение. Общая формула класса углеводородов Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами
Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами Исследовательская работа «Волшебная соль»
Исследовательская работа «Волшебная соль» Фенол. Получение и использование, физические и химические свойства. Биологическая роль
Фенол. Получение и использование, физические и химические свойства. Биологическая роль Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием
Антибиотики-аминогликозиды: получение, свойства, исследование и применение. Связь между химическим строением и действием Вода - растворитель
Вода - растворитель Беседа с в 11 классе
Беседа с в 11 классе Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения
Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения Галогены. Основные химические свойства. Качественные реакции
Галогены. Основные химические свойства. Качественные реакции Алкалоидтар. Алкалоидтар туралы жалпы түсінік
Алкалоидтар. Алкалоидтар туралы жалпы түсінік Актиний
Актиний Краткий очерк истории развития химии
Краткий очерк истории развития химии Комплексные соединения хлоридов европия и гадолиния с салициловой кислотой
Комплексные соединения хлоридов европия и гадолиния с салициловой кислотой Неметаллы
Неметаллы Конфигурация макромолекулы
Конфигурация макромолекулы Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Содержание витамина С (аскорбиновой кислоты) в натуральных и консервированных соках.
Содержание витамина С (аскорбиновой кислоты) в натуральных и консервированных соках. Азотсодержащие вещества. Амины
Азотсодержащие вещества. Амины Открытая школа по химии
Открытая школа по химии Предмет и задачи биохимии. Белки. (Лекция 1)
Предмет и задачи биохимии. Белки. (Лекция 1) Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A
Radical Approach to the Chiral Quaternary Center in Asperaculin A: Synthesis of 9‑Deoxyasperaculin A Презентация по Химии "Патофизиология аритмий сердца ПАТОФИЗИОЛОГИЯ АРИТМИЙ СЕРДЦА" - скачать смотреть бесплатно
Презентация по Химии "Патофизиология аритмий сердца ПАТОФИЗИОЛОГИЯ АРИТМИЙ СЕРДЦА" - скачать смотреть бесплатно