Содержание
- 2. Введение Первое начало Т/Д позволяет рассчитать тепловой эффект процесса ΔН ΔН > 0 эндотермический, теплота поглощается.
- 3. 1. *Второй закон термодинамики. Энтропия. Статистическая интерпретация энтропии Второе начало Т/Д (как и первое) выведено из
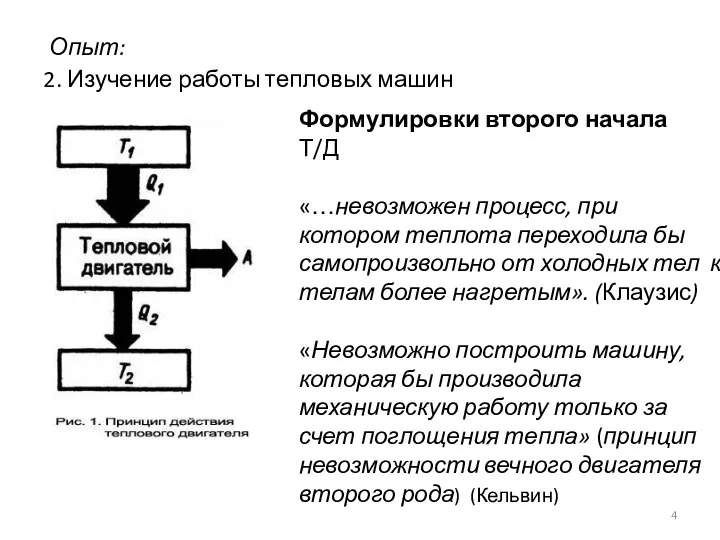
- 4. 2. Изучение работы тепловых машин Опыт: Формулировки второго начала Т/Д «…невозможен процесс, при котором теплота переходила
- 5. Опыт: 3. Существуют самопроизвольные процессы, в ходе которых происходит поглощение/выделение теплоты при постоянной температуре (плавление, испарение,
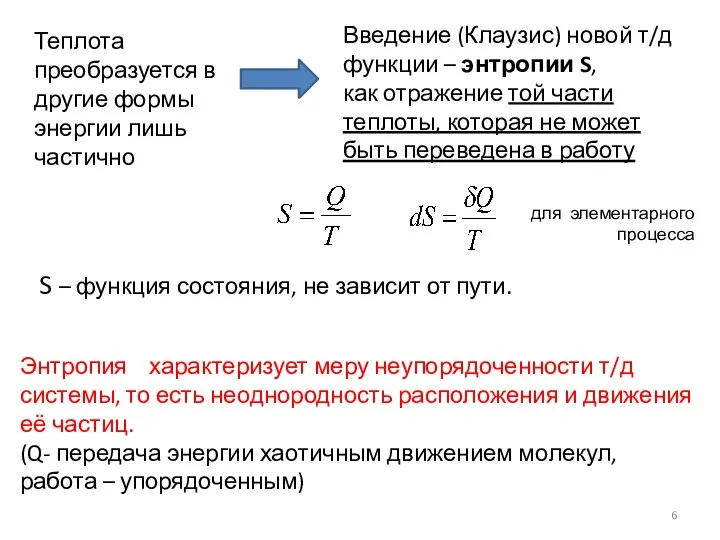
- 6. для элементарного процесса S – функция состояния, не зависит от пути. Теплота преобразуется в другие формы
- 7. Для изолированных систем: В самопроизвольных процессах энтропия растет. Второе начало Т/Д = закон возрастания энтропии ∆S
- 8. Возрастание S . Энтропийный характер жизни и старения объектов живой природы. При старении S возрастает. Для
- 9. Критерий возможности самопроизвольного протекания процесса в изолированной системе: Если ∆S ≥ 0 процесс самопроизвольный ∆S =
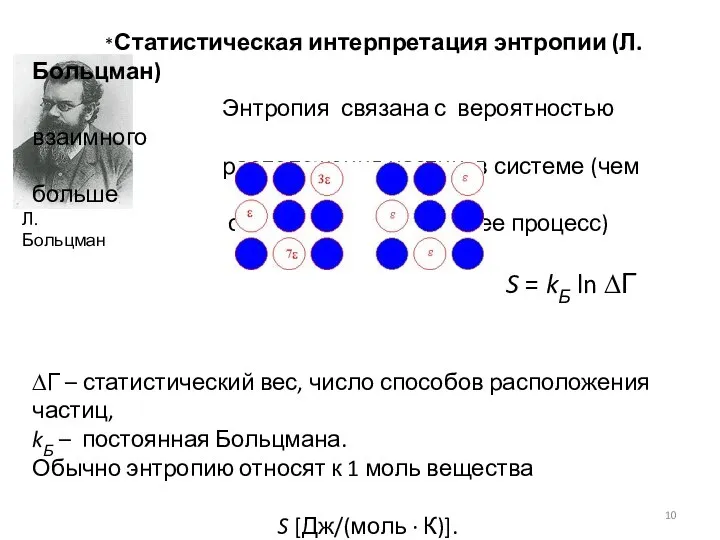
- 10. *Статистическая интерпретация энтропии (Л. Больцман) Энтропия связана с вероятностью взаимного расположения частиц в системе (чем больше
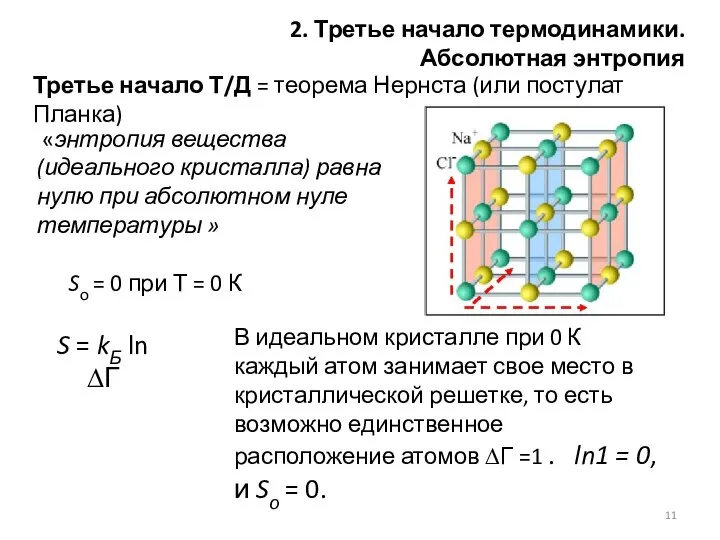
- 11. Третье начало Т/Д = теорема Нернста (или постулат Планка) «энтропия вещества (идеального кристалла) равна нулю при
- 12. Sо = 0 при Т = 0 К - есть точка отсчета, можно рассчитать значение абсолютной
- 13. Изменение энтропии при нагревании от 298 К до T При P=const
- 14. Изменение энтропии при фазовом переходе
- 15. *Изменение энтропии в химической реакции при 298 К ΔS0r 298 = ∑v S0298 прод – ∑v
- 16. Пример: Вычислим ΔS0r в реакции, протекающей при 900 К: CO2 (г) + 4 H2 (г) =
- 17. ∆S ≥ 0 – Т/Д критерий возможности самопроизвольного протекания процесса в изолированной системе. Если системе не
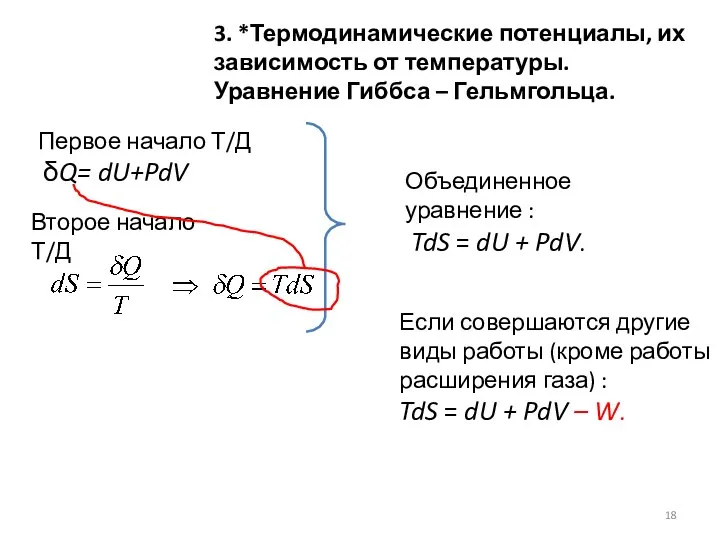
- 18. 3. *Термодинамические потенциалы, их зависимость от температуры. Уравнение Гиббса – Гельмгольца. Первое начало Т/Д δQ= dU+PdV
- 19. Работа процесса (работа хим. реакции) W = dU + PdV –TdS. Максимальная работа – в обратимых
- 20. Термодинамические потенциалы при разных условиях При P, T = const dU + PdV – TdS =
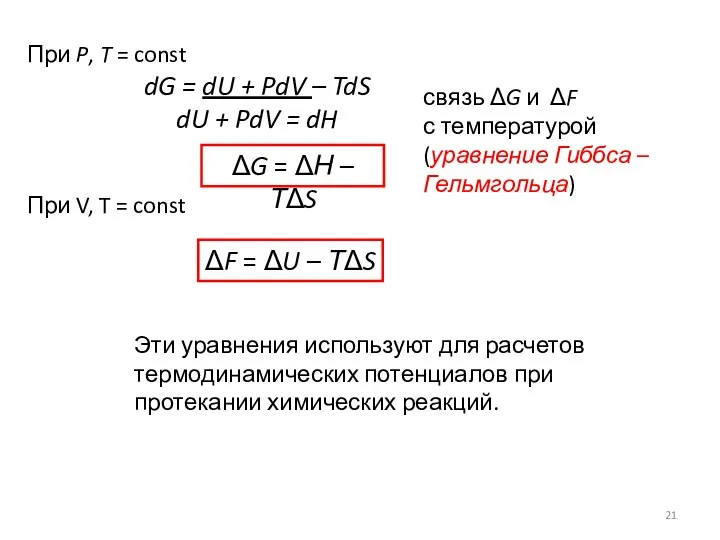
- 21. При P, T = const dG = dU + PdV – TdS dU + PdV =
- 22. Вычисление ΔGr реакции а) при 298 К: ΔGr0298 =ΔНr0298 – 298 ∆Sr0298. ΔНr0298 =∑vΔНf0298 прод –
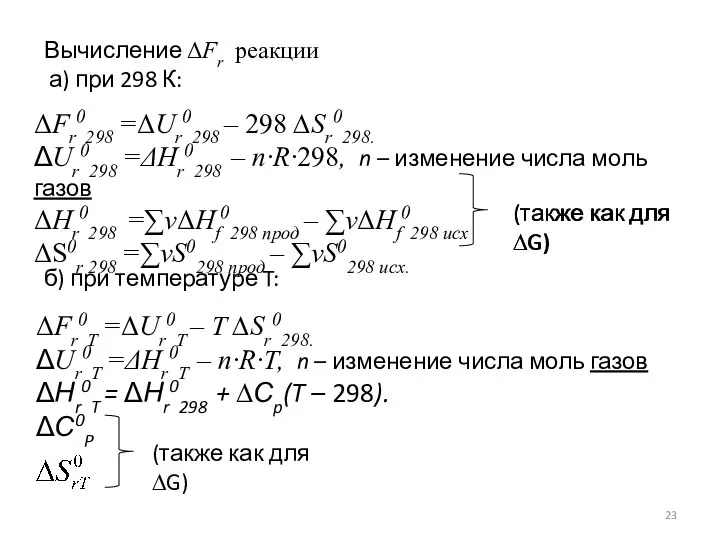
- 23. Вычисление ΔFr реакции а) при 298 К: ΔFr0298 =ΔUr0298 – 298 ∆Sr0298. ΔUr0298 =ΔНr0298 – n∙R∙298,
- 24. Пример: O2 (г) + 2 H2 (г) = 2H2O (г) ΔНr0298 (кДж/моль) - 241,8 S0298 (Дж/(моль∙К))
- 25. 5) Энергия Гиббса при 298 К ΔGr0298 ΔGr0298 =ΔНr0298 – 298 ∆Sr0298. = – 483600 –
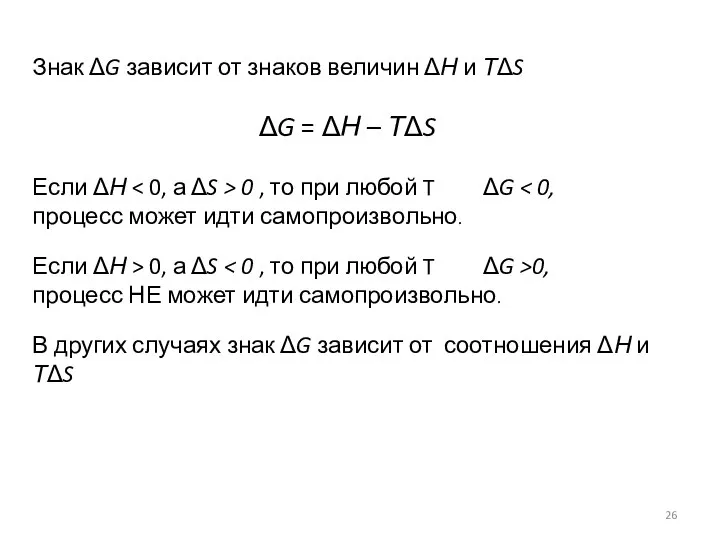
- 26. Знак ΔG зависит от знаков величин ΔН и ТΔS ΔG = ΔН – ТΔS Если ΔН
- 27. Если ΔG ( или ΔF) > 0, то процесс возможен только с затратой энергии : процесс
- 28. 4. Химические потенциалы. Уравнение Гиббса – Дюгема. Состав системы может изменяться (протекание реакций, перехода вещества из
- 29. dG является суммой вкладов μі компонентов, составляющих систему: уравнение Гиббса – Дюгема μі – вклад одного
- 30. Аналитическое выражение для химического потенциала Для газов: μ0 - стандартный химический потенциал (при стандартном давлении 1
- 31. Для растворов концентрация раствора C [моль/л] показывает во сколько раз концентрация раствора отличается от стандартной (в
- 32. В случае реальных газов и реальных растворов, где в отличие от идеальных нельзя пренебречь взаимодействием между
- 34. Скачать презентацию





















![Для растворов концентрация раствора C [моль/л] показывает во сколько раз концентрация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1390458/slide-30.jpg)

 Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила поведения зимой на воде
Правила поведения зимой на воде  Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ
Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Камень, скользящий на льду
Камень, скользящий на льду Химия
Химия Олигомеризация олефинов
Олигомеризация олефинов Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть
Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть  История возникновения химии
История возникновения химии Пластмассы. Классификация
Пластмассы. Классификация Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6)
Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6) Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде
Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде Углеводы
Углеводы  Каталитический риформинг
Каталитический риформинг Природний газ
Природний газ Химиялық қару
Химиялық қару Ферменты. Часть I
Ферменты. Часть I Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Технология пластических масс на основе поликонденсационных смол
Технология пластических масс на основе поликонденсационных смол Синтез и исследование метилольных и хлорметильных производных аллантоина
Синтез и исследование метилольных и хлорметильных производных аллантоина Нанохимия, как наука
Нанохимия, как наука Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Производство серной кислоты
Производство серной кислоты Основания. Простые и сложные ионы
Основания. Простые и сложные ионы