Содержание
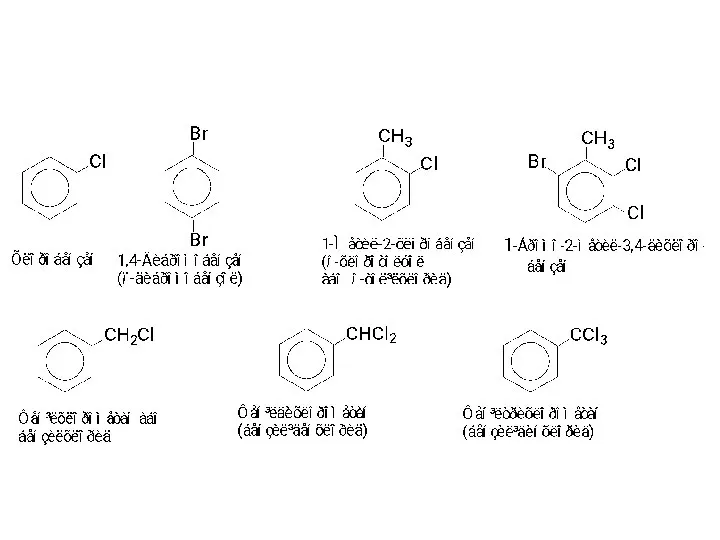
- 3. МЕТОДИ ОДЕРЖАННЯ Існують три основних способи одержання галогенопохідних ароматич-них вуглеводнів: 1 - заміщення атома водню на
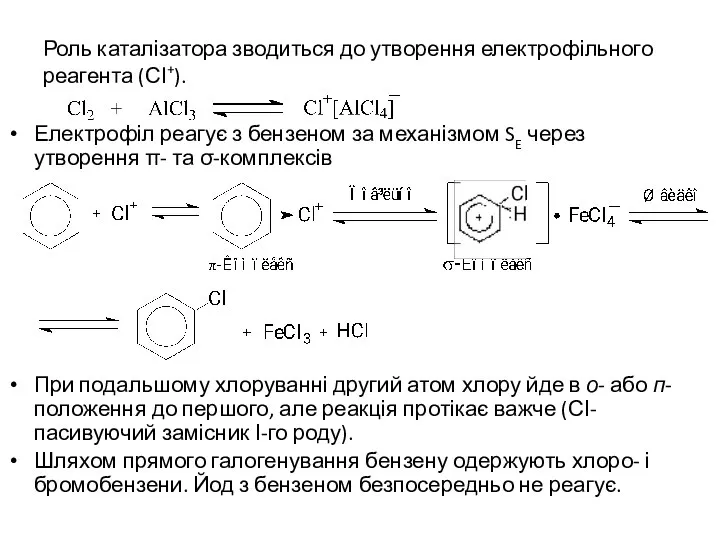
- 4. Роль каталізатора зводиться до утворення електрофільного реагента (СІ+). Електрофіл реагує з бензеном за механізмом SE через
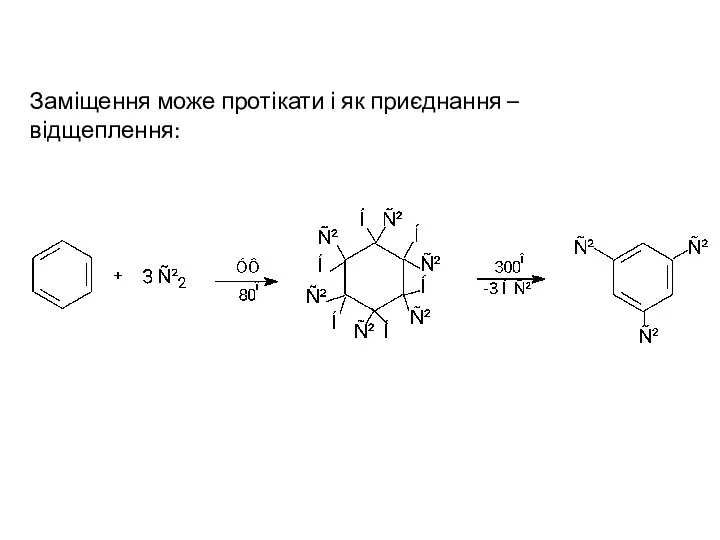
- 5. Заміщення може протікати і як приєднання – відщеплення:
- 6. 2. Заміщення атома водню на атом галогену в бічному ланцюзі Галогенування бічного ланцюга аренів протікає за
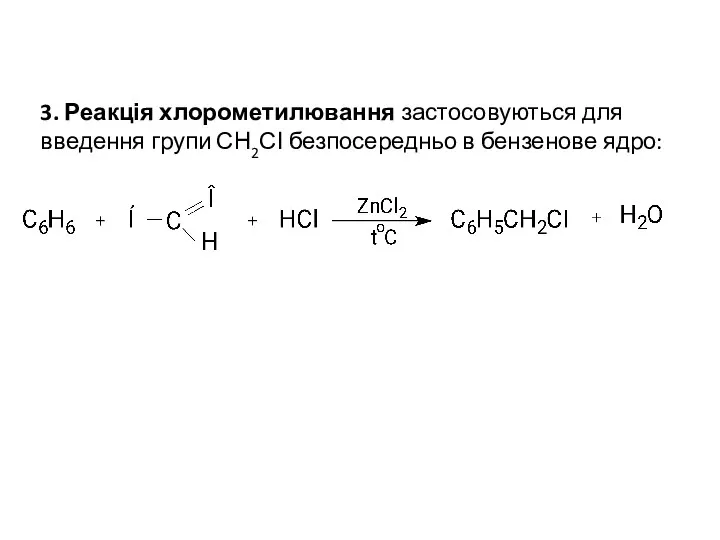
- 7. 3. Реакція хлорометилювання застосовуються для введення групи СН2СІ безпосередньо в бензенове ядро:
- 8. хімічні властивості Величини дипольних моментів у них менші, ніж у подібних галогеналканів. Це свідчить про меншу
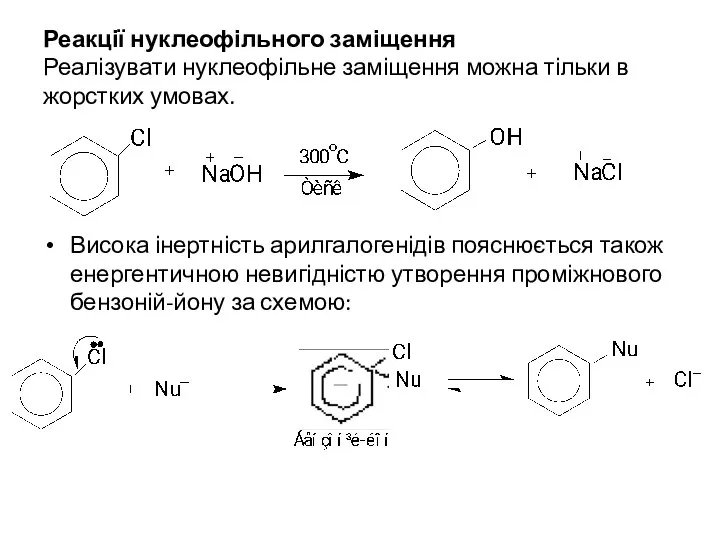
- 9. Реакції нуклеофільного заміщення Реалізувати нуклеофільне заміщення можна тільки в жорстких умовах. Висока інертність арилгалогенідів пояснюється також
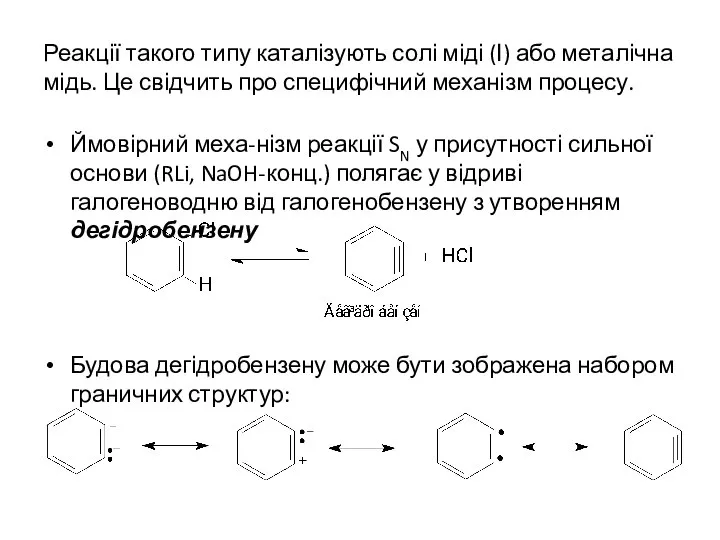
- 10. Реакції такого типу каталізують солі міді (І) або металічна мідь. Це свідчить про специфічний механізм процесу.
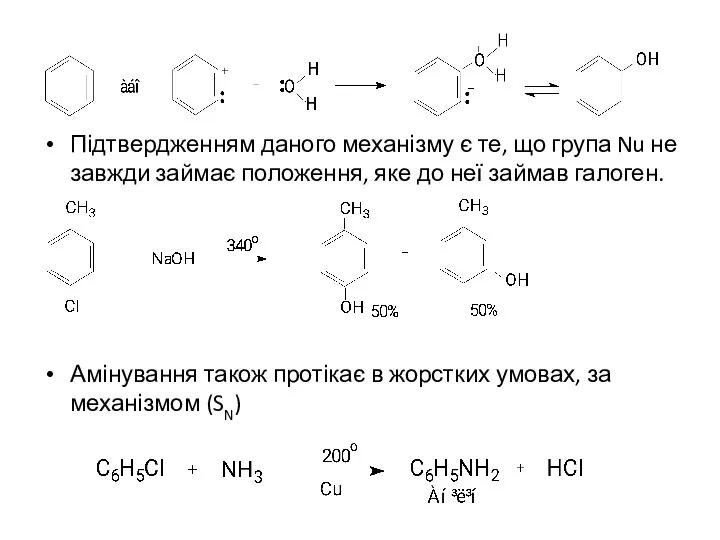
- 11. Підтвердженням даного механізму є те, що група Nu не завжди займає положення, яке до неї займав
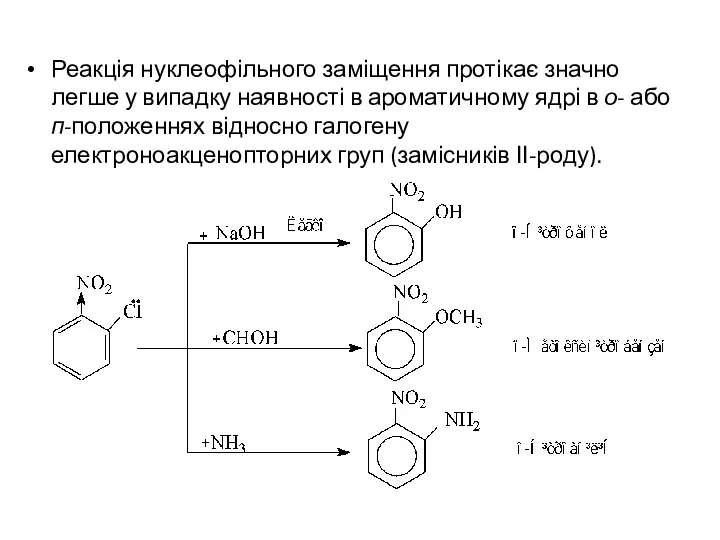
- 12. Реакція нуклеофільного заміщення протікає значно легше у випадку наявності в ароматичному ядрі в о- або п-положеннях
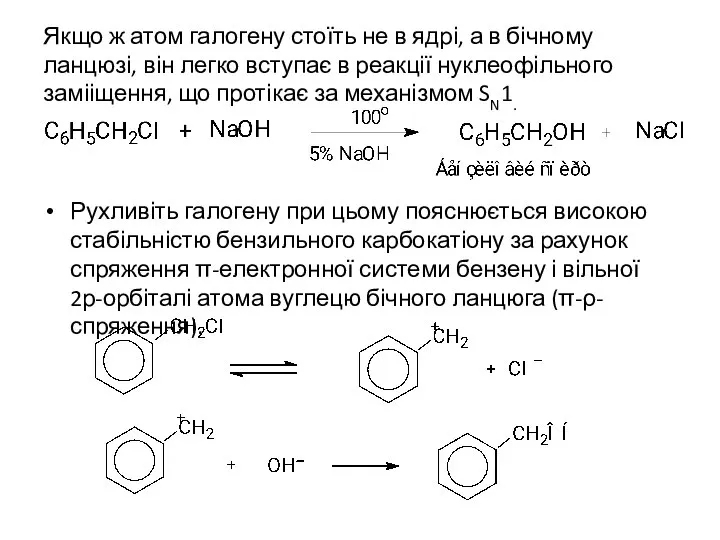
- 13. Якщо ж атом галогену стоїть не в ядрі, а в бічному ланцюзі, він легко вступає в
- 15. Скачать презентацию



 Хроматография
Хроматография Презентация Коррозия
Презентация Коррозия Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко
Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Кислоты в свете ТЭД
Кислоты в свете ТЭД Вуглецеві матеріали
Вуглецеві матеріали Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф
Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф  Коллоидная химия
Коллоидная химия Превращение веществ
Превращение веществ Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Платина. Свойства
Платина. Свойства Дифузія у побуті
Дифузія у побуті Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Атомы. Молекулы. Ионы
Атомы. Молекулы. Ионы Химическая связь
Химическая связь КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Осадительное титрование. (Лекция 11)
Осадительное титрование. (Лекция 11) Задачи в школьном курсе химии
Задачи в школьном курсе химии 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Альдегидтер және кетондар
Альдегидтер және кетондар Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение
Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение Обмен нуклеотидов
Обмен нуклеотидов Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Аминокислоты. Белки
Аминокислоты. Белки