Содержание
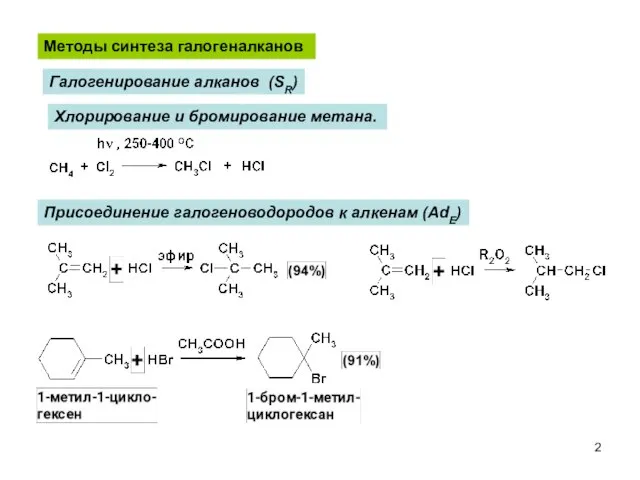
- 2. Хлорирование и бромирование метана. Методы синтеза галогеналканов Галогенирование алканов (SR) Присоединение галогеноводородов к алкенам (AdE)
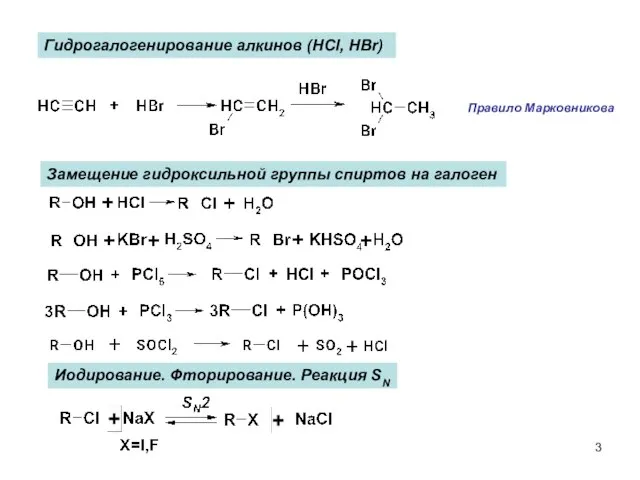
- 3. Замещение гидроксильной группы спиртов на галоген Иодирование. Фторирование. Реакция SN Гидрогалогенирование алкинов (HCl, HBr) Правило Марковникова
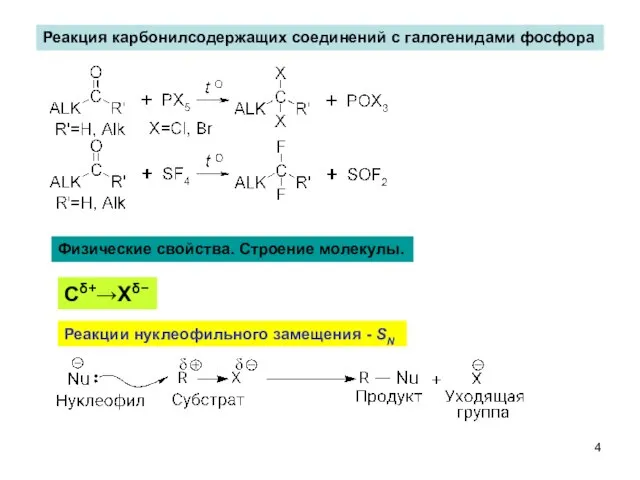
- 4. Реакция карбонилсодержащих соединений с галогенидами фосфора Физические свойства. Строение молекулы. Сδ+→Хδ− Реакции нуклеофильного замещения - SN
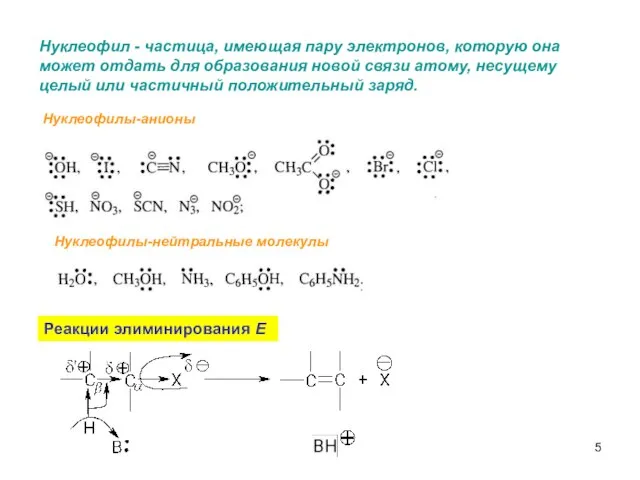
- 5. Нуклеофил - частица, имеющая пару электронов, которую она может отдать для образования новой связи атому, несущему
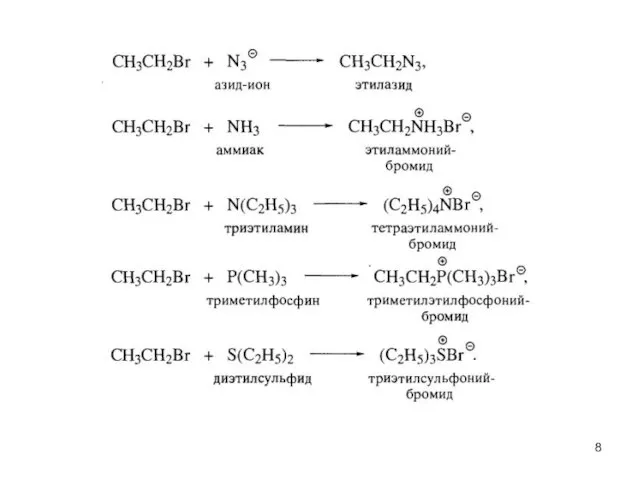
- 6. Нуклеофильное замещение R-Hal + Nu → R-Nu + Hal-
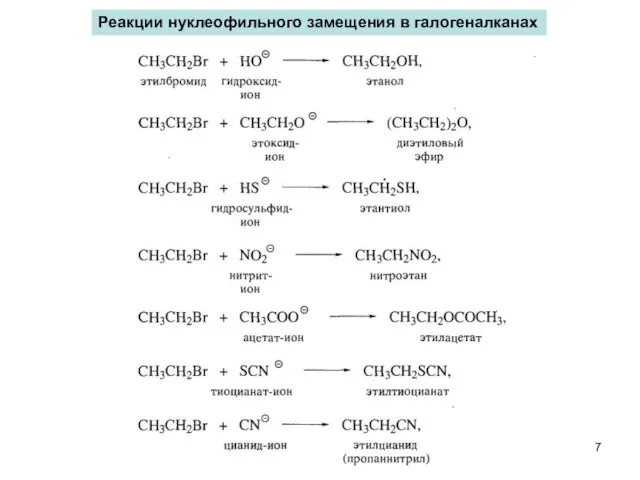
- 7. Реакции нуклеофильного замещения в галогеналканах
- 9. Бимолекулярное нуклеофильное замещение (SN2) Скорость реакции. v = k [R-Hal]·[Nu] Концентрация нуклеофильного реагента, сила нуклеофила Растворитель.
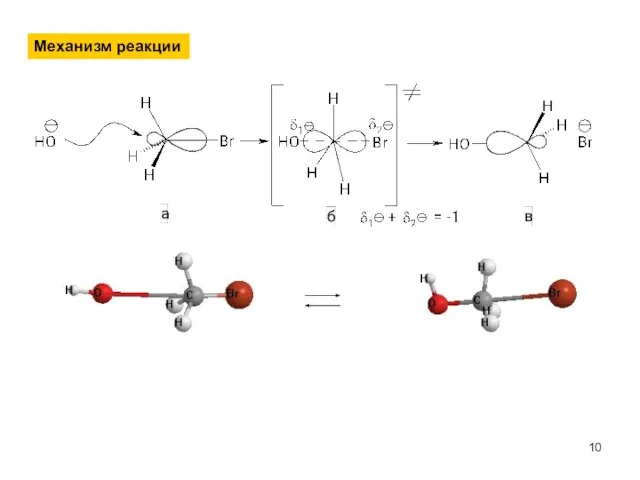
- 10. Механизм реакции
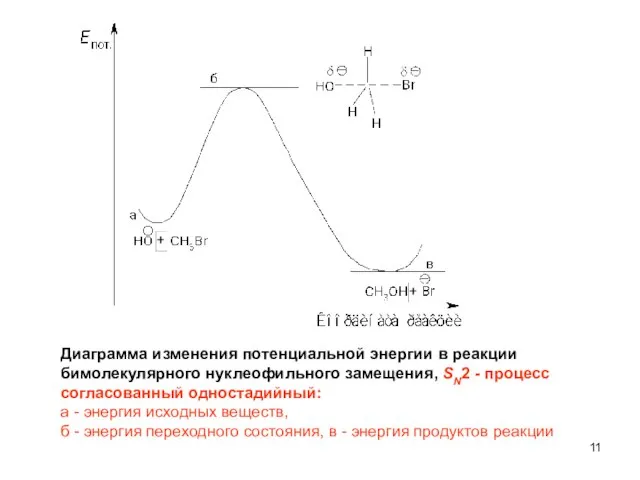
- 11. Диаграмма изменения потенциальной энергии в реакции бимолекулярного нуклеофильного замещения, SN2 - процесс согласованный одностадийный: а -
- 12. Нуклеофил – нейтральная молекула Влияние полярности растворителя на скорость SN2: повышение полярности растворителя стабилизирует АК в
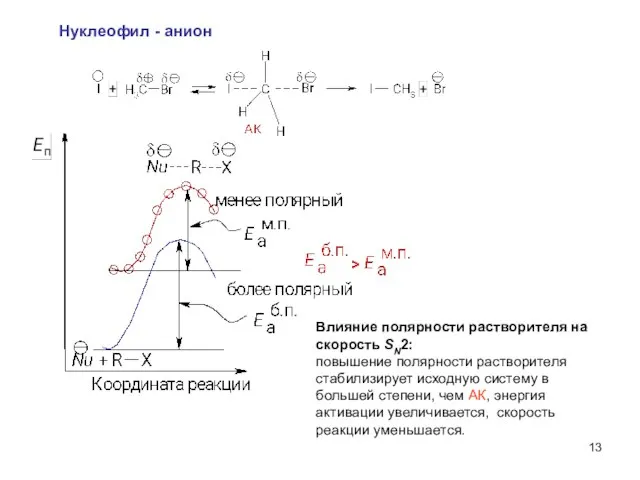
- 13. Нуклеофил - анион Влияние полярности растворителя на скорость SN2: повышение полярности растворителя стабилизирует исходную систему в
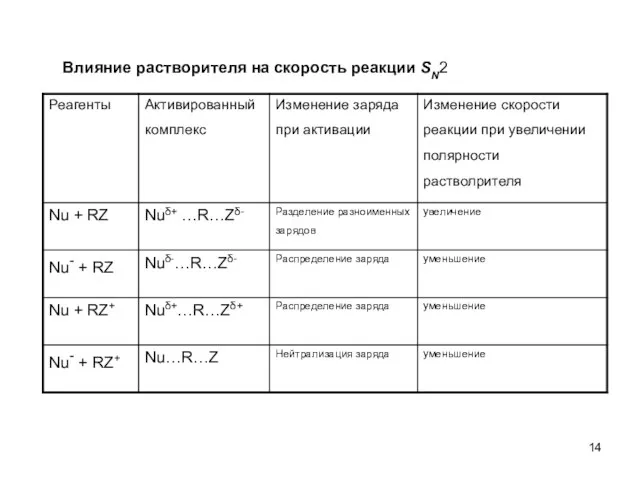
- 14. Влияние растворителя на скорость реакции SN2
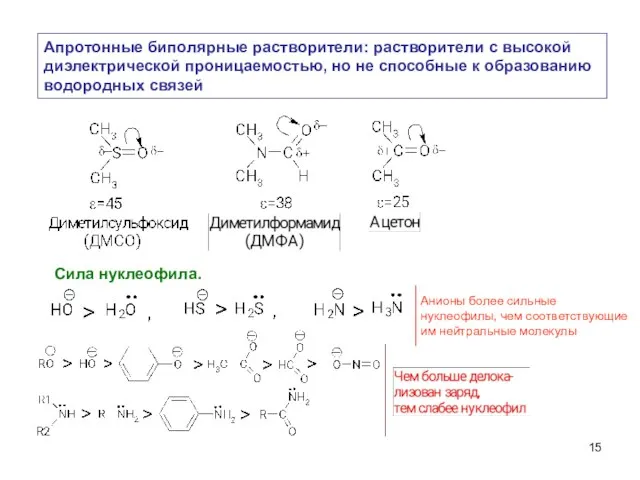
- 15. Апротонные биполярные растворители: растворители с высокой диэлектрической проницаемостью, но не способные к образованию водородных связей Сила
- 16. В апротонных растворителях (ДМФА, ДМСО) реакционная способность нуклеофилов с атомами, находящимися в одной группе, зависит от
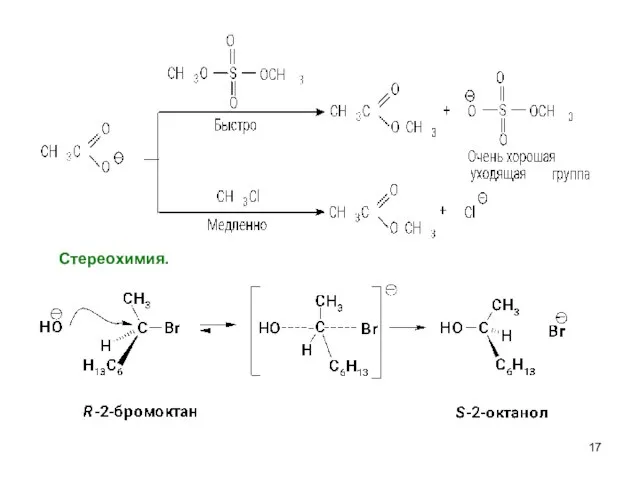
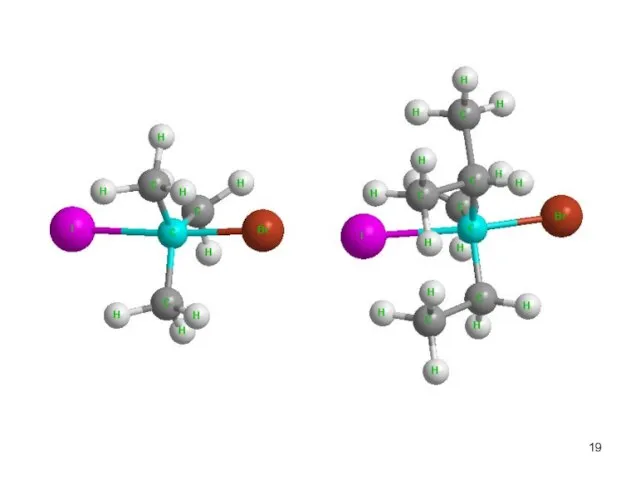
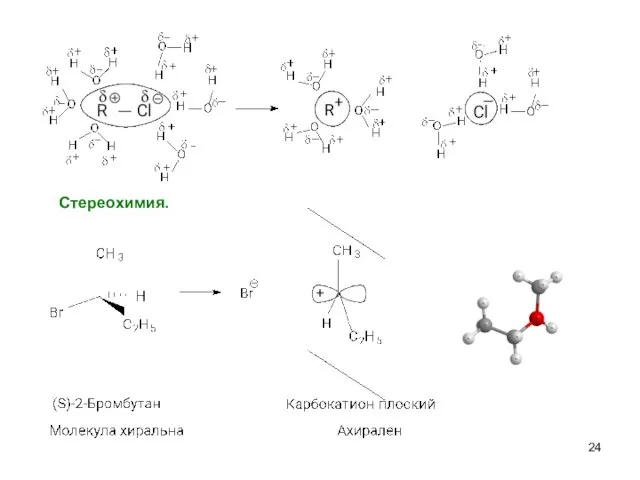
- 17. Cтереохимия.
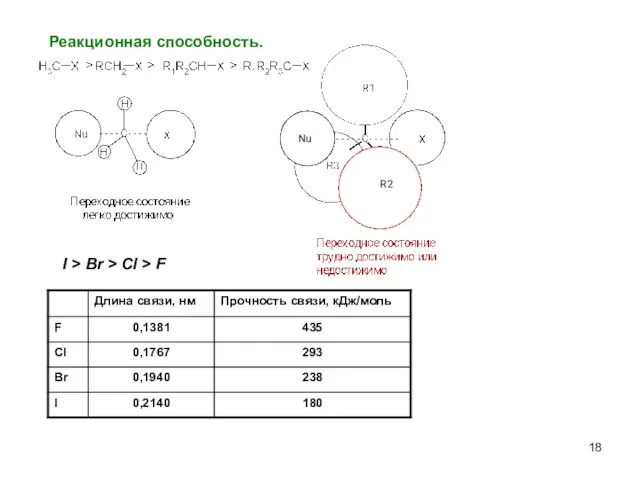
- 18. Реакционная способность. I > Br > Cl > F
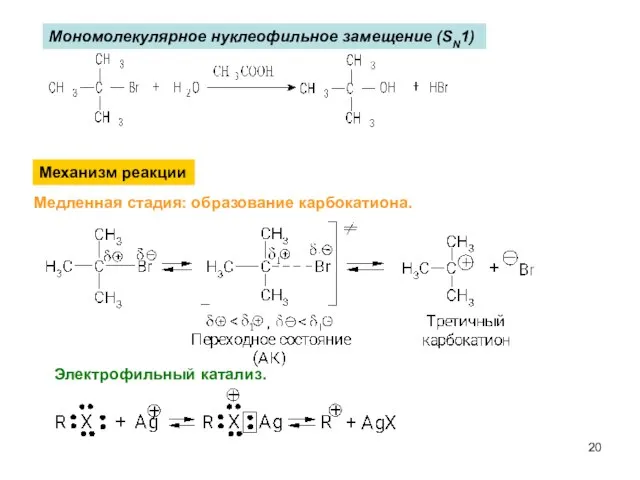
- 20. Мономолекулярное нуклеофильное замещение (SN1) Механизм реакции Медленная стадия: образование карбокатиона. Электрофильный катализ.
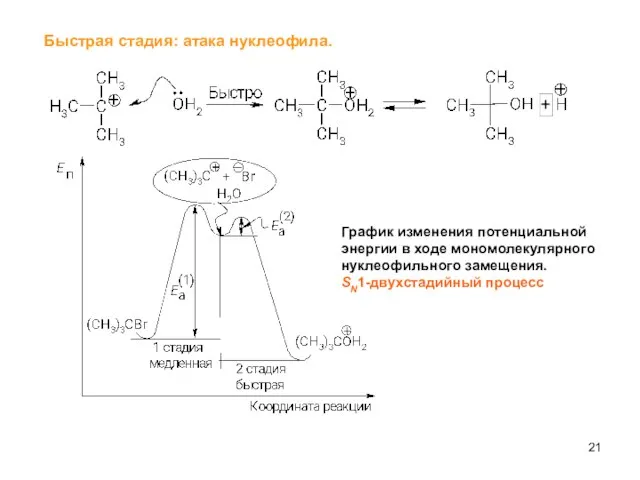
- 21. Быстрая стадия: атака нуклеофила. График изменения потенциальной энергии в ходе мономолекулярного нуклеофильного замещения. SN1-двухстадийный процесс
- 22. Перегруппировка – признак механизма SN1. Механизм перегруппировки. Скорость реакции. v= k[R-Hal] Концентрация нуклеофильного реагента.
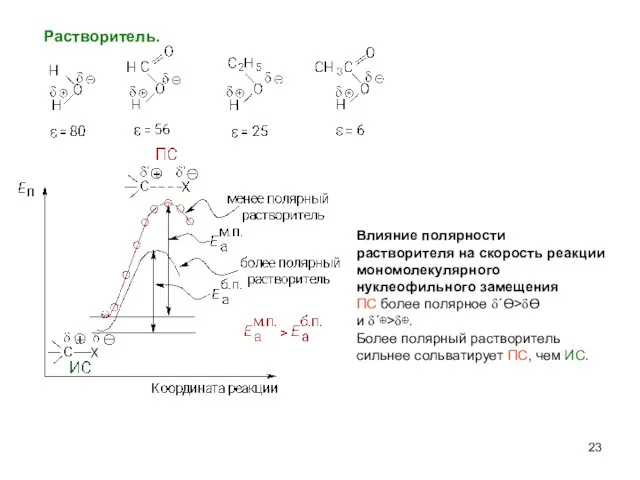
- 23. Растворитель. Влияние полярности растворителя на скорость реакции мономолекулярного нуклеофильного замещения ПC более полярное δ΄Ө>δӨ и δ΄⊕>δ⊕.
- 24. Стереохимия.
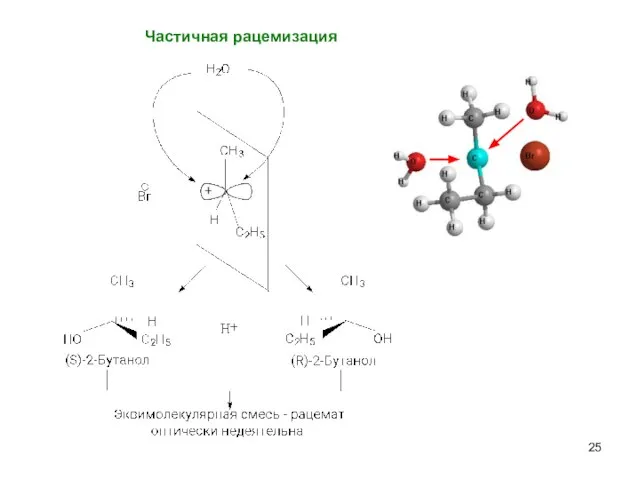
- 25. Частичная рацемизация
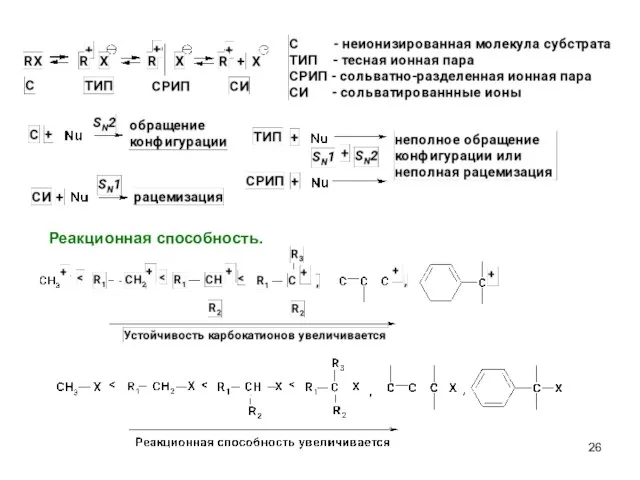
- 26. Реакционная способность.
- 27. Нуклеофильность и основность Нуклеофильность Кинетически контролируемая реакция электронной пары донора с электрофильным атомом (С), с образованием
- 28. Сравнение реакций SN1 и SN2 Влияние условий реакции на соотношение двух механизмов.
- 29. Амбидентные ионы На атомах с большей электроотрицательностью сосредоточена большая электронная плотность. Атомы с меньшей электроотрицательностью обладают
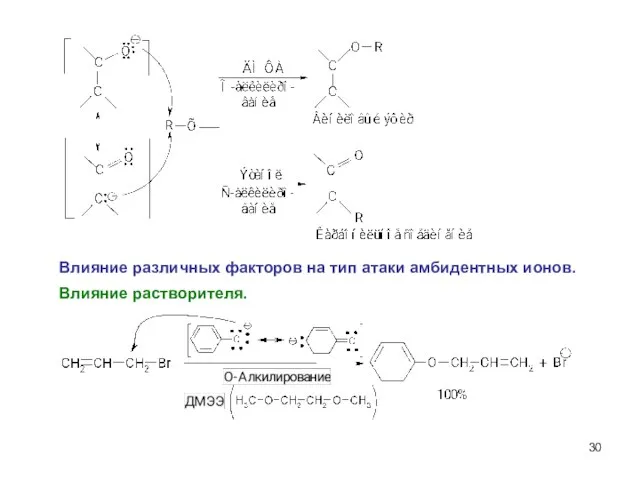
- 30. Влияние растворителя. Влияние различных факторов на тип атаки амбидентных ионов.
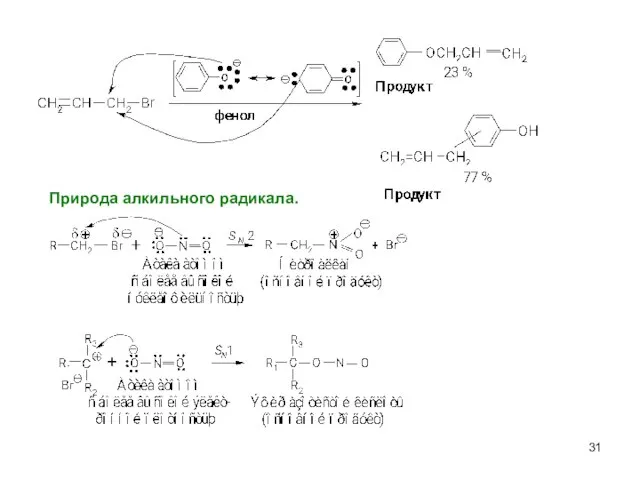
- 31. Природа алкильного радикала.
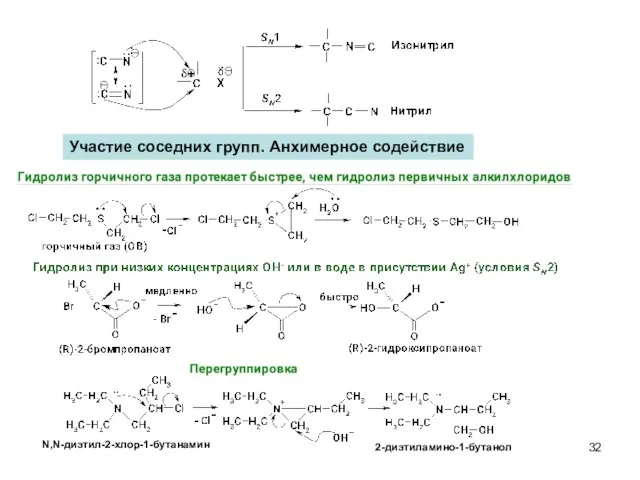
- 32. Участие соседних групп. Анхимерное содействие N,N-диэтил-2-хлор-1-бутанамин 2-диэтиламино-1-бутанол
- 33. Реакции отщепления (элиминирование, Е) -Элиминирование -Элиминирование γ-Элимириование – циклизация.
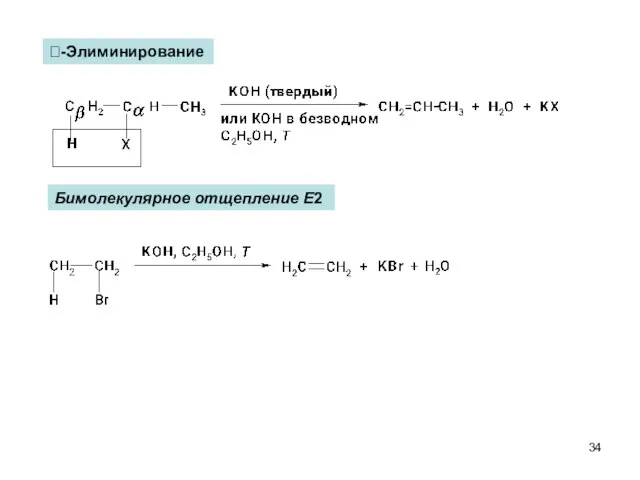
- 34. -Элиминирование Бимолекулярное отщепление Е2
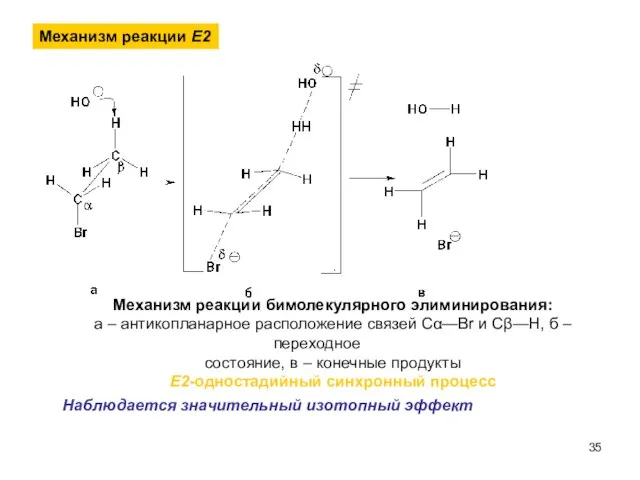
- 35. Механизм реакции Е2 Механизм реакции бимолекулярного элиминирования: а – антикопланарное расположение связей Сα—Br и Сβ—H, б
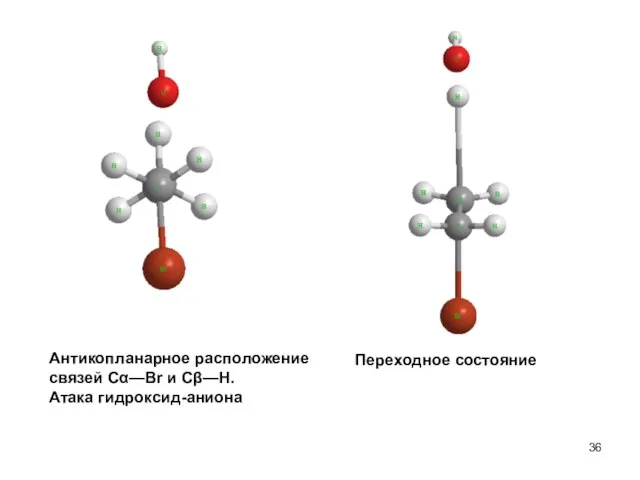
- 36. Антикопланарное расположение связей Сα—Br и Сβ—H. Атака гидроксид-аниона Переходное состояние
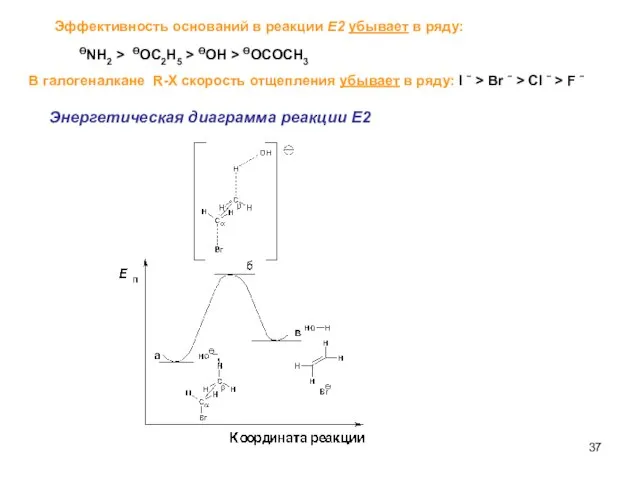
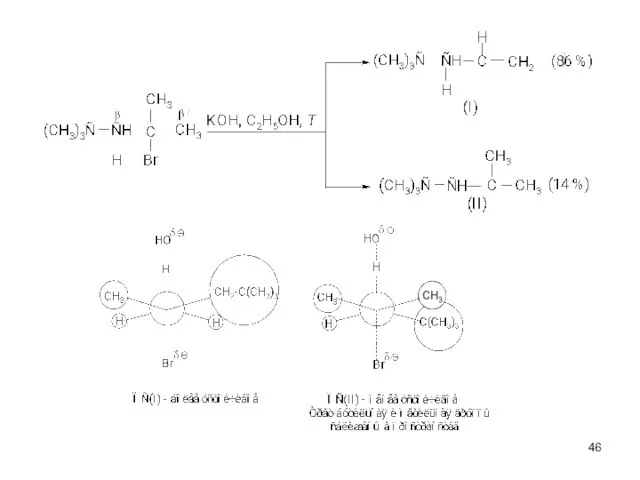
- 37. Эффективность оснований в реакции Е2 убывает в ряду: ӨNH2 > ӨOC2H5 > ӨOH > ӨOCOCH3 В
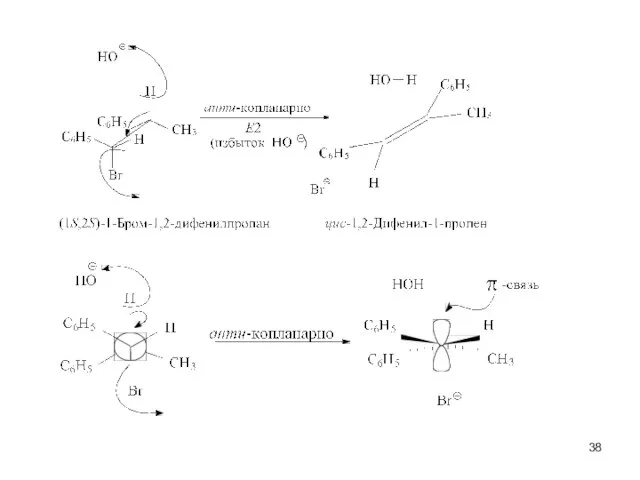
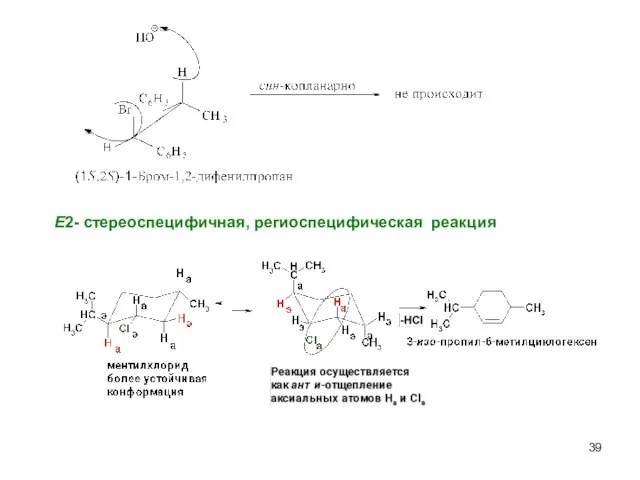
- 39. Е2- стереоспецифичная, региоспецифическая реакция
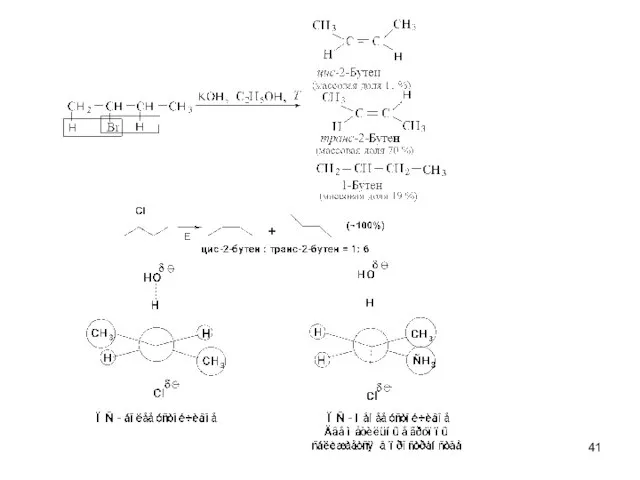
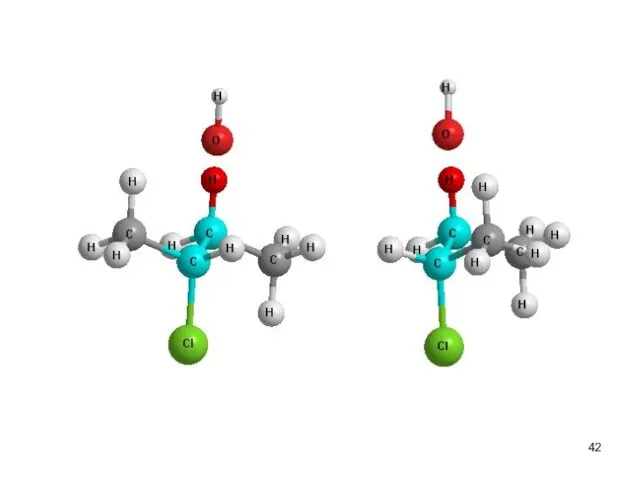
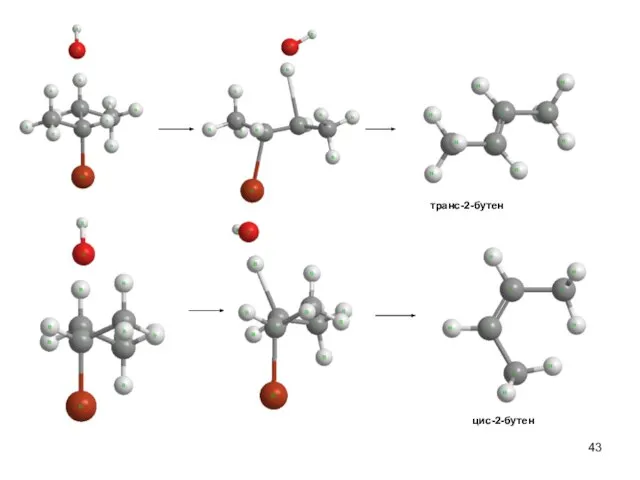
- 40. Скорость реакции V(E2) = k΄ [R-Br] [OНӨ] V (SN2)= k[R-Br] [OНӨ] Правило Зайцева Основным продуктом реакции
- 43. транс-2-бутен цис-2-бутен
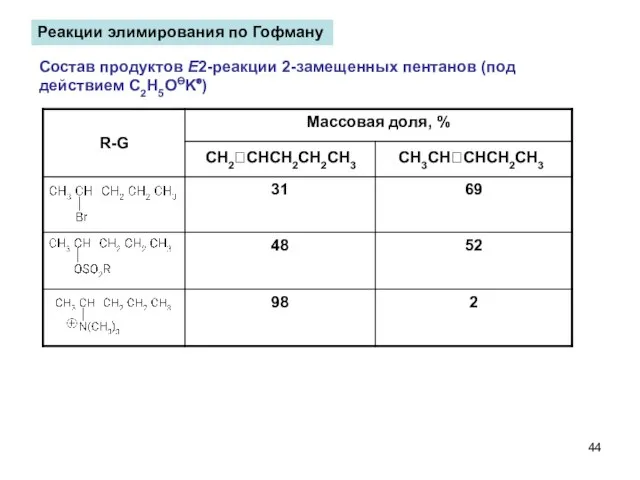
- 44. Реакции элимирования по Гофману Состав продуктов Е2-реакции 2-замещенных пентанов (под действием C2H5OӨK⊕) CH2CHCH2CH2CH3 CH3CHCHCH2CH3
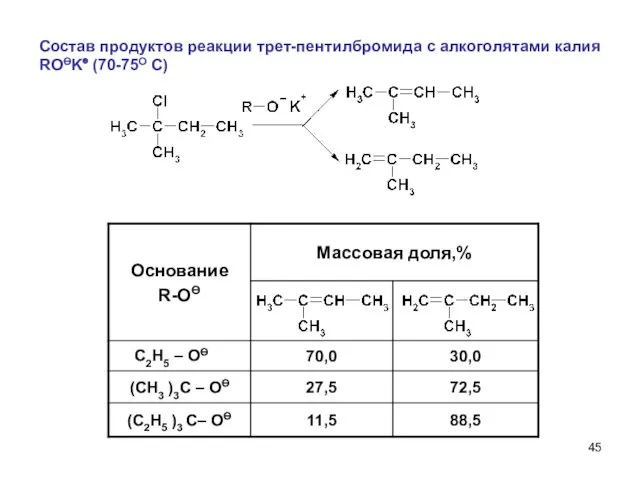
- 45. Состав продуктов реакции трет-пентилбромида с алкоголятами калия ROӨK⊕ (70-75О С) C2H5 – OӨ
- 47. Реакционная способность Мономолекулярное отщепление Е1 Механизм. Этот ряд объясняется возрастающим числом алкильных групп при двойной связи
- 48. Уравнение скорости реакции. v(E1) = k[R-Br] Реакционная способность I > Br > Cl > F
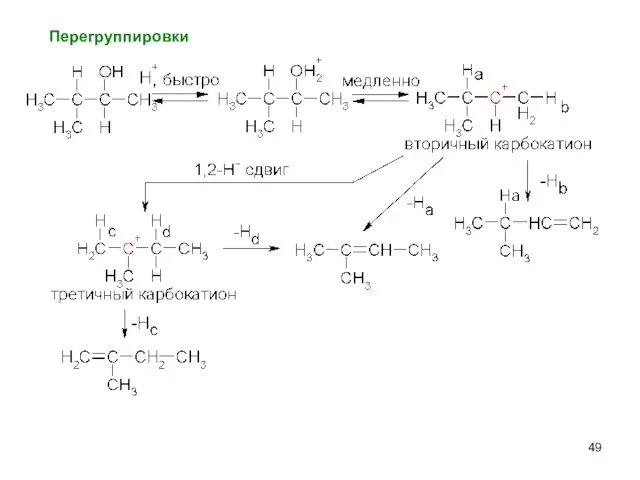
- 49. Перегруппировки
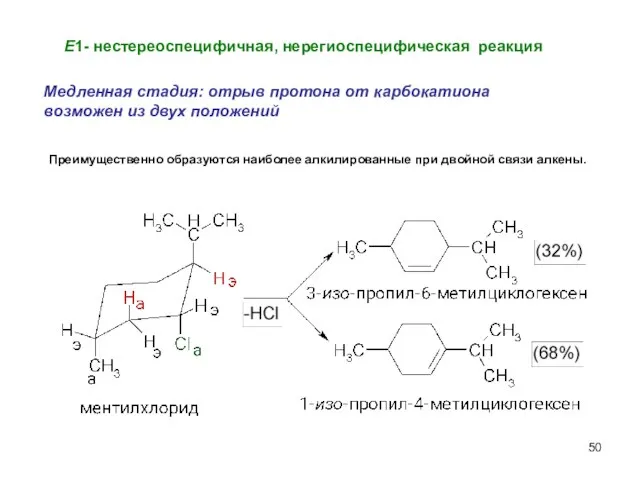
- 50. Е1- нестереоспецифичная, нерегиоспецифическая реакция Медленная стадия: отрыв протона от карбокатиона возможен из двух положений Преимущественно образуются
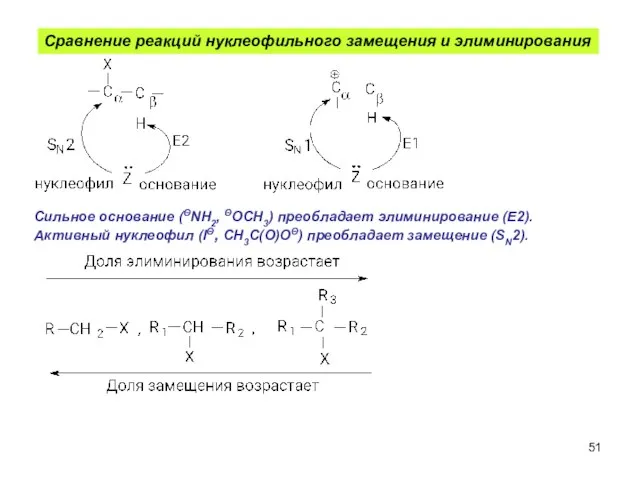
- 51. Сравнение реакций нуклеофильного замещения и элиминирования Сильное основание (ΘNH2, ΘOCH3) преобладает элиминирование (Е2). Активный нуклеофил (IΘ,
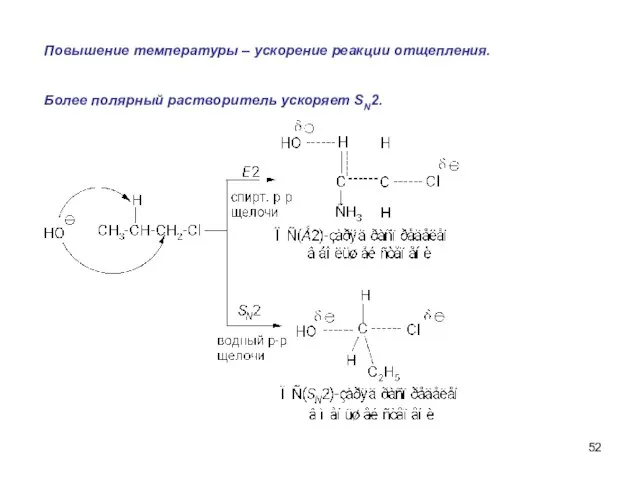
- 52. Повышение температуры – ускорение реакции отщепления. Более полярный растворитель ускоряет SN2.
- 53. Замещение при Сβ ускоряет реакцию элиминирования, т.к. образуется более Устойчивый (более алкилированный) алкен.
- 55. Скачать презентацию

![Бимолекулярное нуклеофильное замещение (SN2) Скорость реакции. v = k [R-Hal]·[Nu] Концентрация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/503352/slide-8.jpg)


![Перегруппировка – признак механизма SN1. Механизм перегруппировки. Скорость реакции. v= k[R-Hal] Концентрация нуклеофильного реагента.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/503352/slide-21.jpg)




![Скорость реакции V(E2) = k΄ [R-Br] [OНӨ] V (SN2)= k[R-Br] [OНӨ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/503352/slide-39.jpg)

![Уравнение скорости реакции. v(E1) = k[R-Br] Реакционная способность I > Br > Cl > F](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/503352/slide-47.jpg)

 Качественный анализ дубильных веществ
Качественный анализ дубильных веществ Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары
Металдар мен бейметалдардың табиғатта таралуы. ҚР-дағы кен орындары Жиры. История открытия жиров
Жиры. История открытия жиров Игра «Химические элементы» (формулы и названия)
Игра «Химические элементы» (формулы и названия) Жидкокристаллический монитор
Жидкокристаллический монитор Дифракционные методы исследований наноматериалов
Дифракционные методы исследований наноматериалов Комбинированные задачи. Задание 34
Комбинированные задачи. Задание 34 ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии
Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии Природные полимеры и продукты их химических превращений
Природные полимеры и продукты их химических превращений Щелочные металлы
Щелочные металлы Симметрия кристаллов, текстур и элементы кристаллофизики
Симметрия кристаллов, текстур и элементы кристаллофизики Кислород
Кислород Презентация к дистанционному уроку, уроку, внеклассному мероприятию, по химии «Предельные одноатомные спирты»
Презентация к дистанционному уроку, уроку, внеклассному мероприятию, по химии «Предельные одноатомные спирты» Физическая и коллоидная химия
Физическая и коллоидная химия Стан, роль і місце органічної хімії в сучасній хімічній освіті.
Стан, роль і місце органічної хімії в сучасній хімічній освіті.  Презентация по Химии "Драгоценные и поделочные камни - соединения кремния" - скачать смотреть
Презентация по Химии "Драгоценные и поделочные камни - соединения кремния" - скачать смотреть  Галогены. Физические свойства
Галогены. Физические свойства VI группа периодической системы. VIA-группа
VI группа периодической системы. VIA-группа Пищевая биотехнология
Пищевая биотехнология ЛЕКЦИЯ 1. Основы токсикологической химии
ЛЕКЦИЯ 1. Основы токсикологической химии  Свойства морской воды
Свойства морской воды Органическая химия. Жиры
Органическая химия. Жиры Оксиды углерода
Оксиды углерода Алкадиены. Состав и строение
Алкадиены. Состав и строение Неметаллы и их соединения
Неметаллы и их соединения Пищевые добавки и добавки к пище
Пищевые добавки и добавки к пище Электролиз
Электролиз