Содержание
- 2. Объединены под общим названием галогенные вещества. Фтор, хлор, бром, йод, астат.
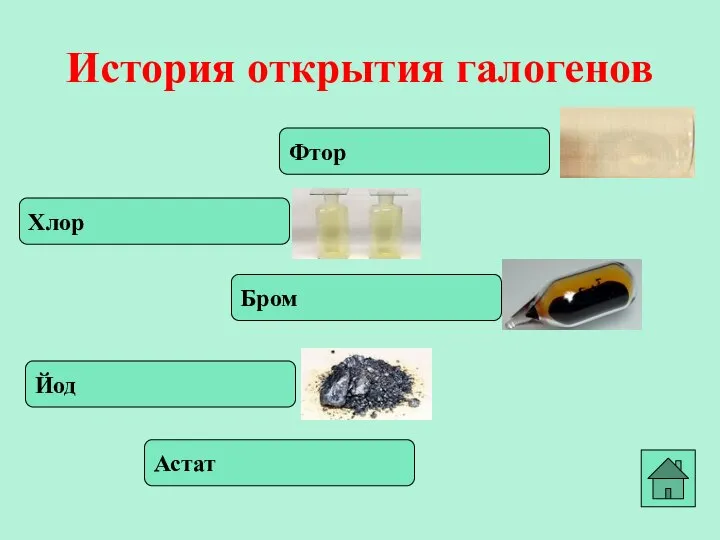
- 3. Фтор История открытия галогенов Хлор Бром Йод Астат
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
- 9. Существуют только в связанном состоянии.
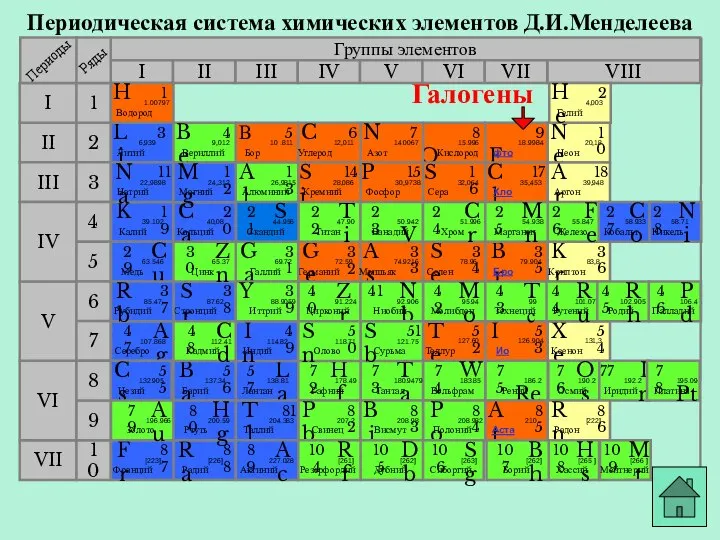
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 11. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 12. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 13. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 14. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 15. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 16. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 17. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с
- 18. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 19. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 20. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
- 21. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 →
- 22. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 23. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
- 24. Биологические значение галогенов И их применение.
- 25. Фтор содержится в зубной пасте, которая защищает от кариеса.
- 26. Хлор попадает в организм в виде NaCl стимулирует обмен веществ, рост волос, придаёт силу и бодрость
- 27. Бром. Его соединения регулируют процессы нервной системы. Бром активно накапливают растения, в том числе водоросли. Главным
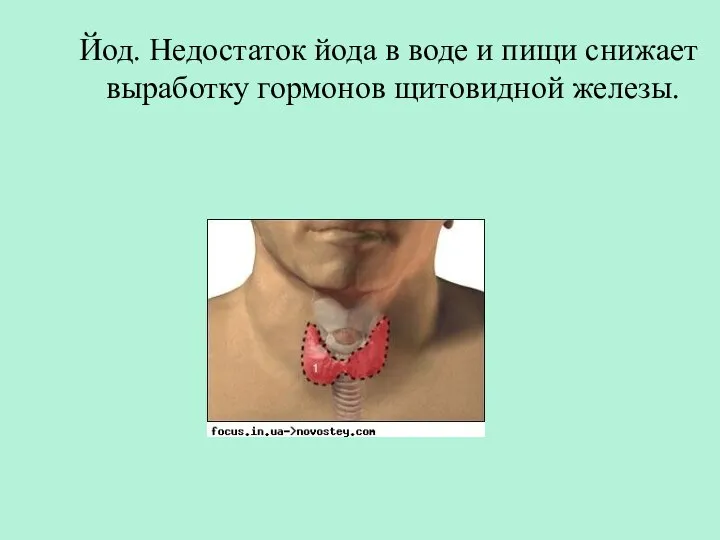
- 28. Йод. Недостаток йода в воде и пищи снижает выработку гормонов щитовидной железы.
- 29. Йод поступает в организм вместе с пищей: хлебом, яйцом, молоком, водой, с морской капустой и с
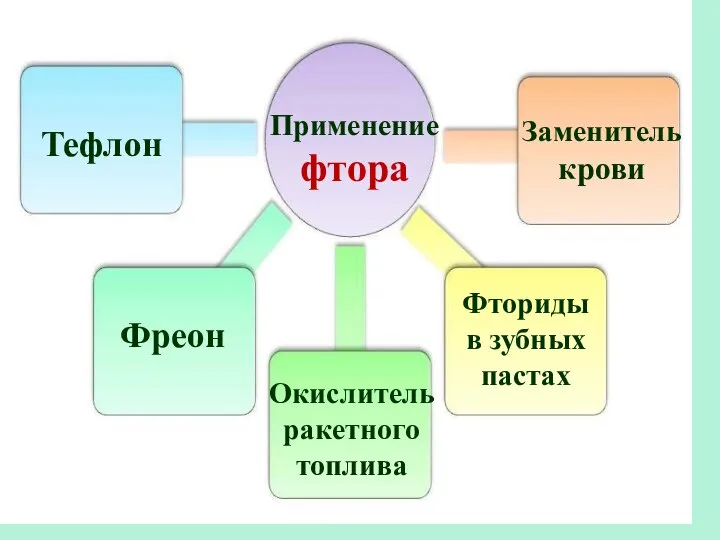
- 30. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
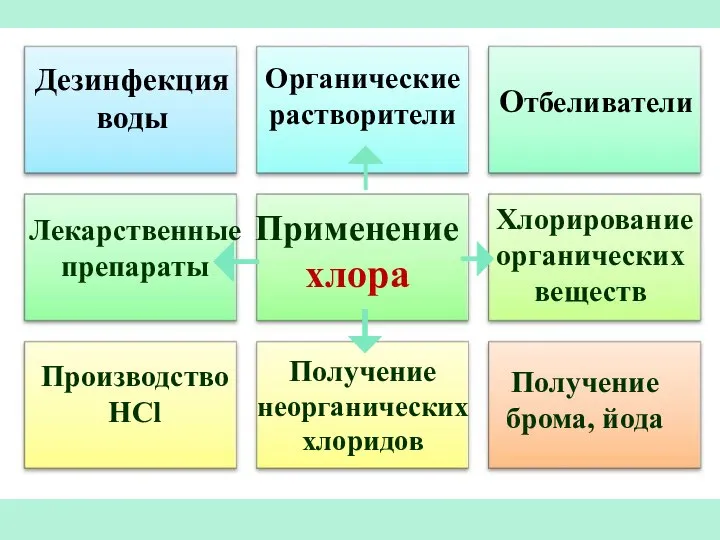
- 31. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
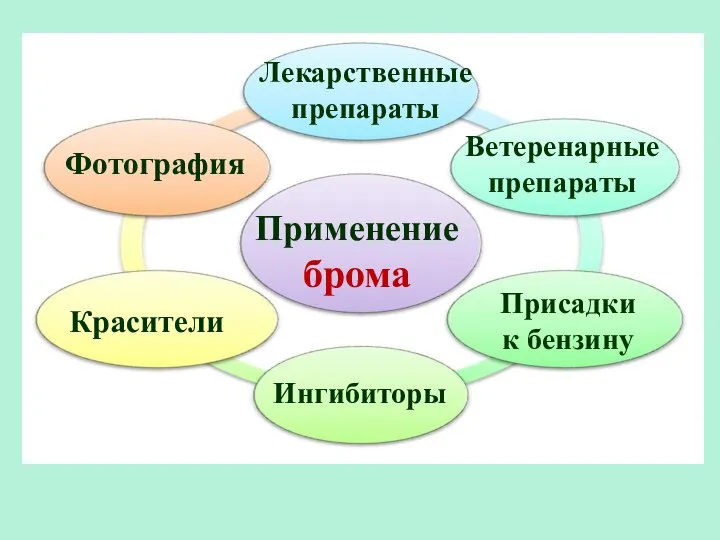
- 32. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
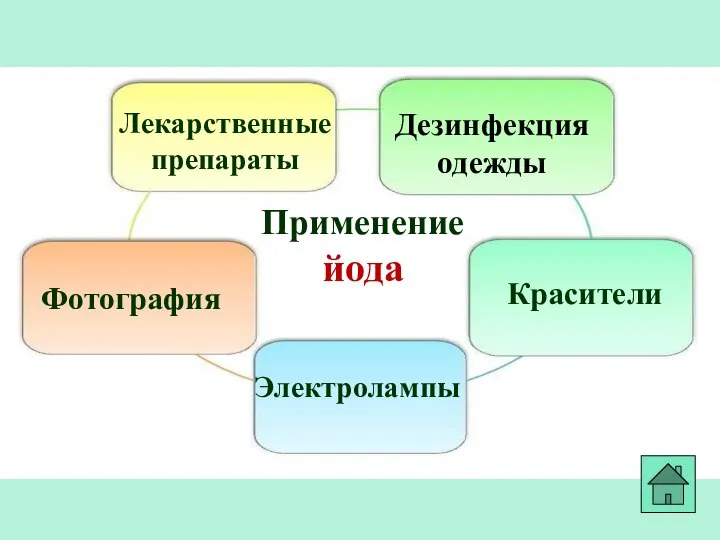
- 33. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 34. В промышленности фтор и хлор получают электролизом расплавов и растворов их солей. Бор и йод получают
- 36. Скачать презентацию


























 Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал
Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Робота учня 11-В класу: Андрійка Андрія
Робота учня 11-В класу: Андрійка Андрія  Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Общенаучные методы исследований
Общенаучные методы исследований Iodine
Iodine Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Химические свойства карбокатионов
Химические свойства карбокатионов Симметрия физических свойств кристаллов
Симметрия физических свойств кристаллов Оксокислоти. Номенклатура
Оксокислоти. Номенклатура Комплексні сполуки
Комплексні сполуки Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно
Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно Железо
Железо Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев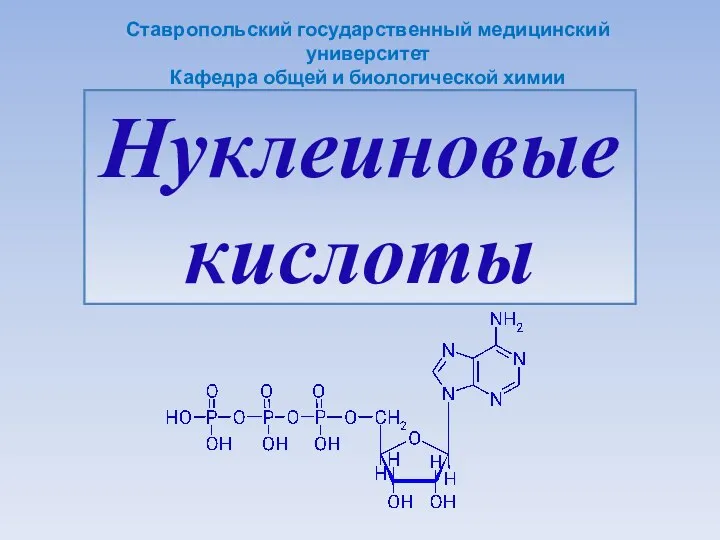 Нуклеиновые кислоты
Нуклеиновые кислоты Неорганические полимеры
Неорганические полимеры Камни и Стрелец
Камни и Стрелец Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Кислоты
Кислоты Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) Пестицидтердің қоршаған ортаға тигізетін әсері
Пестицидтердің қоршаған ортаға тигізетін әсері Гидродинамика (процессы и аппараты химической технологии, 3 лекция)
Гидродинамика (процессы и аппараты химической технологии, 3 лекция) Характеристика ядов, изолируемых водой в клинической фармации
Характеристика ядов, изолируемых водой в клинической фармации