Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Содержание
- 2. Содержание Цель работы Характеристика объектов исследования Приборы (или оборудование) и материалы Порядок выполнения Результаты измерений Выводы
- 3. Цель работы 1.1 Освоить метод объемного титрования. 1.2 Научиться определять концентрацию исследуемого раствора по раствору известной
- 4. 2. Характеристика объекта исследования Объектом исследования в данной работе является Раствор щелочи С теор. Концентрации: 1
- 5. 3. Оборудование и материалы Коническая колба, емк. 250 мл – 2 шт. Пипетка измерительная на 10
- 6. Оборудование и материалы Установочный раствор – р-р NaOH или KOH Титрант или раствор заданной концентрации -
- 7. 4. Порядок выполнения работы Приготовьте раствор щелочи заданной концентрации. Для этого рассчитайте навеску щелочи, взвести её
- 8. К раствору щелочи медленно, небольшими порциями при тщательном перемешивании из бюретки приливайте раствор соляной кислоты до
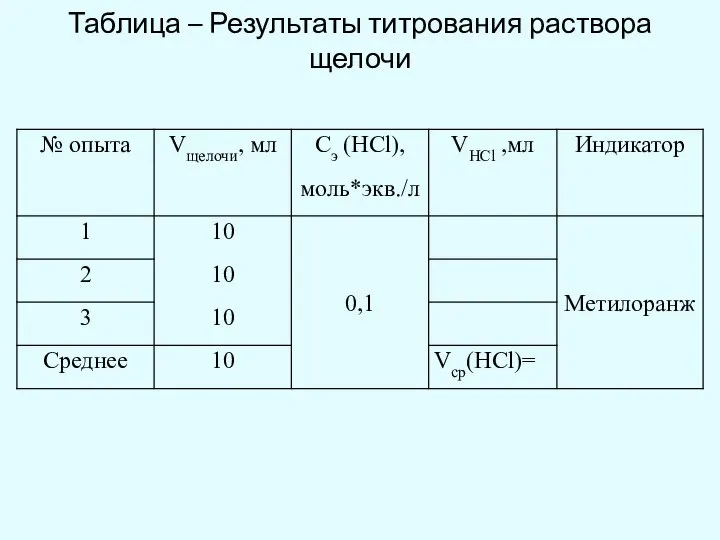
- 9. Таблица – Результаты титрования раствора щелочи
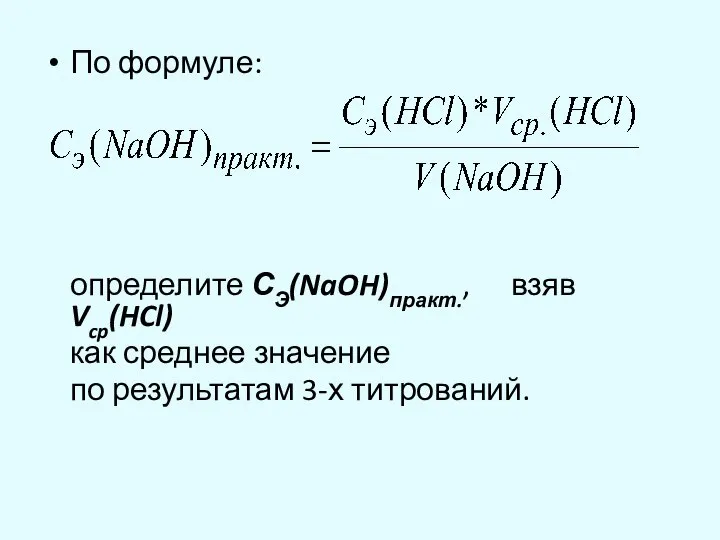
- 10. По формуле: определите СЭ(NaOH)практ., взяв Vcp(HCl) как среднее значение по результатам 3-х титрований.
- 11. Оцените погрешность Ваших измерений: По формулам пересчета рассчитайте концентрацию приготовленного Вами раствора. По проделанной работе и
- 12. Защита лабораторной работы № 1 проводится по теоретическим вопросам метода нейтрализации, формулам пересчета концентраций растворов химических
- 13. Содержание работы 1. Цель работы порядок выполнения работы результаты исследований 3 Выводы Список использованных источников
- 14. 1.1 Растворы. Способы выражения концентрации растворов Растворы – гомогенные (однородные) системы переменного состава, которые содержат два
- 15. Растворимость вещества выражают в граммах на литр (г/л). По растворимости в воде вещества делятся на три
- 16. Малорастворимые вещества – это вещества, растворимость которых составляет от 0,01 до 10 г на 1 л
- 17. Способы выражения концентрации Молярная концентрация – это число молей растворенного вещества n(X) в 1 л раствора
- 18. Способы выражения концентрации Молярная концентрация эквивалента (эквивалентная концентрация) – число эквивалентных масс (nэ(Х)), растворенного в 1
- 19. Способы выражения концентрации Фактор эквивалентности - число, показывающее, какая доля реальной частицы вещества X эквивалентна одному
- 20. Способы выражения концентрации Массовая доля (массовая процентная концентрация ϖ%) - отношение массы данного компонента в растворе
- 21. Все виды концентраций пропорциональны друг другу, следовательно, можно от одного способа выражения концентрации перейти к другому.
- 22. Количественный анализ. Метод нейтрализации Метод нейтрализации позволяет по результатам титрования определить точную концентрацию компонента кислотного или
- 23. Количественный анализ. Метод нейтрализации Теоретически основой метода является закон эквивалентов: массы реагирующих веществ пропорциональны их молярным
- 24. Количественный анализ. Метод нейтрализации В качестве рабочих растворов в методе нейтрализации используют: титрованный раствор НСl (или
- 25. Зная объем исследуемого раствора щелочи (Vисслед. щелочи), молярную концентрацию эквивалента кислоты (Сэ(НСl)), экспериментально определив VHCl, можно
- 26. 2 Практическая часть Цель работы: освоить титрометрический метод анализа; научиться определять концентрации исследуемого раствора
- 27. Порядок выполнения работы Приготовьте раствор щелочи (KOH или NaOH) заданной преподавателем концентрации (Стеор.). Для этого рассчитайте
- 28. Порядок выполнения работы В коническую колбу для титрования пипеткой отмерьте 10 мл, приготовленного Вами раствора щелочи
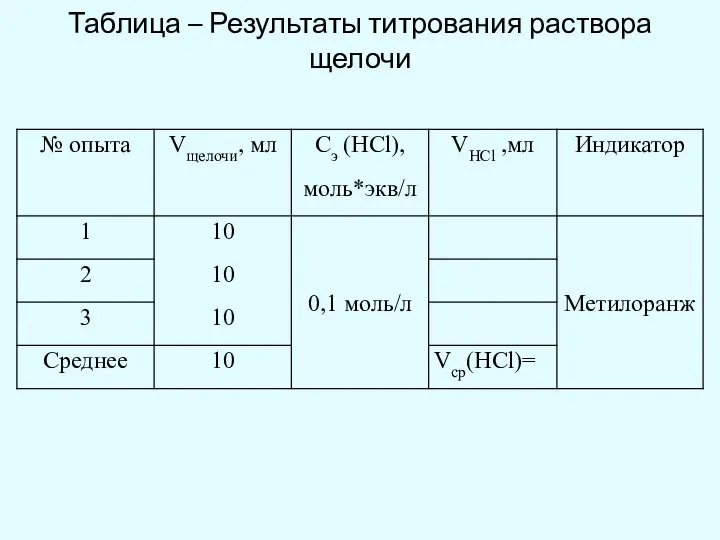
- 29. Таблица – Результаты титрования раствора щелочи
- 30. По формуле: Сэ(NaOH)*V(NaOH) = СЭ(НС1)*V(HC1) определите СЭ(NaOH), взяв Vcp(HCl) как среднее значение по результатам 3-х титрований,
- 31. ВЫВОДЫ 1.Освоен метод объемного титрования с использованием кислотно-основного индикатора- метил-оранжевого 2. Установлена концентрация приготовленного раствора, которая
- 32. Защита лабораторной работы № 1 проводится по теоретическим вопросам метода нейтрализации, формулам пересчета концентраций растворов химических
- 33. Задача 3. Определите Сэ и Т раствора КОН с С% = 43% и р = 1,48
- 35. Скачать презентацию





























 Термодинамика и термохимия процессов горения и взрыва
Термодинамика и термохимия процессов горения и взрыва Полимерные материалы
Полимерные материалы Химико-технологические процессы современных производств. Лекция №3
Химико-технологические процессы современных производств. Лекция №3 Презентация по Химии "Свойства воды" - скачать смотреть
Презентация по Химии "Свойства воды" - скачать смотреть  Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують Пластмассы и их свойства
Пластмассы и их свойства Колообіг оксигену в природі. Озон. Застосування кисню та його біологічна роль
Колообіг оксигену в природі. Озон. Застосування кисню та його біологічна роль Метод комплесонометрии
Метод комплесонометрии АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Окислительно – восстановительные реакции. Раева Анна Семеновна Учитель химии МОБУ СОШ № 24 имени С. И. Климакова, г. Якутск
Окислительно – восстановительные реакции. Раева Анна Семеновна Учитель химии МОБУ СОШ № 24 имени С. И. Климакова, г. Якутск Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Предельные углеводороды. Проверочная работа № 4. Вариант 4
Предельные углеводороды. Проверочная работа № 4. Вариант 4 Химические реакции разложения и соединения
Химические реакции разложения и соединения Реакции фотоизомеризации и фотоперегруппировок. Фотохимические окислительно-восстановительные реакции
Реакции фотоизомеризации и фотоперегруппировок. Фотохимические окислительно-восстановительные реакции Антидуриан (10 класс)
Антидуриан (10 класс) Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов
Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ
КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ  Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна
Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна  Презентация по Химии "Семь доисторических металлов" - скачать смотреть
Презентация по Химии "Семь доисторических металлов" - скачать смотреть  Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Второй закон термодинамики
Второй закон термодинамики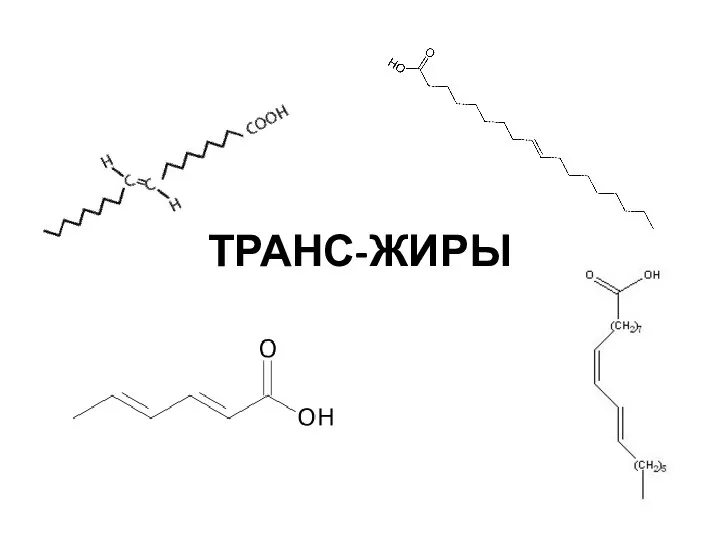 Транс-жиры
Транс-жиры VA группа N и Р (подгруппа ванадия)
VA группа N и Р (подгруппа ванадия) Ионно-координационная полимеризация
Ионно-координационная полимеризация Обмен липидов
Обмен липидов Технология вакуумной перегонки мазута
Технология вакуумной перегонки мазута История развития биохимического знания и биохимии как науки
История развития биохимического знания и биохимии как науки Бинарный урок - конференция по физике и химии
Бинарный урок - конференция по физике и химии