Содержание
- 2. Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия. Цель Задачи обучения: Студент должен знать: Студент должен уметь: Владеть навыками:
- 3. Цель: Изучить строение отдельных представителей гетерофункциональных соединений: гидрокси-, оксо-, фенолокислот и их специфические свойства, кето-енольную таутомерию
- 4. Студент должен знать: Гетерофункциональные соединения, их классификация и реакционная способность О специфических свойствах алифатических гетерофункциональных соединений,
- 5. Студент должен уметь: Писать проекционные формулы Фишера и уравнения реакций характеризующие химические свойства оксо- и гидроксикислот
- 6. Владеть навыками: Выполнять качественные реакции
- 7. Основные вопросы темы : Гетерофункциональные соединения, их классификация и реакционная способность. Гидрокислоты (молочная, β-, γ-гидроксимасляная, γ-гидроксивалериановая).
- 8. Методы обучения и преподавания: Определение входного уровня знаний, беседа по теме занятия, работа в парах -
- 9. Контроль: Напишите уравнение реакции переаминирования (трансаминирования) между 2-аминопропановой и α-кетоглутаровой кислотами Укажите аналитический эффект качественной реакции
- 10. Практические навыки: Тема: Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия. Опыт №1. Реакция Уффельмана на молочную кислоту. В
- 11. Опыт №2. Доказательство наличия двух гидроксигрупп в виннокаменной кислоте В пробирку помещают 5-6 капель 10%-ного раствора
- 13. Скачать презентацию










 Хроматография
Хроматография Презентация Коррозия
Презентация Коррозия Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко
Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Кислоты в свете ТЭД
Кислоты в свете ТЭД Вуглецеві матеріали
Вуглецеві матеріали Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф
Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф  Коллоидная химия
Коллоидная химия Превращение веществ
Превращение веществ Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Платина. Свойства
Платина. Свойства Дифузія у побуті
Дифузія у побуті Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Атомы. Молекулы. Ионы
Атомы. Молекулы. Ионы Химическая связь
Химическая связь КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Осадительное титрование. (Лекция 11)
Осадительное титрование. (Лекция 11) Задачи в школьном курсе химии
Задачи в школьном курсе химии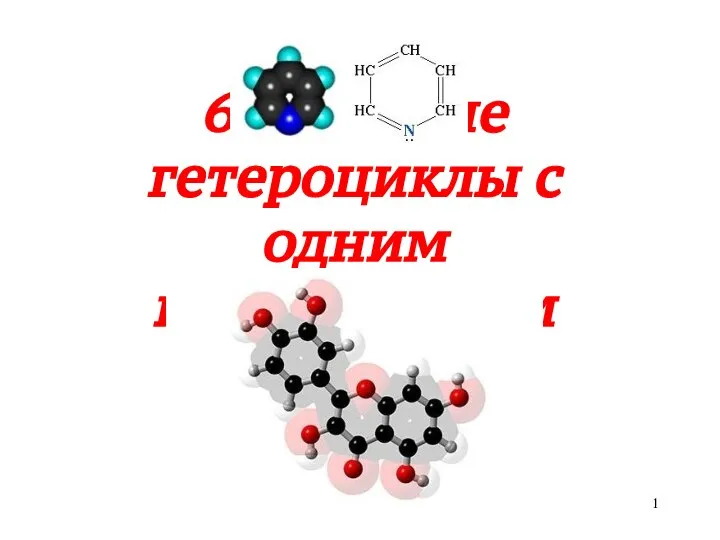 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Альдегидтер және кетондар
Альдегидтер және кетондар Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение
Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение Обмен нуклеотидов
Обмен нуклеотидов Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Аминокислоты. Белки
Аминокислоты. Белки