Содержание
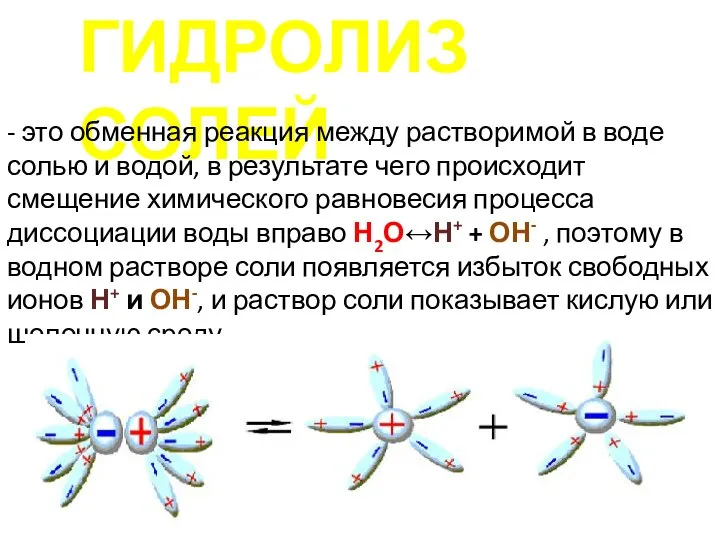
- 2. ГИДРОЛИЗ СОЛЕЙ - это обменная реакция между растворимой в воде солью и водой, в результате чего
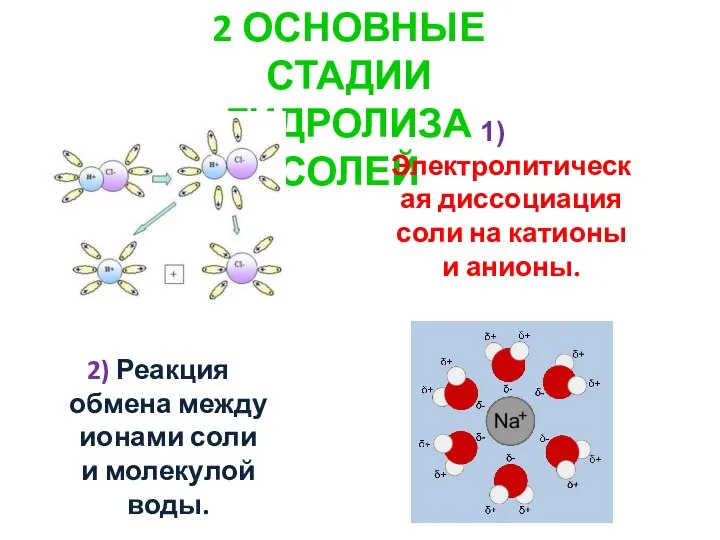
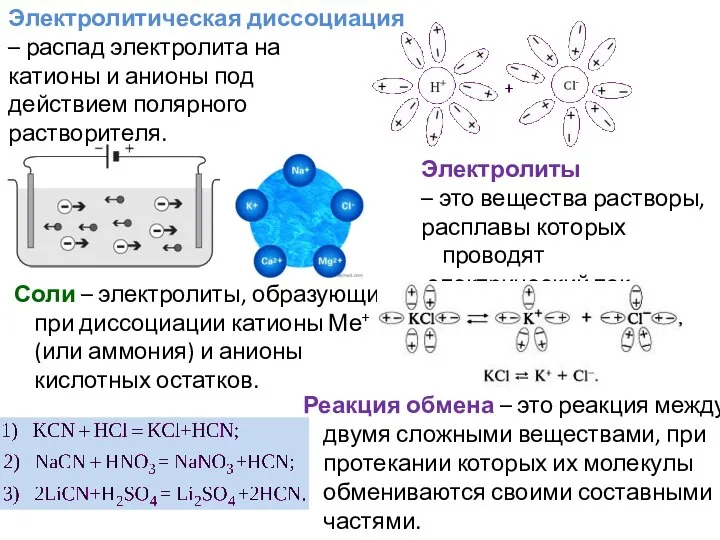
- 3. 2 ОСНОВНЫЕ СТАДИИ ГИДРОЛИЗА СОЛЕЙ Электролитическая диссоциация соли на катионы и анионы. 2) Реакция обмена между
- 4. Реакция обмена – это реакция между двумя сложными веществами, при протекании которых их молекулы обмениваются своими
- 5. ВЕЩЕСТВА ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Растворы или расплавы кислот, щелочей, солей. Неполярные соединения, растворы спирта, сахара, некоторых газов:
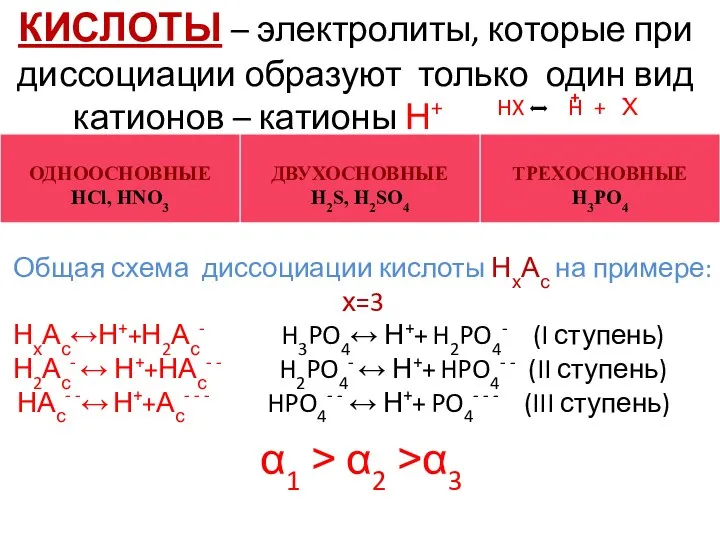
- 6. КИСЛОТЫ – электролиты, которые при диссоциации образуют только один вид катионов – катионы Н+ HX H
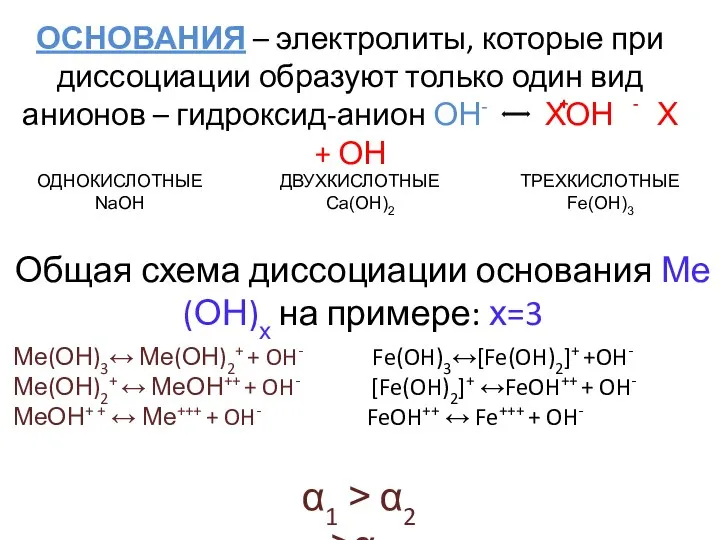
- 7. ОСНОВАНИЯ – электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-анион ОН- ХОН Х
- 8. Чем слабее кислота, тем выше степень гидролиза. Ряд анионов, расположенных по увеличению степени гидролиза от F-
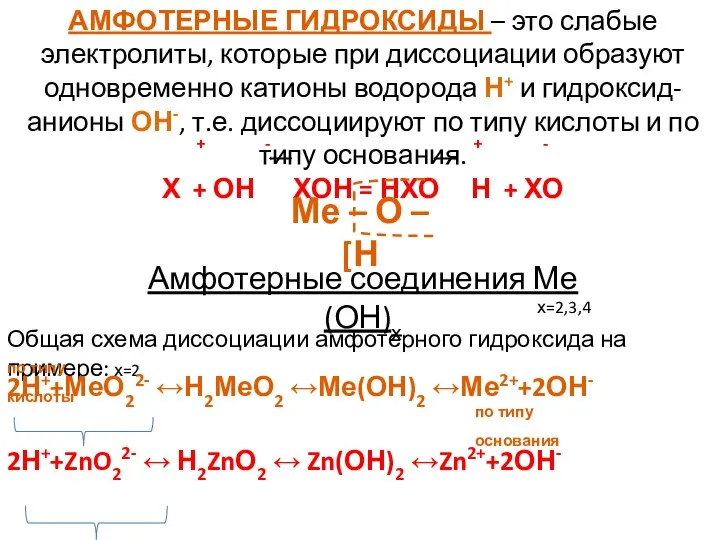
- 9. АМФОТЕРНЫЕ ГИДРОКСИДЫ – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы
- 10. СОЛИ – ионные соединения, состоящие из катионов металлов (или аммония) и анионов кислотных остатков. ХY X
- 11. Разные соотношения основания и кислоты образуют соли различного состава: 1) средние Мех(Ас)у AI2(SO4)3 2AI + 3SO4
- 12. кислые средние основные МеНАс Мех(Ас)у [MeOH] Ac МеНАс↔Ме++НАс- Мех(Ас)у↔xMe+y+yAc-x MeOHAc↔MeOH++Ac- NaHCO3↔Na++HCO3- Na3PO4↔3Na++PO43- MgOHCl↔MgOH++Cl- Н Н ОН
- 13. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЯ ГИДРОЛИЗА Записать формулу соли: FeCl2, Na2S, NH4NO2 Определить тип соли: каким по силе
- 14. Выписать формулу иона слабого электролита и написать уравнение взаимодействия его с одной молекулой воды (реакция обмена):
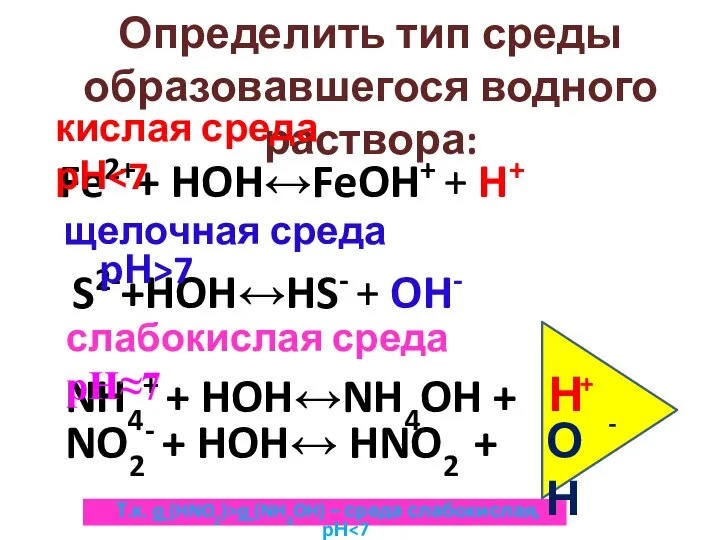
- 15. Определить тип среды образовавшегося водного раствора: Fe2++ HOH↔FeOH+ + H+ кислая среда рН S2-+HOH↔HS- + OH-
- 16. 5. Написать полное ионное уравнение на основании сокращенного ионного уравнения: Fe2+ + 2Cl- + HOH↔ FeOH++H+
- 17. FeSO4 - соль, образованная слабым основанием Fe(OH)2 и сильной кислотой H2SO4 Fe2+ + HOH ↔ FeOH++H+
- 18. ВНИМАНИЕ! Многозарядные ионы гидролизуются ступенчато, причем на каждой ступени расходуется только одна молекула воды. По последней
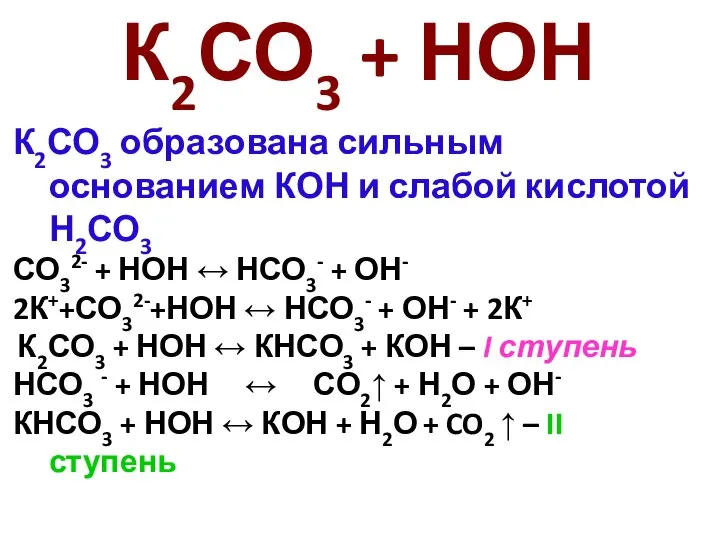
- 19. К2СО3 образована сильным основанием КОН и слабой кислотой Н2СО3 СО32- + НОН ↔ НСО3- + ОН-
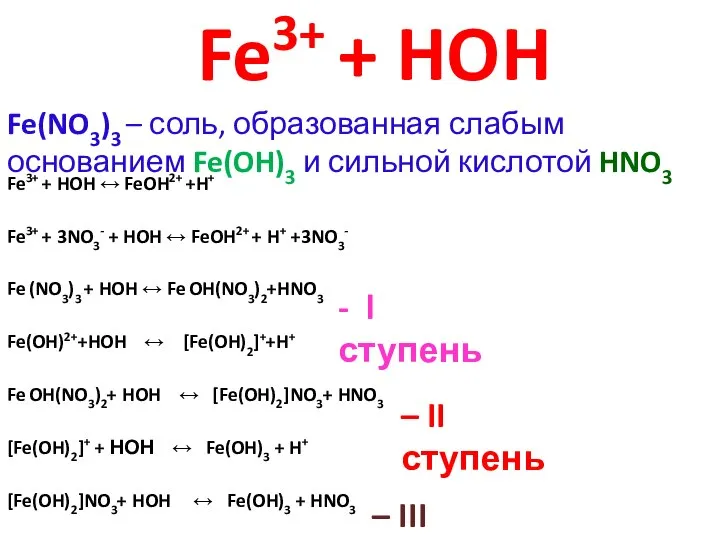
- 20. Fe3+ + HOH Fe(NO3)3 – соль, образованная слабым основанием Fe(OH)3 и сильной кислотой HNO3 Fe3+ +
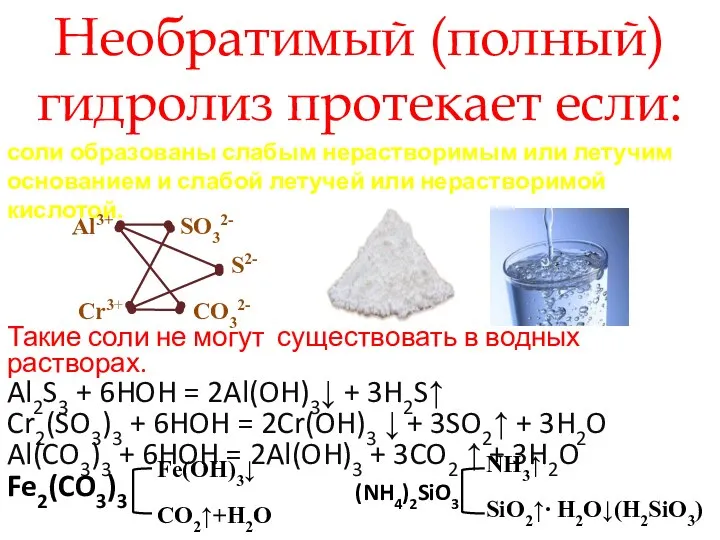
- 21. Необратимый (полный) гидролиз протекает если: соли образованы слабым нерастворимым или летучим основанием и слабой летучей или
- 22. смешали растворы соды и соли любого двухвалентного металла, гидролизованного по катиону ВНИМАНИЕ! Образуется основной карбонат металла.
- 23. Механизм полного гидролиза: FeCl3 – соль, образованная слабым основанием Fe(OH)3 и сильной кислотой HCl Fe3+ +
- 24. Взаимодействие металлов с растворами гидролизующихся солей может вызвать протекание следующих реакций: гидролиз солей взаимодействие металла с
- 25. Соли, гидролизующиеся по катиону: AlCl3 + Zn Zn – металл, расположенный в ряду напряжений металлов до
- 26. Соли, гидролизующиеся по аниону: Na2CO3 + Al Al – металл, расположенный в ряду напряжений металлов до
- 28. Скачать презентацию




![кислые средние основные МеНАс Мех(Ас)у [MeOH] Ac МеНАс↔Ме++НАс- Мех(Ас)у↔xMe+y+yAc-x MeOHAc↔MeOH++Ac- NaHCO3↔Na++HCO3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/748284/slide-11.jpg)










 Обзор и анализ современных порошковых материалов в аддитивных технологиях
Обзор и анализ современных порошковых материалов в аддитивных технологиях Динамическая вулканизация термоэластопластов
Динамическая вулканизация термоэластопластов Сода: мифы и реальность
Сода: мифы и реальность Органические вещества. Углеводы. Липиды
Органические вещества. Углеводы. Липиды Нуклеиновые кислоты
Нуклеиновые кислоты Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Ионные уравнения
Ионные уравнения Титан (лат. Titanium; обозначается символом Ti)
Титан (лат. Titanium; обозначается символом Ti) Волшебный мир кристаллов
Волшебный мир кристаллов Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Химический элемент платина
Химический элемент платина Жидкие кристаллы
Жидкие кристаллы Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Розчинник
Розчинник Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Изомерия органических соединений. 10 класс
Изомерия органических соединений. 10 класс Свойства и классификация нефти
Свойства и классификация нефти Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Строение атома
Строение атома Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) Презентация по Химии "Химия в жизни человека" - скачать смотреть
Презентация по Химии "Химия в жизни человека" - скачать смотреть  Сложные эфиры в природе и их применение
Сложные эфиры в природе и их применение Биологически важные гетероциклы
Биологически важные гетероциклы Теория растворов (лекция 1)
Теория растворов (лекция 1) Коррозия металлов Учитель химии: Ильязова Р. Т.
Коррозия металлов Учитель химии: Ильязова Р. Т.  Нитрофенилалкиламины
Нитрофенилалкиламины Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление