Содержание
- 6. Цель Исследовать действие факторов окружающей среды на степень ржавления металлов. Гипотеза Если поместить железо в щелочную
- 7. Задачи 1. Изучить сущность коррозии, её виды и способы защиты от коррозии. 2.Исследовать зависимость скорости коррозии
- 8. Значение коррозии 1. Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. 2.Недопустима во многих
- 9. Коррозия — гетерогенный процесс который происходит на границе раздела фаз «металл — окружающая среда». В результате
- 10. В случае химической коррозии происходит взаимодействие металла непосредственно с окислителем окружающей среды. В результате этого разрушается
- 11. Электрохимическая коррозия Этот вид коррозии встречается наиболее часто и представляет собой процесс взаимодействия металлов и сплавов
- 12. Факторы вызывающие коррозию 1. Кислород и влага атмосферы 2. Углекислый и сернистый газы, содержащие в атмосфере
- 13. Эксперимент №1. Роль кислорода в процессе коррозии железа. В пробирке №1-ж. гвоздь+вода на половину. В пробирке
- 16. Эксперимент№2. Влияние электролитов на процесс коррозии. В стакане №1-ж. гвоздь + вода. В стакане №2-ж. гвоздь
- 19. Эксперимент №3. Влияние ингибиторов на процесс коррозии. В пробирке №1 - ж. гвоздь + раствор гидроксида
- 21. По результатам исследований были сделаны следующие выводы: 1.Коррозия железа резко усиливается в присутствии кислорода. 2.Коррозия железа
- 22. Способы защиты 1. Изменение состава технического металла. 2. Защитные покрытия. 3. Изменение состава среды. 4. Электрохимические
- 24. Выдвинутая гипотеза подтвердилась, коррозия в щелочной среде уменьшается. Таким образом, известно и используется на практике множество
- 26. Скачать презентацию























 Аммофос өндірісі. Алыну әдісі
Аммофос өндірісі. Алыну әдісі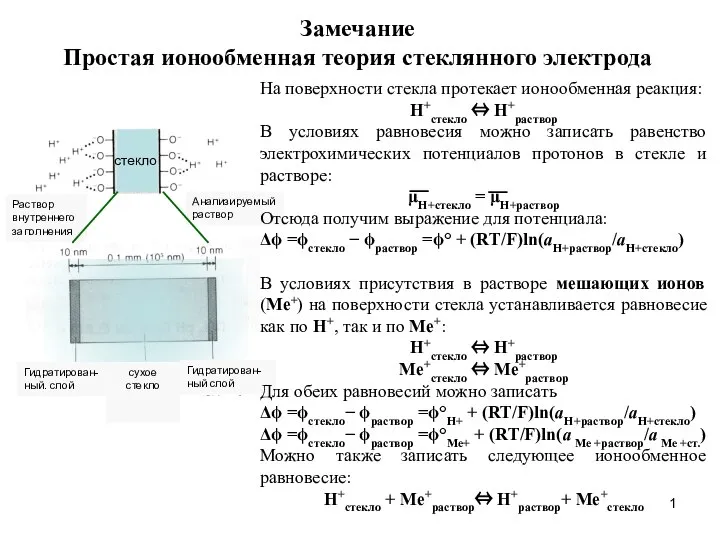 Простая ионообменная теория стеклянного электрода
Простая ионообменная теория стеклянного электрода Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Решение задач Скорость химических реакций 11 класс
Решение задач Скорость химических реакций 11 класс  Парниковий ефект
Парниковий ефект Презентация по Химии "Соли в медицине" - скачать смотреть
Презентация по Химии "Соли в медицине" - скачать смотреть  Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства) Определение содержания солей в нефти
Определение содержания солей в нефти Понятие о химической реакции. Реакции без изменения состава веществ
Понятие о химической реакции. Реакции без изменения состава веществ Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Алкены
Алкены Непредельные углеводороды. Алкены. 9 класс
Непредельные углеводороды. Алкены. 9 класс Периодический закон и периодическая система химических элементов (турнир знатоков химии)
Периодический закон и периодическая система химических элементов (турнир знатоков химии) Тема урока: Силикатная промышленность
Тема урока: Силикатная промышленность Типы химической связи
Типы химической связи Современные конструкционные материалы
Современные конструкционные материалы Коллигативные свойства растворов
Коллигативные свойства растворов Свойства солей
Свойства солей Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4)
Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4) Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Кинетика гетерогенно-каталитических реакций. (Лекция 22)
Кинетика гетерогенно-каталитических реакций. (Лекция 22) Духи
Духи Углеводы. Классификация углеводов
Углеводы. Классификация углеводов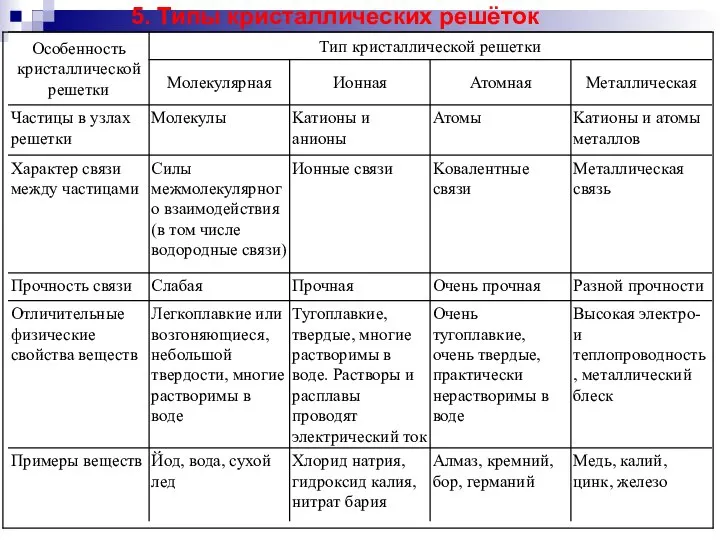 Типы кристаллических решёток. (Лекция 3)
Типы кристаллических решёток. (Лекция 3) Синтетические топлива
Синтетические топлива Основы органической химии. Кислородсодержащие органические соединения
Основы органической химии. Кислородсодержащие органические соединения Биохимия. Химический состав организма
Биохимия. Химический состав организма Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО
Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО