Содержание
- 2. ЦЕЛЬ УРОКА: Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.
- 4. ОТВЕТЫ ТЕСТА 1 вариант – неметаллы 2, 4, 5, 7, 10, 11, 13, 15 2 вариант
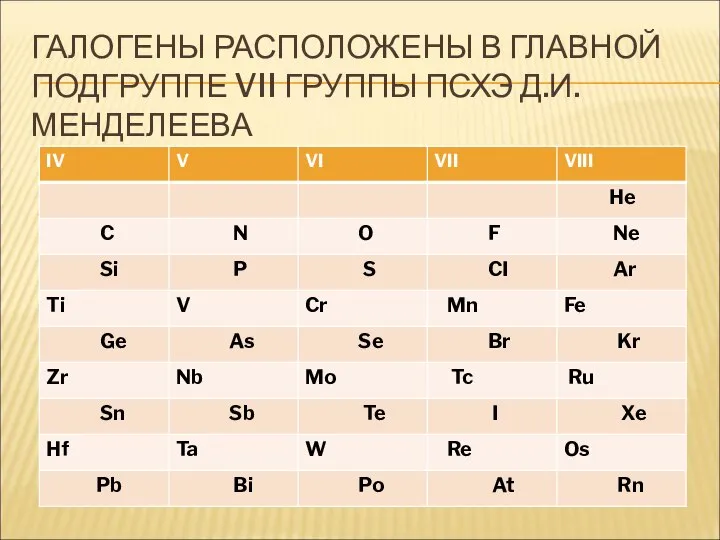
- 5. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
- 6. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
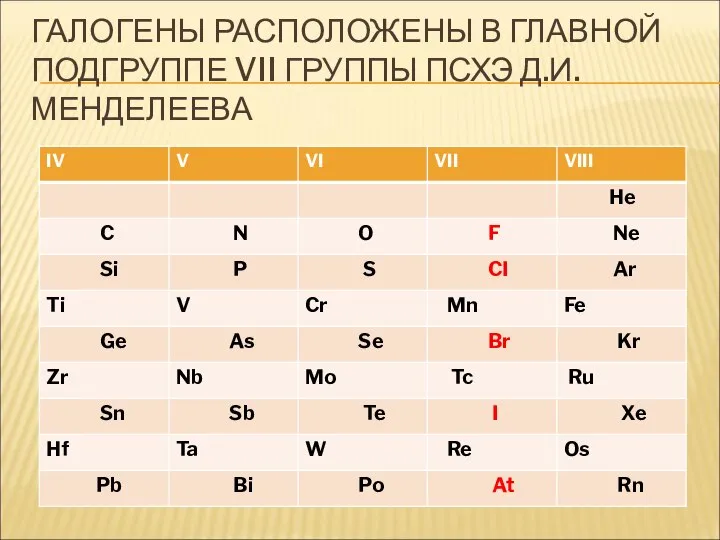
- 7. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
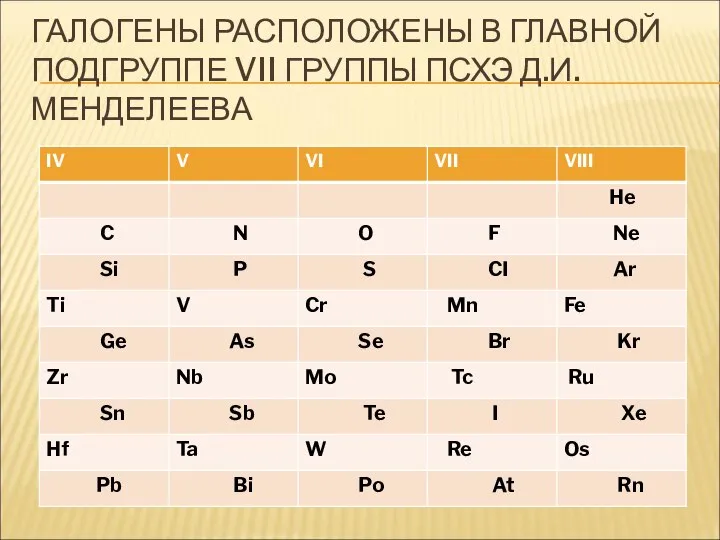
- 8. ГАЛОГЕНЫ РАСПОЛОЖЕНЫ В ГЛАВНОЙ ПОДГРУППЕ VII ГРУППЫ ПСХЭ Д.И. МЕНДЕЛЕЕВА
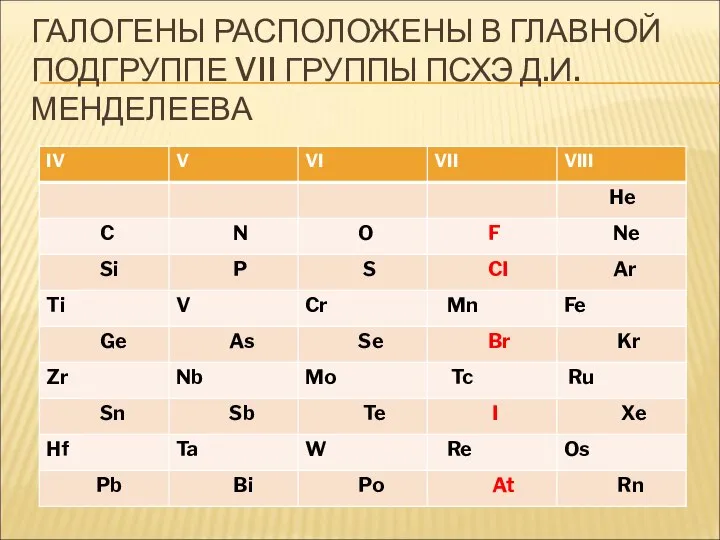
- 9. ГАЛОГЕНЫ «рождающие соли» F CI Br I At
- 10. РАСПРОСТРАНЕННОСТЬ ГАЛОГЕНОВ В ПРИРОДЕ
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность Повышаются температуры кипения и плавления
- 13. ФИЗИЧЕСКИЕ СВОЙСТВА Увеличивается плотность Повышаются температуры кипения и плавления Усиливается интенсивность окраски
- 14. ФТОР F2 Ядовитый газ светло- зелёного цвета
- 15. ХЛОР CI2 - Ядовитый газ жёлто-зеленого цвета
- 16. БРОМ Br2 Токсичная тяжёлая жидкость красно- бурого цвета
- 17. ЙОД I2 – Твёрдое кристаллическое вещество с металлическим блеском При нагревании образует пары фиолетового цвета
- 18. ОТВЕТЬТЕ НА ВОПРОСЫ. Число электронов на внешнем энергетическом уровне атома; Изменение радиуса атомов и окислительно-восстановительных свойств
- 19. ПРОВЕРКА: На внешнем энергетическом уровне галогены содержат 7 электронов. В главной подгруппе с увеличением зарядов ядер,
- 20. ХИМИЧЕСКИЕ СВОЙСТВА F) ) 2 7 Г°+1е = Г¯ - Галогены- окислители
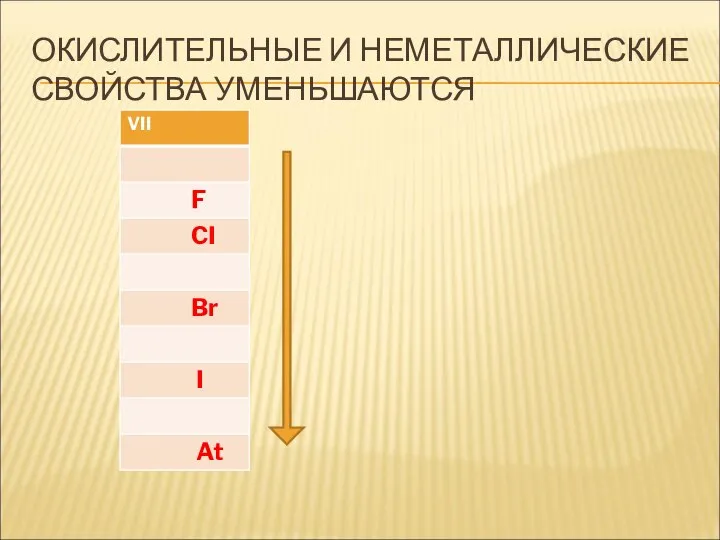
- 21. ОКИСЛИТЕЛЬНЫЕ И НЕМЕТАЛЛИЧЕСКИЕ СВОЙСТВА УМЕНЬШАЮТСЯ
- 22. БОЛЕЕ АКТИВНЫЙ ГАЛОГЕН ВЫТЕСНЯЕТ МЕНЕЕ АКТИВНЫЙ ИЗ ЕГО СОЕДИНЕНИЙ С МЕТАЛЛАМИ И ВОДОРОДОМ 2KI + Br2
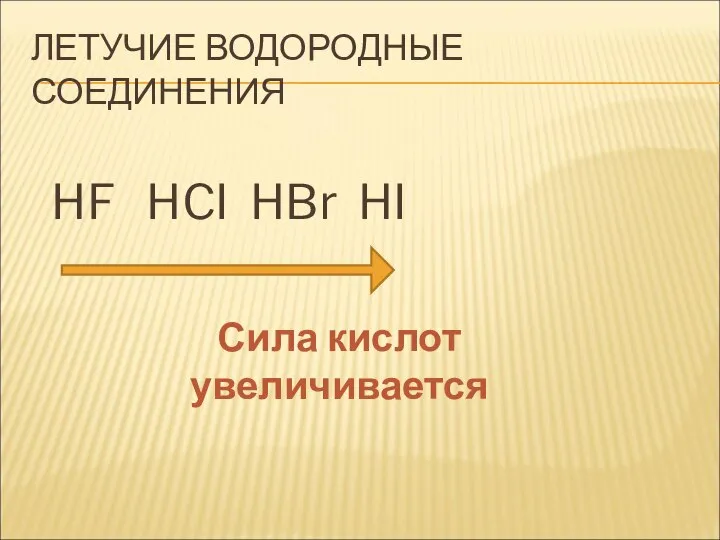
- 23. ЛЕТУЧИЕ ВОДОРОДНЫЕ СОЕДИНЕНИЯ HF HCI HBr HI Сила кислот увеличивается
- 24. Л. О. №2 ВЫТЕСНЕНИЕ ОДНИХ ГАЛОГЕНОВ ДРУГИМИ ИЗ ИХ СОЕДИНЕНИЙ ОФОРМИТЕ РЕЗУЛЬТАТЫ РАБОТЫ В ВИДЕ ТАБЛИЦЫ
- 25. Л. О. №3 РАСТВОРИМОСТЬ ЙОДА В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ ОФОРМИТЕ РЕЗУЛЬТАТЫ РАБОТЫ В ВИДЕ ТАБЛИЦЫ Запишите уравнения
- 26. ВОПРОСЫ И ЗАДАНИЯ Перечислите галогены. Фтор, хлор, бром, йод, астат. Где в ПСХЭ располагаются галогены? в
- 27. ВОПРОСЫ И ЗАДАНИЯ Сопоставьте : Хлор красно – бурая жидкость Бром светло – зеленый газ Йод
- 28. ВОПРОСЫ И ЗАДАНИЯ Дополните: Самый сильный неметалл – фтор. Самая сильная бескислородная кислота – HI. Как
- 29. Домашнее задание § 13 , УПРАЖНЕНИЯ 1- 4 СТР. 61.
- 31. Скачать презентацию






















 Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер
Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер Использование ИКТ в преподавании химии - презентация_
Использование ИКТ в преподавании химии - презентация_ Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул
Идеальный газ в молекулярно-кинетической теории. Среднее значение квадрата скорости молекул Реакции координированных лигандов
Реакции координированных лигандов Школьное мероприятие Д. И. Менделеев в высказываниях Автор: Ким Наталья Викторовна учитель химии
Школьное мероприятие Д. И. Менделеев в высказываниях Автор: Ким Наталья Викторовна учитель химии  Азотные удобрения
Азотные удобрения Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях
Особенности структуры сплава FeCu1Si16B6 на нанометровом и морфологическом уровнях Сложные вещества кислоты
Сложные вещества кислоты Реакции щелочных металлов (Группа 1) – Li, Na, K
Реакции щелочных металлов (Группа 1) – Li, Na, K Уникальный мир мыла Работу выполнила: Булгакова Елизавета МОУСОШ №7 Г.Сальска
Уникальный мир мыла Работу выполнила: Булгакова Елизавета МОУСОШ №7 Г.Сальска Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть  Алкани Підготувала учениця 9-Б класу Кудименко Діана
Алкани Підготувала учениця 9-Б класу Кудименко Діана  Диеновые углеводороды (алкадиены)
Диеновые углеводороды (алкадиены) Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Цезій та його вплив на організм людини
Цезій та його вплив на організм людини  Дисперсті жүйелердің оптикалық әдістері
Дисперсті жүйелердің оптикалық әдістері Современные методы пробоподготовки пищевых проб для определения токсичных элементов
Современные методы пробоподготовки пищевых проб для определения токсичных элементов Типы и механизмы органических реакций
Типы и механизмы органических реакций Углерод и 4 группа
Углерод и 4 группа Способы выражения состава раствора. Решение задач
Способы выражения состава раствора. Решение задач Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем ФКХ-Л2 2016
ФКХ-Л2 2016 Основы качественного анализа. Лекция №4
Основы качественного анализа. Лекция №4 Анализ лекарственных смесей
Анализ лекарственных смесей Неорганические вяжущие вещества. (Лекция 6)
Неорганические вяжущие вещества. (Лекция 6) Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки
Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки Галогены
Галогены