Содержание
- 2. * Химическая кинетика – это раздел химии, изучающий механизмы химических реакций и скорости их протекания. Химические
- 3. * В гомогенных реакциях отсутствуют поверхности раздела между реагентами (реагирующие вещества находятся в одном агрегатном состоянии),
- 4. * В гетерогенных реакциях есть поверхность раздела между реагентами (реагирующие вещества находятся в разных агрегатных состояниях),
- 5. * Скорость химической реакции - изменение концентрации любого участника реакции в единицу времени: Знак «+» –
- 6. * Продукты реакции Исходные вещества
- 7. * Скорость в данный момент времени ( ) называется истинной скоростью реакции Скорость за промежуток времени
- 8. * Факторы, влияющие на скорость реакции: природа реагирующих веществ; концентрация; давление (только для газов); температура; наличие
- 9. * Реакции по механизму их протекания простые (элементарные реакции) – это реакции, протекающие в одну стадию.
- 10. * Большинство хим. и все биохим. реакции – сложные. В сложных реакциях скорости отдельных стадий могут
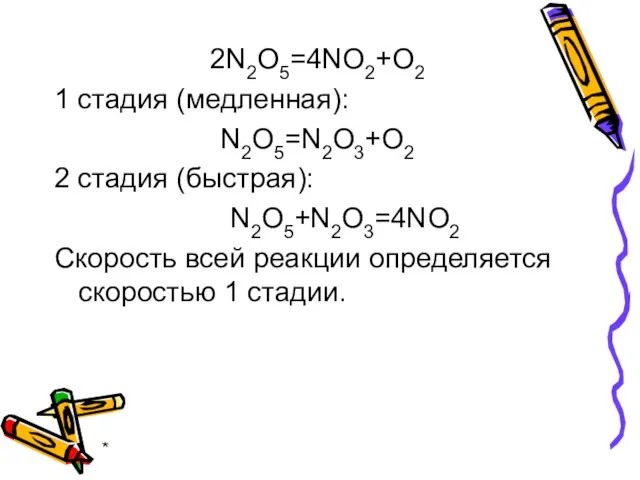
- 11. * 2N2O5=4NO2+O2 1 стадия (медленная): N2O5=N2O3+O2 2 стадия (быстрая): N2O5+N2O3=4NO2 Скорость всей реакции определяется скоростью 1
- 12. * Влияние природы реагирующих веществ определяется их составом и видом частиц, участвующих в реакции. Оксид натрия
- 13. * Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: H2 + I2
- 14. * Влияние концентрации и давления на скорость реакции. Для элементарных реакций справедлив закон действующих масс Гульберга-Вааге:
- 15. * Для простой реакции aA(р) + bB(р) = dD(р) v=k·Сa(А) ·Сb(В) где С(А) и С(В) -
- 16. * Для реакции в газовой фазе aA(г) + bB(г) = dD(г) Вместо концентраций можно использовать давления:
- 17. * Выражения v=k·Сa(А) ·Сb(В) и v=k·Рa(А) ·Рb(В) называются кинетическими уравнениями реакции. коэффициент a - порядок реакции
- 18. * Порядок сложной реакции не совпадает со стехиометрическими коэф-ми реакции, поэтому кинетическое уравнение для сложной реакции
- 19. * Например, для реакции H2(г) + Сl2(г) → 2НСl(г) кинетическое уравнение частный порядок по H2 равен
- 20. * Для реакции Zn(тв) + 2HCl(р) → ZnСl2(р) + H2(г) кинетическое уравнение v = k·C2HCl частный
- 21. * Для реакции 2Na(тв) + H2O(р) → 2NaOH(р) + H2(г) кинетическое уравнение v = k частный
- 22. * Молекулярность реакции – это количество молекул, участвующих в элементарном процессе. Для простых реакций молекулярность совпадает
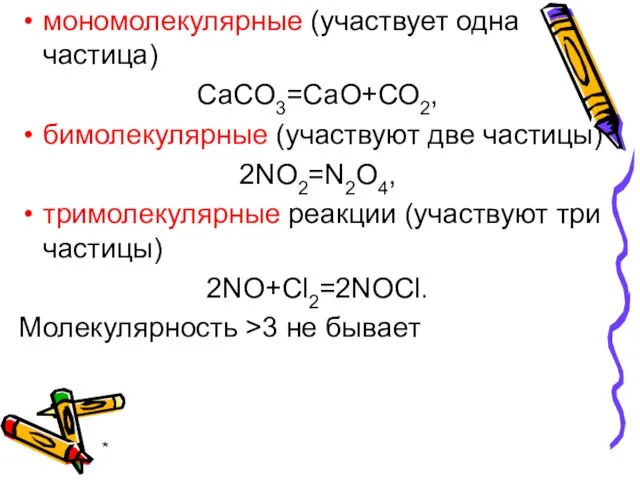
- 23. * мономолекулярные (участвует одна частица) СаСО3=СаО+СО2, бимолекулярные (участвуют две частицы) 2NO2=N2O4, тримолекулярные реакции (участвуют три частицы)
- 24. * Для кинетической характеристики реакции используют не скорость, а константу скорости реакции k. Константа скорости реакции
- 25. * Влияние температуры на скорость реакции.
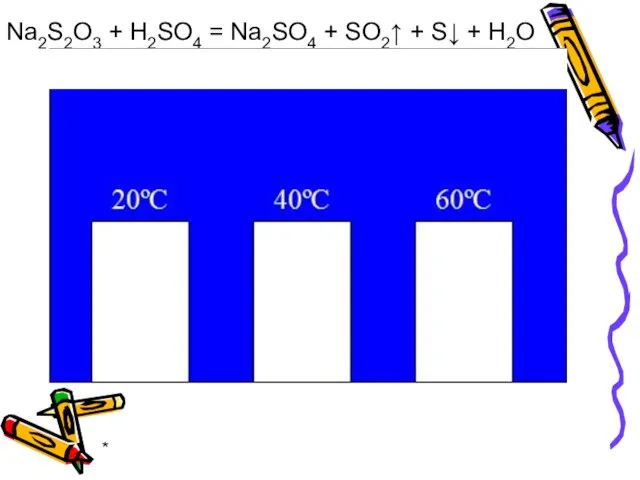
- 26. * Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O
- 27. * Правило Вант-Гоффа: С увеличением температуры на каждые 10º скорость химической реакции возрастает в 2-4 раза:
- 28. * Так как скорость реакции обратно пропорциональна времени, затраченного на реакцию, то правило Вант-Гоффа можно записать
- 29. * для хим. реакций для ферментативных (биохим.) реакций Поэтому колебания температуры тела человека в пределах даже
- 30. * Зависимость скорости реакции от температуры более точно описывается теорией активных столкновений Аррениуса:
- 31. * к химическому взаимодействию приводит не каждое столкновение частиц, а только те столкновения, в которых участвуют
- 32. * Энергия активации Еа – это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы
- 33. * E Ход реакции А+В [А…В] C+D Ea
- 34. * [А…В] – активированный комплекс (промежуточный комплекс молекул, в котором одновременно разрываются старые связи и образуются
- 35. * где - константа скорости реакции при температуре Т (К), А – предэкспоненциальный множитель (коэффициент Аррениуса),
- 36. * Уравнение Аррениуса выведено экспериментально, из него следует, что чем больше энергия активации, тем меньше будут
- 37. * Влияние катализатора на скорость реакции. Катализатором называют вещество, участвующее в реакции и изменяющее ее скорость,
- 38. * Катализ бывает положительный, когда скорость реакции возрастает, и отрицательный, когда скорость реакции уменьшается (в этом
- 39. * Гомогенный катализ В гомогенных каталитических реакциях скорость пропорциональна количеству катализатора. Реакция направляется по пути с
- 40. * Сущность механизма действия катализатора при гомогенном катализе заключается в образовании промежуточного реакционноспособного соединения: А+В =
- 41. * Ход реакции Е [А…В] А+В+kat C+D+kat [A...B]kat Ea E'a
- 42. * Механизм действия ингибитора не связан с понижением энергии активации. Ингибитор вступает во взаимодействие с каким-либо
- 43. * Гетерогенный катализ Механизм гетерогенного катализа объясняется теорией активированной адсорбции. Адсорбция – это свойство вещества поглощать
- 44. *
- 45. * На активных центрах поверхности катализатора адсорбируются реагирующие вещества. Процесс протекает в несколько стадий, и промежуточными
- 46. * В гетерогенных реакциях увеличение поверхности соприкосновения фаз равносильно увеличению концентрации, поэтому катализатор всегда измельчают и
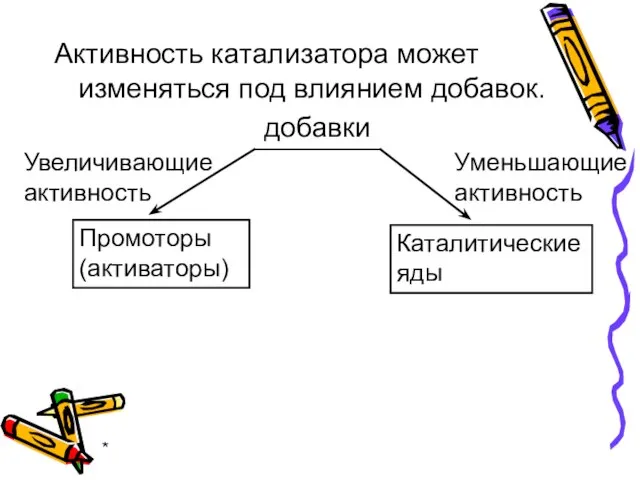
- 47. * Активность катализатора может изменяться под влиянием добавок. добавки Увеличивающие активность Уменьшающие активность Промоторы (активаторы) Каталитические
- 48. * биологические катализаторы – ферменты (энзимы) – это белковые молекулы, которые катализируют химические реакции в живых
- 49. * В живой клетке одновременно протекают много химических реакций, одно и тоже вещество является реагентом или
- 50. * Сопряженными называют реакции, каждая из которых происходит только при условии протекания другой реакции, причем обе
- 51. * Такой продукт может играть роль катализатора или ингибитора для реакций, протекающих в клетке: явление автокатализа
- 52. * Автокатализ – это самоускорение реакции, обусловленное накоплением конечного или промежуточного продукта, обладающего каталитическим действием на
- 53. * Химическое равновесие. Химические реакции Необратимые (протекают только в одном направлении) Обратимые (одновременно протекают две взаимно
- 54. * Состояние обратимого процесса, при котором скорости прямой и обратной реакции равны, называют химическим равновесием. Концентрации
- 55. * Для реакции aА(г)+bB(г) cC(г)+ dD(г) кинетическое уравнение прямой реакции v=k·[A]a ·[B]b кинетическое уравнение обратной реакции
- 56. * В условиях равновесия v = v тогда k·[A]a·[B]b = k·[C]c·[D]d k [C]c·[D]d k [A]a·[B]b -
- 57. * КР - константа химического равновесия, зависит от природы реагирующих веществ, от температуры, но не зависит
- 58. * Химические реакции: экзотермические (с выделением теплоты, Q>0, ∆Н 2NO+O2↔2NO2 +113 кДж (или 2NО+O2↔2NO2; ∆Н=-113 кДж)
- 59. * принцип Ле Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие путем изменения
- 61. Скачать презентацию




























![* E Ход реакции А+В [А…В] C+D Ea](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537198/slide-32.jpg)
![* [А…В] – активированный комплекс (промежуточный комплекс молекул, в котором одновременно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537198/slide-33.jpg)






![* Ход реакции Е [А…В] А+В+kat C+D+kat [A...B]kat Ea E'a](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537198/slide-40.jpg)











![* Для реакции aА(г)+bB(г) cC(г)+ dD(г) кинетическое уравнение прямой реакции v=k·[A]a](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537198/slide-54.jpg)
![* В условиях равновесия v = v тогда k·[A]a·[B]b = k·[C]c·[D]d](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/537198/slide-55.jpg)



 Минерал гранат
Минерал гранат Radiation dosimetry
Radiation dosimetry Физико-химические свойства воды. Водные ресурсы Земли
Физико-химические свойства воды. Водные ресурсы Земли Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Молекулярные массы и гибкость полимеров
Молекулярные массы и гибкость полимеров Вакуумное фильтрование
Вакуумное фильтрование Инфузионая терапия новорожденных
Инфузионая терапия новорожденных Защитные материалы
Защитные материалы Наука плазмохимия
Наука плазмохимия Фосфор. Получение. Химические свойства
Фосфор. Получение. Химические свойства Brain элементтері
Brain элементтері Аттестационная работа. Программа элективного курса по химии экологическая химия
Аттестационная работа. Программа элективного курса по химии экологическая химия Теоретические основы органической химии
Теоретические основы органической химии Свойства фенола
Свойства фенола Катализ. Влияние катализатора на скорость химической реакции
Катализ. Влияние катализатора на скорость химической реакции Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Дослідження достовірності реклами з погляду хімії
Дослідження достовірності реклами з погляду хімії Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Трансмиссионное масло ADDINOL Eco Gear GLS
Трансмиссионное масло ADDINOL Eco Gear GLS ГИА по химии
ГИА по химии Оксиди, їх склад, назви.
Оксиди, їх склад, назви.  Оксид кремния
Оксид кремния Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие ГИА-9 Химия. А4
ГИА-9 Химия. А4 Каталитический крекинг
Каталитический крекинг Свойства аммиачной селитры
Свойства аммиачной селитры Растворение, растворимость веществ в воде
Растворение, растворимость веществ в воде