Содержание
- 2. Историческая справка Фосфор открыт гамбургским алхимиком Геннингом Брандом в 1669 г. Подобно другим алхимикам, Бранд пытался
- 3. Строение На внешнем энергетическом уровне атома фосфора содержится 5 электронов, которые имеют электронную конфигурацию 3s23p3. Фосфор
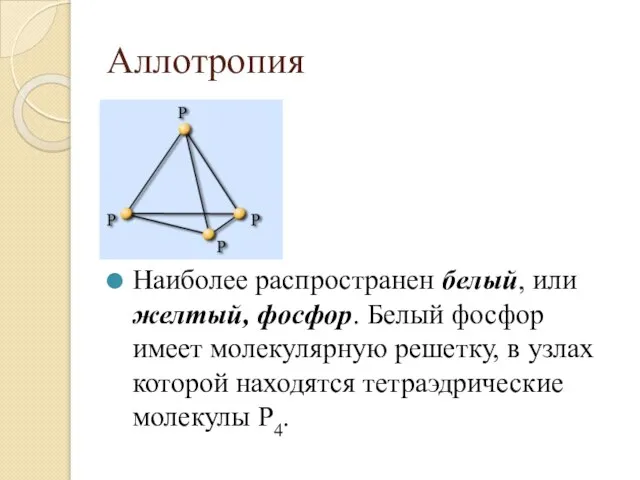
- 4. Аллотропия Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой находятся
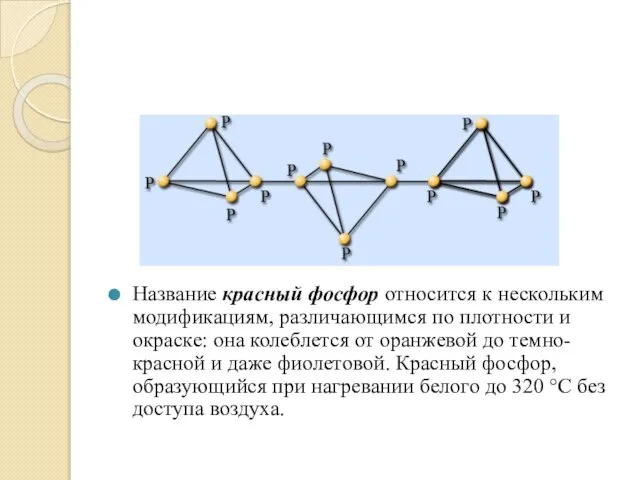
- 5. Название красный фосфор относится к нескольким модификациям, различающимся по плотности и окраске: она колеблется от оранжевой
- 6. При повышенном давлении белый фосфор переходит в черный фосфор. Это самая устойчивая модификация фосфора. Кристаллический черный
- 7. Получение Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре
- 8. Химические свойства Взаимодействие с простыми веществами Фосфор легко окисляется кислородом: 4P + 5O2 = 2P2O5, 4P
- 9. с неметаллами – восстановитель : 2P + 3S = P2S3, 2P + 3Cl2 = 2PCl3. Взаимодействует
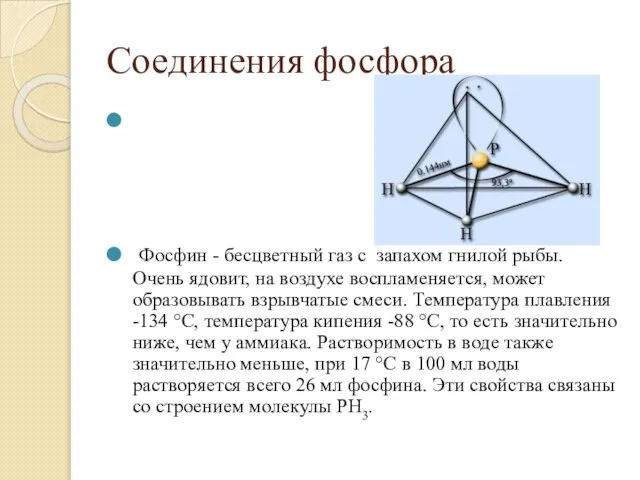
- 10. Соединения фосфора Фосфин - бесцветный газ с запахом гнилой рыбы. Очень ядовит, на воздухе воспламеняется, может
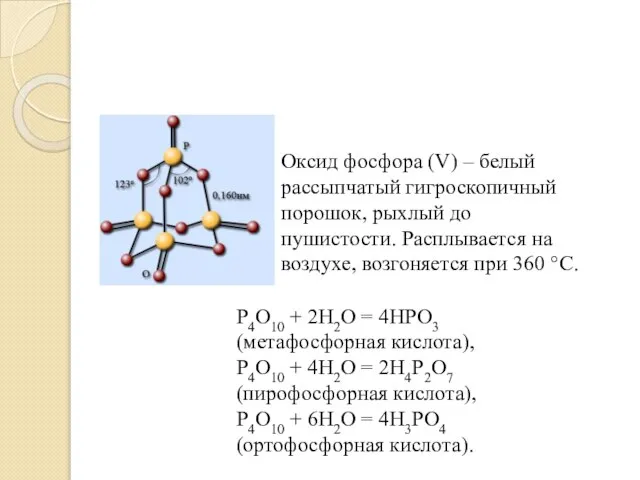
- 11. Оксид фосфора (V) – белый рассыпчатый гигроскопичный порошок, рыхлый до пушистости. Расплывается на воздухе, возгоняется при
- 12. Свойства кислотного оксида Типичный кислотный оксид: 6CaO + P4O10 = 2Ca3(PO4)2, 6Ca(OH)2 + P4O10 = 2Ca3(PO4)2
- 13. Фосфорноватистая кислота – это белые кристаллы, хорошо растворимые в воде и в органических растворителях. Температура плавления
- 14. Фосфористая кислота – это бесцветные кристаллы, хорошо растворимые в воде и спирте, температура плавления 74 °С,
- 15. При комнатной температуре довольно инертна, при нагревании проявляет свойства кислот, относится к кислотам средней силы. Диссоциация
- 16. Термический способ получения фосфорной кислоты основан на окислении элементарного фосфора в избытке воздуха с последующей гидратацией
- 18. Скачать презентацию











 Алканы. Гомологический ряд
Алканы. Гомологический ряд Химическая связь (Лекция 3)
Химическая связь (Лекция 3) Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Химическое равновесие
Химическое равновесие Современные методы обработки продуктов. Молекулярная кухня
Современные методы обработки продуктов. Молекулярная кухня Твердые вещества. Типы кристаллических решеток
Твердые вещества. Типы кристаллических решеток Химия. Роберт Бойль
Химия. Роберт Бойль Углеводороды нефти. Алканы. Парафины
Углеводороды нефти. Алканы. Парафины Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Синтетические полимеры. Искусственные полимерные материалы
Синтетические полимеры. Искусственные полимерные материалы  Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Органические вещества. Углеводы. Липиды
Органические вещества. Углеводы. Липиды Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10)
Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10) Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии
Биогеохимия: основные понятия, история развития, практическое значение идей биогеохимии Золото и его применение
Золото и его применение Методы получения основных классов неорганических соединений
Методы получения основных классов неорганических соединений Физические свойства полимеров
Физические свойства полимеров Производные салициловой и индолуксусной кислоты
Производные салициловой и индолуксусной кислоты Презентация 30
Презентация 30 Тагер. Физико-химия полимеров
Тагер. Физико-химия полимеров Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Калифорний Cf
Калифорний Cf Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Стероиды - производные углеводорода стерана
Стероиды - производные углеводорода стерана Минеральные продукты
Минеральные продукты Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4)
Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4) Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии
Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии