Содержание
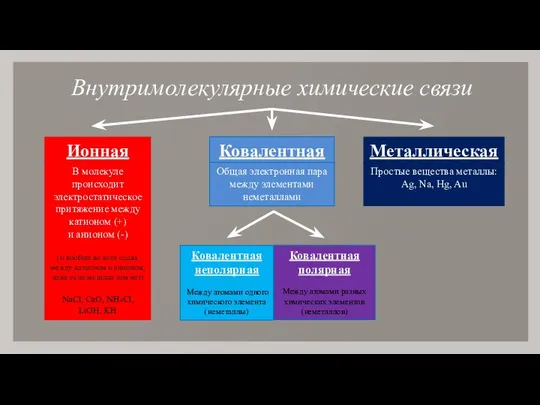
- 2. Внутримолекулярные химические связи Ионная Ковалентная Металлическая В молекуле происходит электростатическое притяжение между катионом (+) и анионом
- 3. Ионная химическая связь Химическая связь, образующаяся между ионами за счет электростатического притяжения – ионная химическая связь
- 4. Ионная связь возникает при взаимодействии атомов, имеющих ярко выра- женные противоположные свойства: между элементами-металлами IА- и
- 5. Схема: ионная химическая связь 1. Возьмем два разных атома: Сa – 2e Атом Сa Ион 2+
- 6. Ионная химическая связь Все твёрдые вещества характеризуются правильным расположением составляющих их частиц. Если соединить эти точки
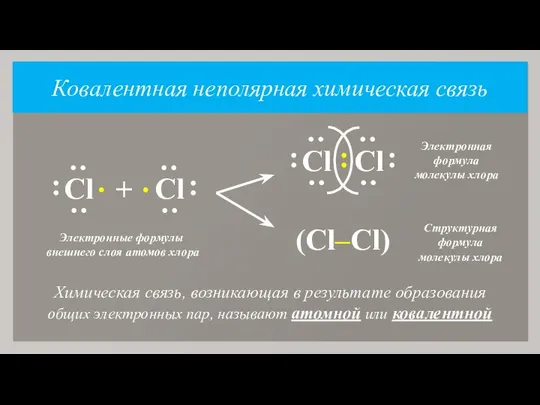
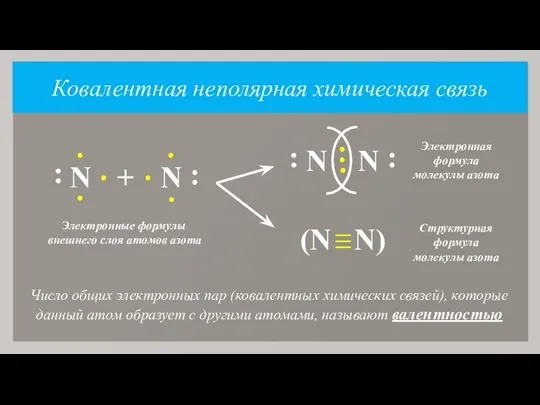
- 7. Ковалентная неполярная химическая связь Химическая связь, возникающая в результате образования общих электронных пар, называют атомной или
- 8. Число общих электронных пар (ковалентных химических связей), которые данный атом образует с другими атомами, называют валентностью
- 9. Так как молекулы простых веществ-неметаллов образованы атомами одного и того же химического элемента, то такую химическую
- 10. Некоторые вещества с ковалентной неполярной связью — алмаз, кремний, кристаллический бор — имеют ещё один тип
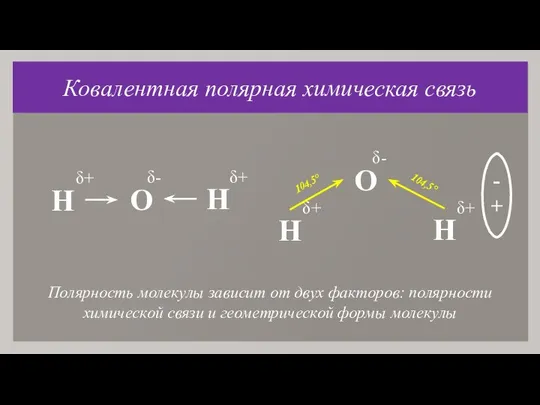
- 11. Ковалентная полярная химическая связь Химическая связь, возникающая в результате образования общих электронных пар с разными полюсами
- 12. Ковалентная полярная химическая связь H . O : : . + H O : : :
- 13. Ковалентная полярная химическая связь δ+ - + 104,5° Полярность молекулы зависит от двух факторов: полярности химической
- 14. Ковалентная полярная химическая связь Электроотрицательность — это способность атома химического элемента притягивать к себе общие электронные
- 15. Ковалентная связь, образующаяся между атомами с одинаковой электроотрицательностью, называют ковалентной неполярной связью Ковалентная связь, образующаяся между
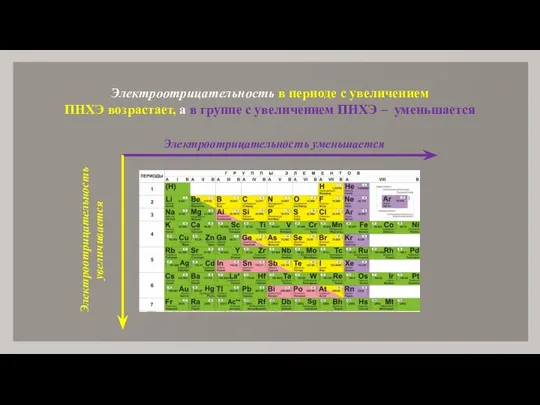
- 16. Электроотрицательность в периоде с увеличением ПНХЭ возрастает, а в группе с увеличением ПНХЭ – уменьшается Электроотрицательность
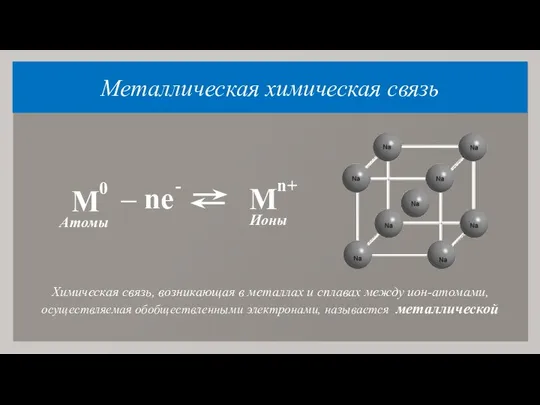
- 17. Металлическая химическая связь Химическая связь, возникающая в металлах и сплавах между ион-атомами, осуществляемая обобществленными электронами, называется
- 19. Скачать презентацию










 Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Неметаллические материалы
Неметаллические материалы Жесткость воды
Жесткость воды Новые пути использования парафиновых углеводородов
Новые пути использования парафиновых углеводородов Производство синтетических моющих средств
Производство синтетических моющих средств МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Петреня Игорь Михайлович, учитель химии и биологии госуд
МЕТАЛЛЫ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Петреня Игорь Михайлович, учитель химии и биологии госуд Нуклеиновые кислоты (строение, свойства и синтез). Тема 14
Нуклеиновые кислоты (строение, свойства и синтез). Тема 14 Аморфные материалы
Аморфные материалы Исследование синтетического наркотика – метилового эфира алкилиндазола (MDMB(N)-073), поиск и идентификация его метаболитов
Исследование синтетического наркотика – метилового эфира алкилиндазола (MDMB(N)-073), поиск и идентификация его метаболитов Вычисления по химическим уравнениям
Вычисления по химическим уравнениям Сложные эфиры
Сложные эфиры Тематическая викторина «Химические элементы, металлы и неметаллы»
Тематическая викторина «Химические элементы, металлы и неметаллы» Mechanistic insights into the aminolysis of 3,4-epoxysulfolane
Mechanistic insights into the aminolysis of 3,4-epoxysulfolane Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Шкала рН. Функции воды в организме
Шкала рН. Функции воды в организме Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон химических элементов Д. И. Менделеева и периодическая система Растворы жидкие, твердые, газообразные
Растворы жидкие, твердые, газообразные Основы строения и реакционной способности органических соединений. Сопряжение. Ароматичность. Электронные эффекты заместителей
Основы строения и реакционной способности органических соединений. Сопряжение. Ароматичность. Электронные эффекты заместителей Фазовые и агрегатные состояния полимеров
Фазовые и агрегатные состояния полимеров Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Откуда ты, химия ?
Откуда ты, химия ? Методы получения порошков карбидов
Методы получения порошков карбидов Фуллерены в супрамолекулярной химии (Лекция 7)
Фуллерены в супрамолекулярной химии (Лекция 7) Презентация на тему: Молекулы
Презентация на тему: Молекулы Общая характеристика элементов VI группы главной подгруппы. Кислород
Общая характеристика элементов VI группы главной подгруппы. Кислород Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены)