Содержание
- 2. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА – область химии, изучающая энергетику химических процессов, возможности и условия самопроизвольного протекания химических реакций,
- 3. Термодинамическая система (ТС) Объект изучения химической термодинамики термодинамическая система (ТС). ТС – это тело или группа
- 4. ТС бывают: 1. Изолированные – отсутствуют, какие-либо формы обмена с окружающей средой. 2. Открытыми – система
- 5. В ходе различных превращений система переходит из одного энергетического состояния в другое. То или иное состояние
- 6. Др. параметры, зависящие от основных, наз-ся ТД функциями состояния системы. В химии наиболее часто используются :
- 7. Также для описания состояния тс используют две функции процесса- это работа (А) и теплота (Q). Их
- 8. Внутренняя Энергия Внутренняя энергия системы (U) – это полная энергия системы, включающая кине-тическую энергию всех видов
- 9. Запас внутр. энергии системы зависит от параметров состояния системы, природы в-ва и прямо пропорционален массе вещества.
- 10. При переходе неизолированной системы из одного состояния в другое изменение её внутренней энергии осуществляется путём обмена
- 11. ТЕРМОХИМИЯ. ТЕРМОХИМ. УРАВНЕНИЯ. ТЕРМОХИМИЧЕСКИЕ РАСЧЁТЫ Раздел химии и хим. ТД, занятый расчётами тепловых эффектов, наз-ся термохимией.
- 12. В основе термохимических расчётов реакций лежит закон Гесса (1836 – 1841): Тепловой эффект реакции (ΔНр) не
- 13. 1. Тепловой эффект реакции равен сумме теплот обр-ния продуктов р-ции (Σν2ΔН0обр.прод.) за вычетом суммы теплот обр-ния
- 14. Поскольку абсолютные значения энергии (т.д. ф-ций) измерить принципиально невозможно, то для проведения термохим. расчётов вводят специальные
- 15. Для того, чтобы можно было теоретически рассчитать и сравнивать тепловые эффекты в основу термохимических расчетов положены
- 16. Стандартные условия стандартное давление – 0,1 МПа или 1 атм стандартная температура – 25°C или 298
- 17. Пример Рассчитать какое количество теплоты выделится при сгорании 8 г метана.
- 18. ЭНТРОПИЯ По з-ну сохранения энергии система может самопроизвольно совершать работу только за счёт собственной энергии, т.е.
- 19. Л.Больцман (1877): Т.д. вероятность W состояния системы – это число микросостояний, реализующих данное макросостояние: S =
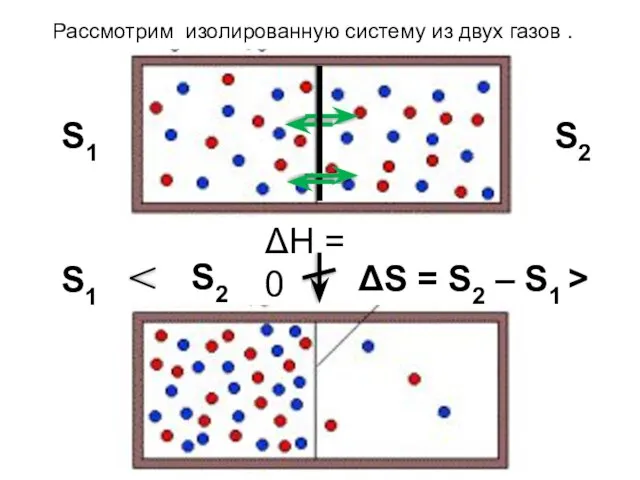
- 20. S1 S2 ΔН = 0 S1 S2 Рассмотрим изолированную систему из двух газов . ΔS =
- 21. 2-ой закон термодинамики В изолированной системе самопроизвольно протекают такие процессы, которые ведут к росту энтропии.
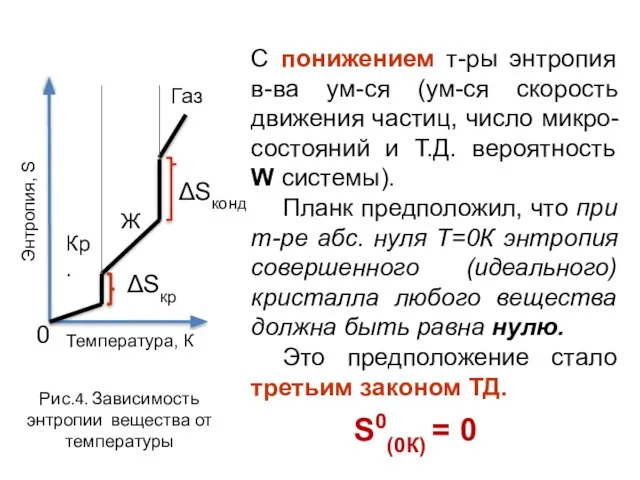
- 22. С понижением т-ры энтропия в-ва ум-ся (ум-ся скорость движения частиц, число микро-состояний и Т.Д. вероятность W
- 23. ΔS хим. реакции также не зависит от пути процесса, а определяется лишь энтропией начального и конечного
- 24. ЭНЕРГИЯ ГИББСА С учетом одновременного действия двух противоположных факторов движущей силой для р-ций, протекающих при P,T=const,
- 25. ΔG ΔG > 0 ΔG = 0 реакция термодинамически возможна При постоянной т-ре и давлении хим.
- 26. Энергия Гиббса связана с энтальпией, энтропией и температурой: G = H – Т⋅S. Её изм-ние ΔG:
- 27. Стандартная энергия Гиббса обр-ния в-ва (ΔG0обр. 298) – изм-ние энергии Гиббса в р-ции обр-ния 1 моль
- 29. Скачать презентацию
























 Вода - растворитель
Вода - растворитель Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы
Подготовка к ГИА. В2. Первоначальные сведения об органических веществах. Биологически важные вещества: белки, жиры, углеводы Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12)
Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12) Молекулярная биология для биоинформатиков Академический университет Ефимова Ольга Алексеевна
Молекулярная биология для биоинформатиков Академический университет Ефимова Ольга Алексеевна  Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно
Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно Газдық фазадан химиялық тұндыру технологиясы (CVD)
Газдық фазадан химиялық тұндыру технологиясы (CVD) Сплавы со специальными свойствами
Сплавы со специальными свойствами Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно
Презентация по Химии "Готовимся к экзамену по химии" - скачать смотреть бесплатно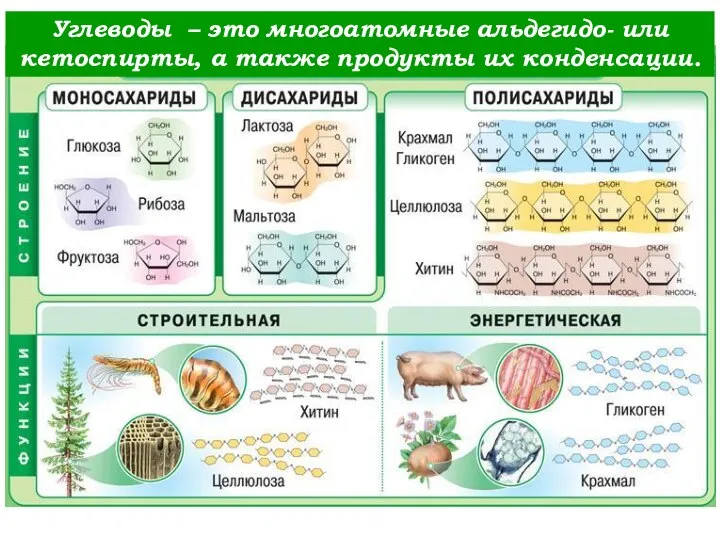 Углеводы. Классификация углеводов. Явление мутаротации. (Лекция 4)
Углеводы. Классификация углеводов. Явление мутаротации. (Лекция 4) Алюминиевые сплавы
Алюминиевые сплавы Химическая термодинамика
Химическая термодинамика Гравиметрический метод анализа
Гравиметрический метод анализа Окислительно-восстановительные потенциалы (электродные потенциалы)
Окислительно-восстановительные потенциалы (электродные потенциалы) Железо. Электронное строение железа
Железо. Электронное строение железа Геохимия, как наука
Геохимия, как наука Пути обмена глюкозо-6 фосфата в тканях. Анаэробное расщепление глюкозы. Спиртовое брожение. Метаболизм этанола. (Тема 2)
Пути обмена глюкозо-6 фосфата в тканях. Анаэробное расщепление глюкозы. Спиртовое брожение. Метаболизм этанола. (Тема 2) Вода Самое удивительное вещество
Вода Самое удивительное вещество Карбоновые кислоты
Карбоновые кислоты Строение электронных оболочек атомов
Строение электронных оболочек атомов Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Презентация по Химии "Кто хочет стать отличником" - скачать смотреть бесплатно
Презентация по Химии "Кто хочет стать отличником" - скачать смотреть бесплатно Химические свойства воды
Химические свойства воды Особенности химического состава клетки
Особенности химического состава клетки Основы общей химии. Кинетика
Основы общей химии. Кинетика Содержание ртути и её соединений в воздухе при использовании осветительных ламп
Содержание ртути и её соединений в воздухе при использовании осветительных ламп Строение и обмен липидов
Строение и обмен липидов Строение газообразных, жидких, твердых тел
Строение газообразных, жидких, твердых тел