Содержание
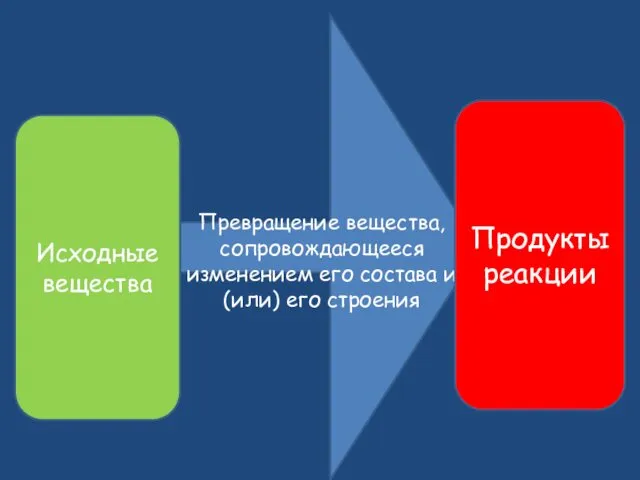
- 2. Превращение вещества, сопровождающееся изменением его состава и (или) его строения Исходные вещества Продукты реакции
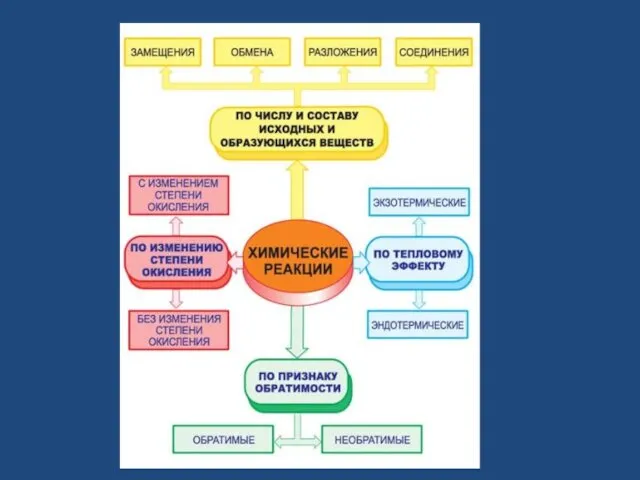
- 3. Признаки химических реакций Выделение или поглощение газа Образование осадка Изменение цвета вещества Выделение или поглощение тепла
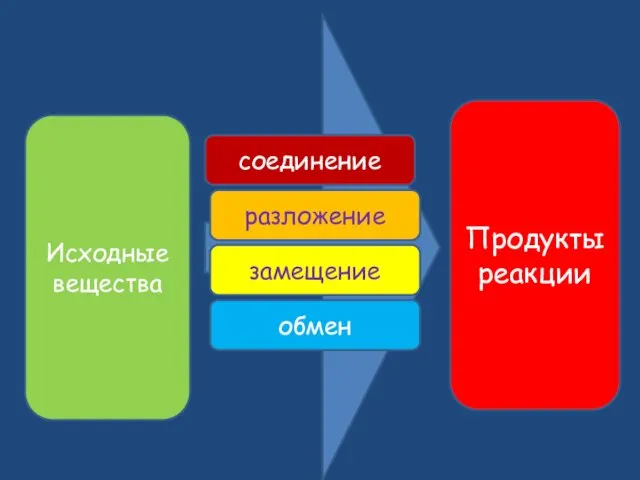
- 8. Исходные вещества Продукты реакции соединение разложение замещение обмен
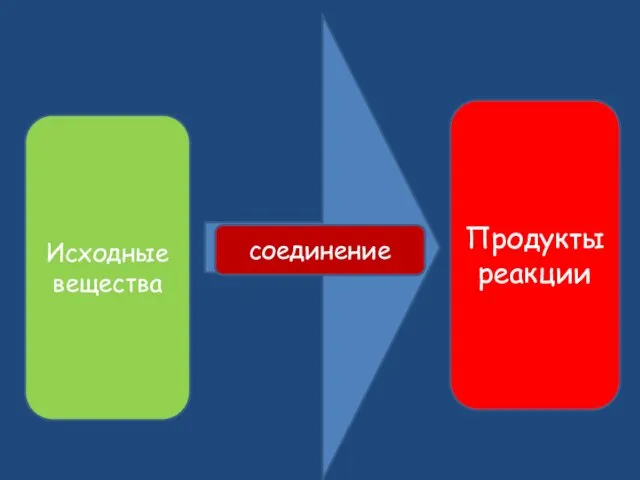
- 9. Исходные вещества Продукты реакции соединение
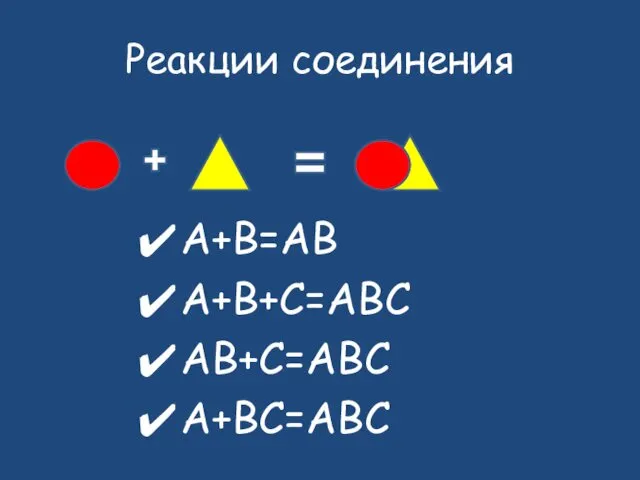
- 10. Реакции соединения А+B=AB A+B+C=ABC AB+C=ABC A+BC=ABC
- 11. 4Fe + 3O2 = 2Fe2O3 выделение тепла излучение света изменение цвета вещества
- 12. Выберите реакцию NaOH + HCl → NaCl + H2O CaCO3 → CaO + CO2 Fe +
- 13. Исходные вещества Продукты реакции разложение
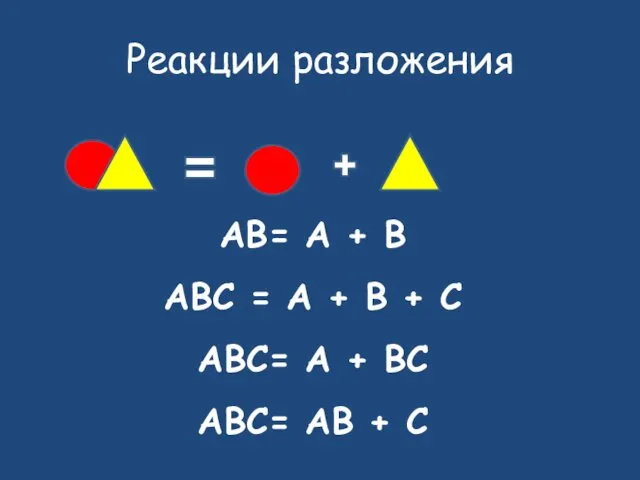
- 14. Реакции разложения AB= A + B ABC = A + B + C ABC= A +
- 15. (NH4)2Cr2O7 = N2+4H2O+Cr2O3 изменение цвета выделение тепла выделение газа
- 16. Выберите реакцию NaOH + HCl → NaCl + H2O CaCO3 → CaO + CO2 Fe +
- 17. Исходные вещества Продукты реакции замещение
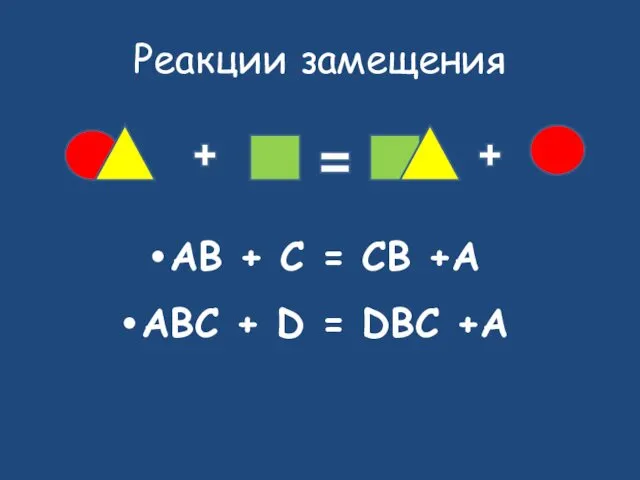
- 18. Реакции замещения AB + C = CB +A ABC + D = DBC +A
- 19. Zn + 2HCl = ZnCl2 + H2 выделение газа растворение металла
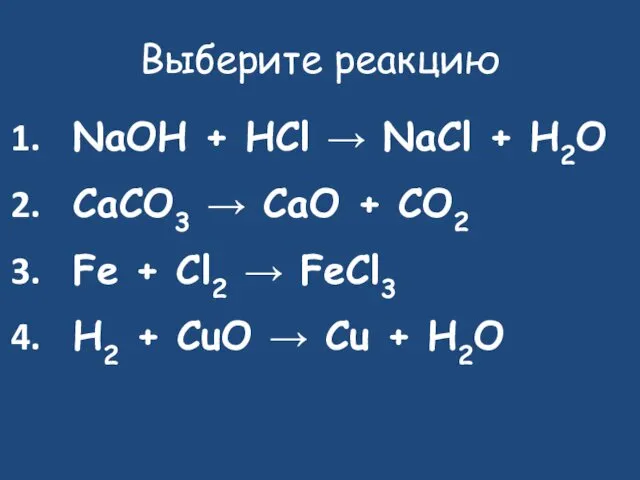
- 20. Выберите реакцию NaOH + HCl → NaCl + H2O CaCO3 → CaO + CO2 Fe +
- 21. Исходные вещества Продукты реакции обмен
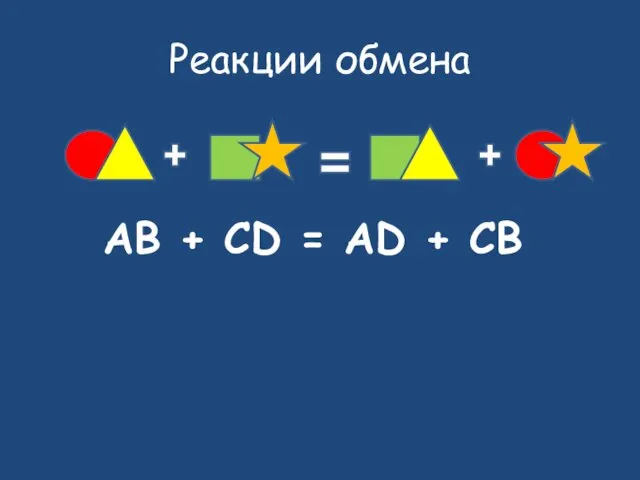
- 22. Реакции обмена AB + CD = AD + CB
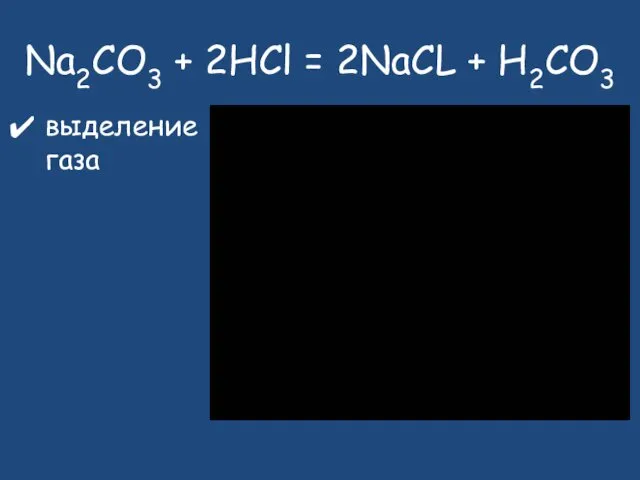
- 23. Na2CO3 + 2HCl = 2NaCL + H2CO3 выделение газа
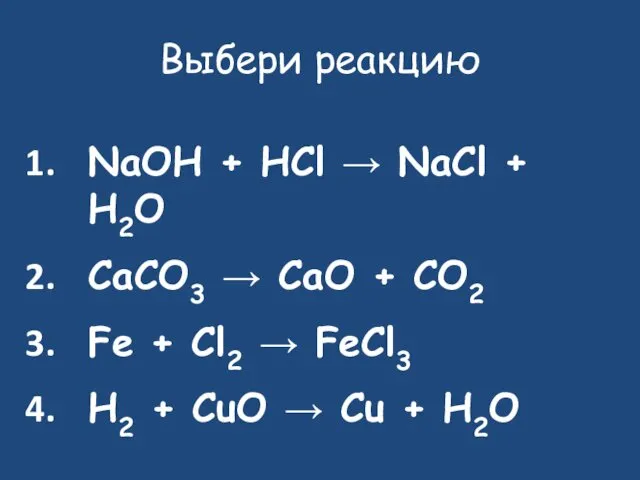
- 24. Выбери реакцию NaOH + HCl → NaCl + H2O CaCO3 → CaO + CO2 Fe +
- 25. Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате
- 26. Данный закон позднее (1789 г.) подтвердил французский химик А. Лавуазье Все перемены в натуре случающиеся такого
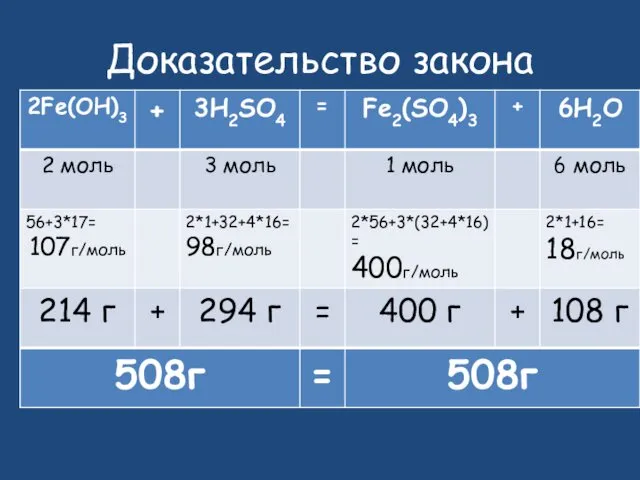
- 27. Доказательство закона
- 29. Обратимая реакция - реакция, которая в данных условиях может протекать как в прямом, так и в
- 30. Закон Бертолле основной закон направления обратимых химических взаимодействий, который можно формулировать так: всякий химический процесс протекает
- 31. CH4+ 2O2 = CO2 +2H2O + 802 кДж. Количество теплоты, которое выделяется или поглощается в результате
- 32. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с
- 33. Реакции, протекающие с выделением теплоты и света называются реакциями горения
- 35. Скачать презентацию

















 Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13)
Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13) Презентация по Химии "«Белки»" - скачать смотреть
Презентация по Химии "«Белки»" - скачать смотреть 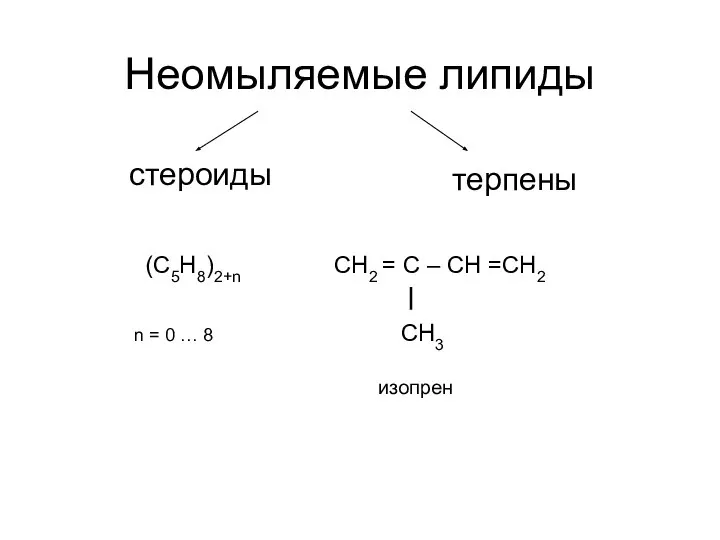 Неомыляемые липиды. Стероиды
Неомыляемые липиды. Стероиды Минералы горных пород
Минералы горных пород ГИА. А1: Строение атомов первых 20 химических элементов ПСХЭ
ГИА. А1: Строение атомов первых 20 химических элементов ПСХЭ Химия и наркотические вещества
Химия и наркотические вещества Формирование навыков научно-исследовательской деятельности школьников 5-7 классов
Формирование навыков научно-исследовательской деятельности школьников 5-7 классов АМОРФНЫЕ И НАНОКРИСТАЛЛИЧЕСКИЕ МЕТАЛЛЫ И СПЛАВЫ
АМОРФНЫЕ И НАНОКРИСТАЛЛИЧЕСКИЕ МЕТАЛЛЫ И СПЛАВЫ Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс)
Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс) неделя биологии и химии
неделя биологии и химии Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Кумарины
Кумарины Индикаторный метод титрования
Индикаторный метод титрования Задачи по химии
Задачи по химии Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно
Презентация по Химии "ВИЩІ КАРБОНОВІ КИСЛОТИ.МИЛА, СИНТЕТИЧНІ МИЮЧІ ЗАСОБИ" - скачать смотреть бесплатно Локальная депассивация и локальные коррозионные процессы
Локальная депассивация и локальные коррозионные процессы Альдегиды. (10 класс)
Альдегиды. (10 класс) Интерактивные игры. Химия
Интерактивные игры. Химия Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8)
Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8) Производные карбоновых кислот
Производные карбоновых кислот Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Диагностическое тестирование по химии в 8 классе
Диагностическое тестирование по химии в 8 классе Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2)
Номенклатура органических соединений. Структурные формулы соединений. Алканы. (Лабораторная работа 2) Раствор. Отчет
Раствор. Отчет Химические свойства алкенов
Химические свойства алкенов Autoionization of water Hydrolysis of salts
Autoionization of water Hydrolysis of salts Способы количественного определения белка. (Лекция 10)
Способы количественного определения белка. (Лекция 10) Вода - растворитель
Вода - растворитель