Содержание
- 2. Литература 1. Попков В.А., Пузаков С.А. Общая химия: Учебник. - М.: ГЭОТАР-Медиа, 2010. -976 с. 2.
- 3. 3. Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие для студентов мед. вузов. - 3-е
- 4. Интернет-источники http://www.chemlib.ru http://http://www.chem.msu.su http://www.xumuk.ru/ http://www.alhimik.ru/ http://alhimikov.net/ http://chemistry.narod.ru/ http://www.chemport.ru/
- 5. I. Элементы химической термодинамики
- 6. Термодинамика - наука, изучающая общие законы взаимного превращения одной формы энергии в другую.
- 7. К настоящему времени термодинамика содержит два основных раздела: 1.Равновесная термодинамика (термодинамика изолированных систем) 2. Неравновесная термодинамика
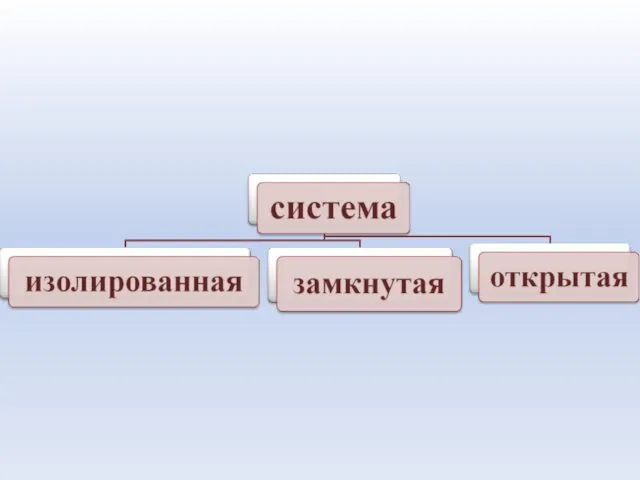
- 8. Система – это совокупность материальных объектов (тел), ограниченных каким-либо образом от окружающей среды Элементы системы -
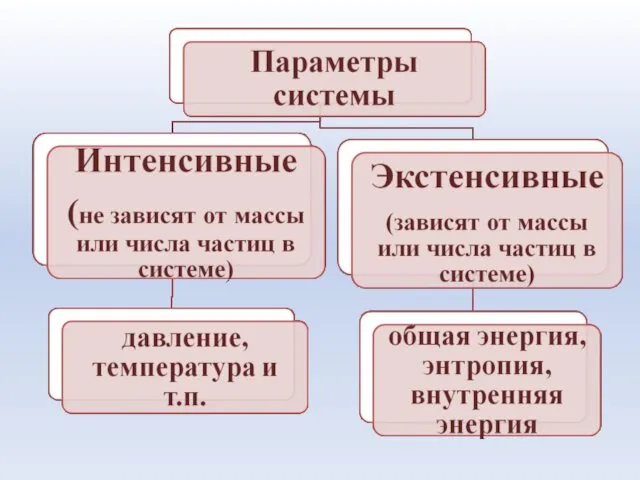
- 9. Термодинамические системы: • Гомогенная – система, в которой каждое ее свойство (параметр) имеет одно и то
- 11. Изолированная система – система , которая не обменивается с окружающей средой ни веществом, ни энергией в
- 12. Открытая система – система, которая обменивается с окружающей средой и энергией, и веществом.
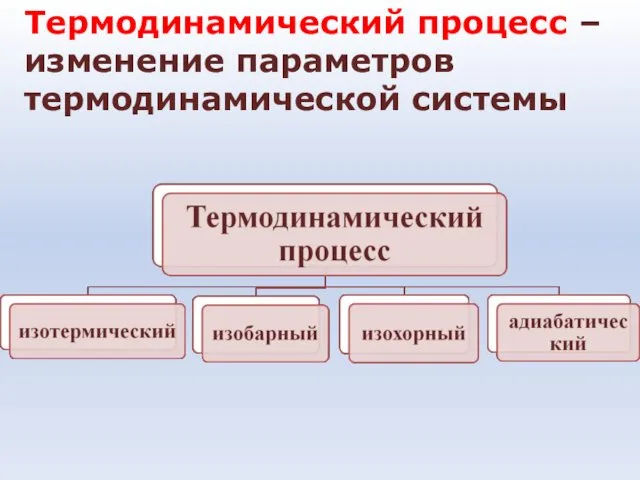
- 14. Термодинамический процесс – изменение параметров термодинамической системы
- 15. Энергия системы (W) - совокупность двух частей: зависящей от движения и положения системы как целого (Wц)
- 16. Первое начало термодинамики термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт
- 17. Энтальпия (Н) Qp= ΔU + A (1), где А – работа по перемещению поршня Qp= ΔU
- 18. Энтальпия Н - внутреннее теплосодержание системы Для экзотермических реакций Q>0, ΔH Для эндотермических реакций Q 0
- 19. Количество теплоты, выделяющееся или поглощающееся в результате химической реакции, называется тепловым эффектом химической реакции. Термохимия –
- 20. Закон Гесса: Тепловой эффект химических реакций, протекающих при постоянном давлении или при постоянном объёме, не зависит
- 21. В термодинамике принята следующая запись теплот химических реакций: С(тв)+О2(г)=СО2(г); ∆НР=-405,8 кДж в термохимии: С(тв) + О2(г)
- 22. Теплотой сгорания вещества называется тепловой эффект реакции сгорания его (1 моль) с образованием устойчивых продуктов (для
- 23. Первое следствие закона Гесса: Теплота реакции равна сумме теплот сгорания начальных участников реакции за вычетом суммы
- 24. Стандартная теплота образования вещества - тепловой эффект реакции образования одного моль вещества из простых веществ в
- 25. Второе следствие закона Гесса: Теплота реакции равна сумме теплот образования конечных веществ за вычетом суммы теплот
- 26. Пример: аА + bB→сС + dD ∆Hреакц. = [с ⋅∆Hобр(С) + d ⋅∆Hобр(D)] – [а ⋅
- 27. Второе начало термодинамики Постулат Клаузиуса Единственным результатом любой совокупности процессов не может быть переход теплоты от
- 28. Постулат Томсона Теплота наиболее холодного из участвующих в процессе тел не может служить источником работы. (Теплота
- 29. Энтропия – функция состояния термодинамической системы, используемая во втором законе т/д для выражения через нее возможности
- 30. Изменение энтропии определяется отношением количества теплоты, сообщенного системе или отведенного от нее, к температуре системы: где
- 31. Если энтропия увеличивается (S > 0), то самопроизвольный неравновесный процесс возможен, если S
- 32. Все самопроизвольные процессы в изолированных системах идут в сторону увеличения энтропии до достижения равновесия, где она
- 33. Изобарно-изотермический потенциал (Свободная энергия Гиббса) ΔG = ΔH – T · ΔS где ΔH – изменение
- 34. Третье начало термодинамики В. Нернст (1906) (тепловой закон Нернста): энтропия S любой системы стремится к конечному
- 35. II. ХИМИЧЕСКАЯ КИНЕТИКА
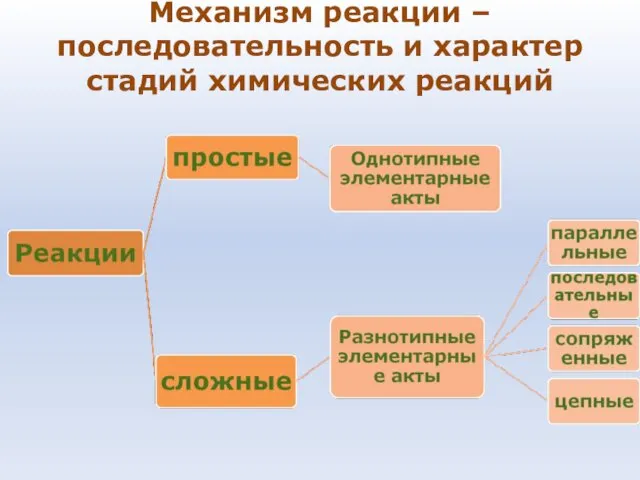
- 36. Химическая кинетика занимается исследованием механизмов реакций и течения их во времени
- 37. Механизм реакции – последовательность и характер стадий химических реакций
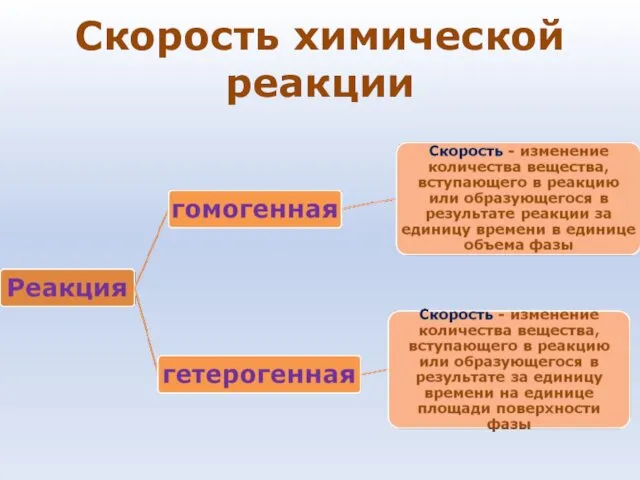
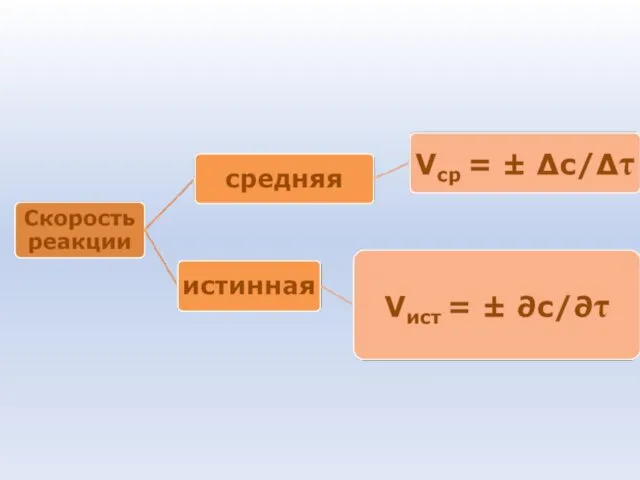
- 38. Скорость химической реакции
- 40. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ Концентрация реагирующих веществ Температура Присутствие катализаторов
- 41. Закон действующих масс (К. Гульдберг и П. Вааге) при постоянной температуре скорость химической реакции прямо пропорциональна
- 42. Константа скорости k не зависит от концентраций веществ Закон действующих масс применим только к газообразным и
- 43. ПРИМЕРЫ СuО(к) + Н2 (г) = Сu (к) + Н2О (г) v=kC(H2) H2(г) + I2(г) =
- 44. Молекулярность и порядок реакций Молекулярность реакции - число молекул, участвующих в элементарном акте химического взаимодействия Порядок
- 45. Реакция первого порядка C = C0 ⋅ e–kt или lnC = lnC0 – kt С –
- 46. Время, в течение которого прореагировала половина начального количества вещества, называется временем полураспада и обозначается τ1/2. Для
- 47. Зависимость скорости реакции от температуры. Правило Вант-Гоффа при повышении температуры на каждые 10° скорость реакции увеличивается
- 48. Температурный коэффициент реакции (γ) -число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры
- 49. Уравнение Аррениуса k = A ⋅ e–Ea/RT R – универсальная газовая постоянная, 8,314 Дж/моль·К, Т –
- 50. Энергия активации (Еа) - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло
- 51. Уравнение Аррениуса позволяет рассчитать константы скорости реакций при различных температурах: а так же при изменении энергии
- 52. III. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 53. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём
- 54. Термодинамически химическое равновесие определяется как соотношение концентраций исходных веществ и продуктов реакции, при котором энтропия системы
- 55. Константа химического равновесия mA + nB ↔ pC + qD v1= k1 ·CАm ·CBn v2=k2 ·CCp
- 56. Константа равновесия Кр - частное от деления произведения равновесных концентраций продуктов и исходных веществ реакции (является
- 57. Константа равновесия и энергия Гиббса. Константа химического равновесия зависит от природы реагентов, от температуры и связана
- 58. Смещение химического равновесия. Принцип Ле Шателье: если на систему, находящуюся в равновесии, воздействовать извне, то в
- 59. Влияние давления Повышение давления, согласно принципу Ле-Шателье, должно смещать равновесие в сторону образования меньшего количества моль
- 60. Влияние концентрации Если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в
- 61. Влияние температуры на константу равновесия химической реакции выражается уравнениями изобары и изохоры Вант-Гоффа: где ΔН= QP,
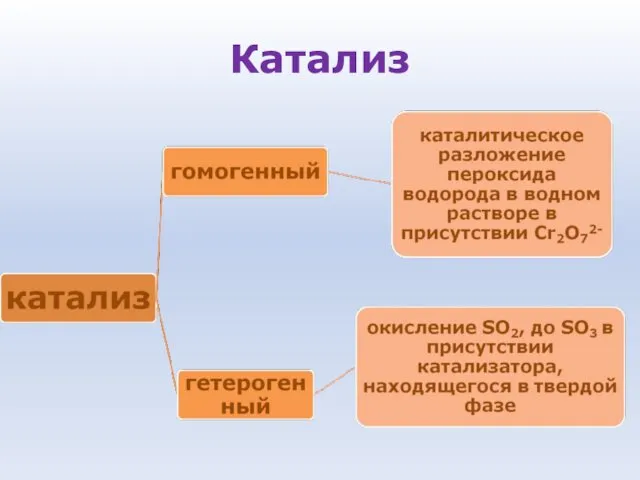
- 62. Катализ Катализ - процесс увеличения скорости реакции с помощью катализатора Катализаторы - вещества, которые увеличивают скорость
- 63. Особенности катализаторов: • Ускоряют реакцию, присутствуя в очень малых количествах • Избирательность действия, то есть катализатор
- 64. Катализ
- 65. Механизм гомогенной каталитической реакции А+В К АВ A + K = AK AK + B =
- 67. Скачать презентацию

























































 Химический состав молока
Химический состав молока Комплексные (координационные) соединения. Строение
Комплексные (координационные) соединения. Строение Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии»
Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии» Производство аммиака
Производство аммиака Классификация неорганических веществ
Классификация неорганических веществ Токсичность. Параметры токсичности
Токсичность. Параметры токсичности Алкены
Алкены Презентация по Химии "Белый фосфор" - скачать смотреть
Презентация по Химии "Белый фосфор" - скачать смотреть  Поверхностные явления
Поверхностные явления Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Химия нефти и газа
Химия нефти и газа Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Краски. Виды красок
Краски. Виды красок «Природные источники углеводородов и их переработка»
«Природные источники углеводородов и их переработка» Процессы соосаждения. Радионуклид без носителя. Индикаторные количества
Процессы соосаждения. Радионуклид без носителя. Индикаторные количества Явление изоморфизма в геохимии
Явление изоморфизма в геохимии Алкены
Алкены Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Вопросы ИК-спектроскопии органических соединений
Вопросы ИК-спектроскопии органических соединений Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории
Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории Physical chemistry of surface phenomena. Basics of adsorptive therapy
Physical chemistry of surface phenomena. Basics of adsorptive therapy Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Альбітит-грейзенові родовища
Альбітит-грейзенові родовища ОДНОАТОМНЫЕ СПИРТЫ !! МОУ СПИРТЫ Учитель химии Галимова Э.И.
ОДНОАТОМНЫЕ СПИРТЫ !! МОУ СПИРТЫ Учитель химии Галимова Э.И. Биосинтез пуриновых и пиримидиновых нуклеотидов. (Лекция 5)
Биосинтез пуриновых и пиримидиновых нуклеотидов. (Лекция 5) Альдегидтер мен кетондар
Альдегидтер мен кетондар Тұндыру әдістері
Тұндыру әдістері