Содержание
- 2. Содержание I закон термодинамики, его применение для расчёта тепловых эффектов. II и III законы термодинамики. Энтропия
- 3. Библиографический список Стромберг А. Г. Физическая химия / А. Г. Стромберг, Д. П. Семченко – М.:
- 4. I закон термодинамики, его применение для расчёта тепловых эффектов Основные понятия термодинамики. I закон (начало) термодинамики.
- 5. Предмет термодинамики Термодинамика изучает положения и законы, описывающие обмен энергией между изучаемой системой и внешней средой,
- 6. Основные понятия термодинамики Система (С.) − тело или группа тел, находящихся во взаимосвязи и мысленно обособленных
- 7. Основные понятия термодинамики Фаза − часть системы, одинаковая по составу, физическим и химическим свойствам и отделённая
- 8. Основные понятия термодинамики Т/Д параметры − характеризуют состояние системы. Различают экстенсивные параметры (аддитивны): m – масса;
- 9. Основные понятия термодинамики Функции состояния (U, H, S, G, A) − Т/Д функции, значения которых зависят
- 10. I закон (начало) термодинамики (закон сохранения энергии) - В любой изолированной системе общий запас энергии постоянен.
- 11. I закон термодинамики Внутренняя энергия U – общий запас энергии системы, которая складывается из кинетической и
- 12. Применение I закона термодинамики Термохимия – раздел, посвящённый изучению тепловых эффектов химических и физико-химических процессов. Тепловой
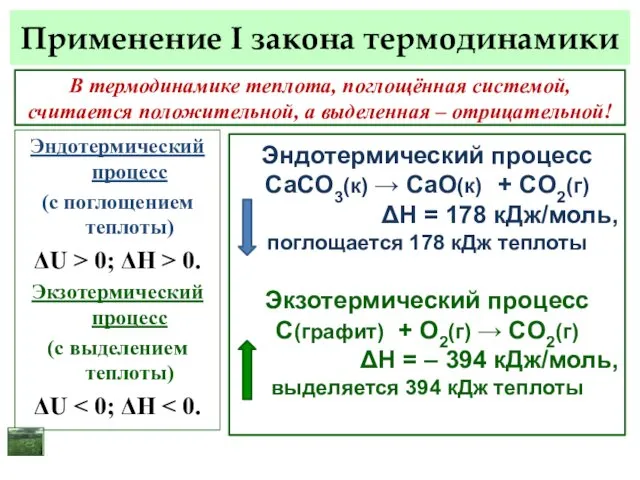
- 13. Применение I закона термодинамики Эндотермический процесс (с поглощением теплоты) ΔU > 0; ΔH > 0. Экзотермический
- 14. Применение I закона термодинамики Связь между изобарным и изохорным тепловыми эффектами: ΔH = ΔU + РΔV
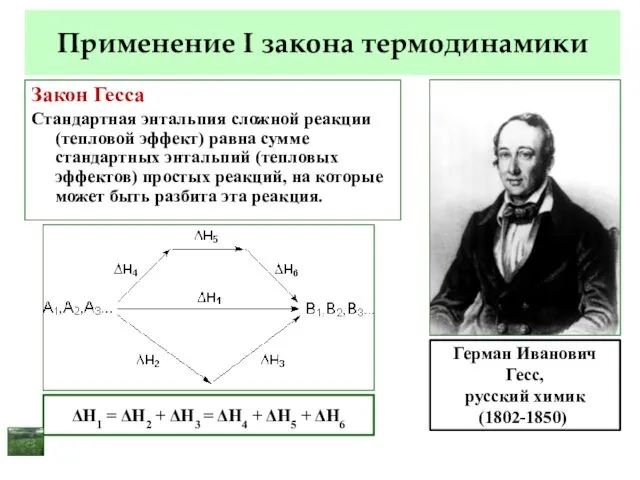
- 15. Применение I закона термодинамики Закон Гесса Стандартная энтальпия сложной реакции (тепловой эффект) равна сумме стандартных энтальпий
- 16. Применение I закона термодинамики Расчёты ΔΗ любого процесса основаны на свойстве энтальпии являться функцией состояния! 1)
- 17. Применение I закона термодинамики ΔtrsΗ0 – стандартная энтальпия фазового перехода (тепловой эффект фазового перехода при стандартном
- 18. Применение I закона термодинамики Особенности термодинамического уравнения: Указываются агрегатные состояния веществ. Допускаются дробные коэффициенты. С термодинамическими
- 19. Применение I закона термодинамики Пример 2. Определить при Т = 298 К тепловой эффект реакции разложения
- 20. Применение I закона термодинамики Для реакций с участием органических веществ тепловой эффект можно рассчитывать по стандартным
- 21. Применение I закона термодинамики 2) Тепловые эффекты процессов растворения Интегральная энтальпия (теплота) растворения ΔsΗ0 зависит от
- 22. Влияние температуры на тепловой эффект (уравнение Кирхгофа) Характер влияния температуры на тепловой эффект в соответствии с
- 23. Анализ уравнения Кирхгофа если ΔСР > 0, то dΔΗ/dТ > 0, т. е. с увеличением температуры
- 24. Расчёт теплового эффекта при любой температуре Уравнение Кирхгофа в интегральной форме ΔrΗ298 = ∑νi ΔfΗ0(прод) –
- 25. Расчёт теплового эффекта при любой температуре Расчёт ΔrΗТ с различными приближениями Первое приближение: ΔСР = ΔС0Р,298;
- 26. Влияние температуры на тепловой эффект Пример 3. Определить тепловой эффект реакции С2Н5ОН(г) + 3О2(г) = 2СО2(г)
- 27. Влияние температуры на тепловой эффект (уравнение Кирхгофа) ΔrΗТ = ΔrΗ298 + = ΔrΗ298 + ΔСР,298· (Т
- 28. Качественная оценка тепловых эффектов различных процессов С выделением теплоты (ΔrH – реакции горения (взаимодействие веществ с
- 29. II и III законы термодинамики. Энтропия и её расчёт в различных процессах II закон (начало) термодинамики.
- 30. II закон (начало) термодинамики I закон термодинамики позволяет определять теплоту и работу, но не даёт ответа
- 31. II закон (начало) термодинамики Формулировка Оствальда Невозможно создание вечного двигателя второго рода, т. е. невозможно построить
- 32. II закон (начало) термодинамики II закон термодинамики также был установлен как постулат, но в отличие от
- 33. II закон (начало) термодинамики Накопленный человечеством опыт показывает, что самопроизвольное протекание процессов в системе возможно только
- 34. II закон (начало) термодинамики II закон (начало) термодинамики особенно наглядно проявляется в работе тепловых машин, для
- 35. II закон (начало) термодинамики Пусть система переходит из состояния 1 в состояние 2 с поглощением теплоты.
- 36. II закон (начало) термодинамики Из принципа Каратеодори следует утверждение о существовании новой функции, которая связана с
- 37. Энтропия как критерий самопроизвольного протекания процесса Для изолированных систем (U = const; V = const) теплообмен
- 38. Изменение энтропии в процессах Энтропия S – мера беспорядка (хаоса) или степень неупорядоченности системы – функция
- 39. Увеличение энтропии в процессах Изменение агрегатного состояния вещества: т → ж → г и увеличение температуры
- 40. Статистическое обоснование II закона термодинамики Всякая изолированная система стремится перейти из состояния менее вероятного в состояние
- 41. Расчёт изменения энтропии в различных процессах 1. При фазовом превращении 1 моль вещества (Т = const;
- 42. Расчёт изменения энтропии в различных процессах 4. В химических реакциях: При Т = 298 К ΔrS
- 43. Расчёт изменения энтропии вещества при изменении температуры Пример 4. Определить изменение энтропии при охлаждении 320 г
- 44. Расчёт изменения энтропии вещества при изменении температуры
- 45. Расчёт изменения энтропии вещества при изменении температуры
- 46. Расчёт изменения энтропии в химической реакции Пример 5. Определить изменение энтропии при температурах 298 К и
- 47. Расчёт изменения энтропии в химической реакции
- 48. Третий закон термодинамики Известен также как постулат Планка - энтропия идеального кристалла при абсолютном нуле равна
- 49. Энергия Гиббса, энергия Гельмгольца, их практическое значение Энергия Гиббса и энергия Гельмгольца, их физический смысл. Энергия
- 50. Энергия Гиббса Энергия Гиббса (изобарно-изотермический потенциал или свободная энергия) – G Из объединённого уравнения I и
- 51. Энергия Гельмгольца Энергия Гельмгольца (изохорно-изотермический потенциал) – A Из объединённого уравнения I и II законов термодинамики
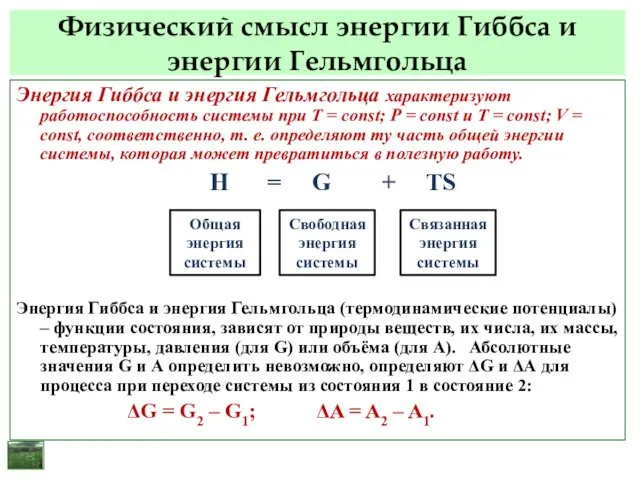
- 52. Физический смысл энергии Гиббса и энергии Гельмгольца Энергия Гиббса и энергия Гельмгольца характеризуют работоспособность системы при
- 53. Полные дифференциалы термодинамических потенциалов A и G После дифференцирования выражений А = U – TS и
- 54. Энергии Гельмгольца и Гиббса как критерий самопроизвольного протекания процесса В закрытой системе всякий самопроизвольный процесс протекает
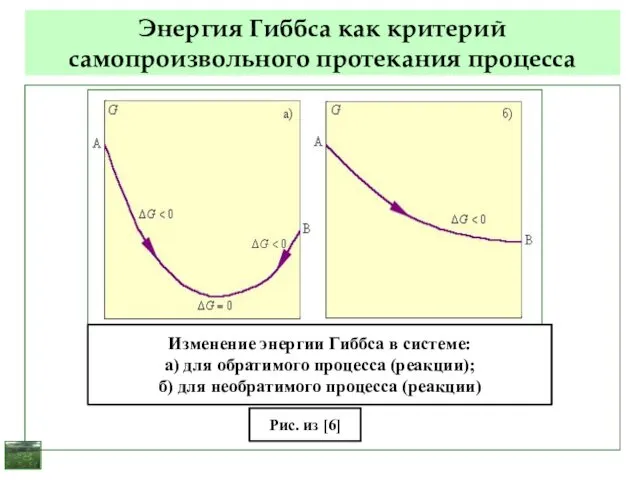
- 55. Энергия Гиббса как критерий самопроизвольного протекания процесса Изменение энергии Гиббса в системе: а) для обратимого процесса
- 56. Знаки ΔН, ΔS, ΔG и направление самопроизвольного протекания реакции ΔG = ΔH – TΔS
- 57. Характеристические функции. Уравнения Гиббса-Гельмгольца Характеристическими называют термодинамические функции, посредством которых или их производных могут быть выражены
- 58. Стандартная энергия Гиббса образования вещества ΔfG0298, кДж/моль – стандартная энергия Гиббса образования 1 моль вещества из
- 59. Стандартная энергия Гиббса образования вещества Пример 6. Определить наиболее устойчивое вещество в ряду карбонатов: Na2CO3(К), BaCO3(К),
- 60. Расчёт изменения энергии Гиббса в химических реакциях При Т = 298 К 1) ΔrG0298 = ∑νi
- 61. Расчёт изменения энергии Гиббса в химических реакциях Пример 7. Определить при температурах 298 и 800 К
- 62. Расчёт изменения энергии Гиббса в химических реакциях Расчет ΔrG при 298 К 2 способом по уравнению
- 63. Качественная оценка направления протекания процесса
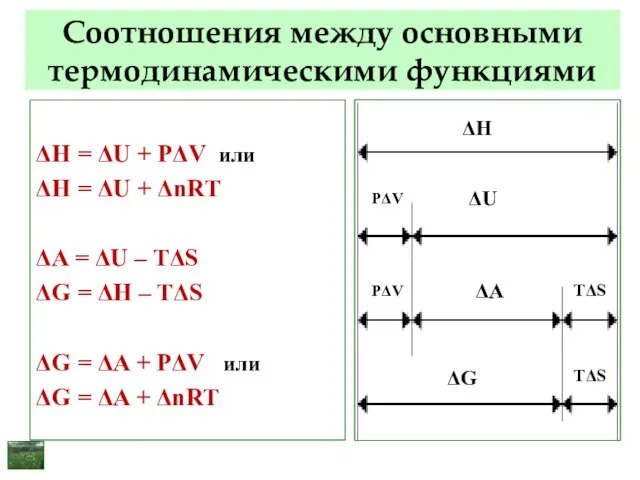
- 64. Соотношения между основными термодинамическими функциями ΔH = ΔU + РΔV или ΔH = ΔU + ΔnRT
- 65. Химический потенциал При протекании химических реакций в открытых системах состав и масса каждого компонента изменяются, что
- 66. Химический потенциал Дж. Гиббс ввёл представление о химическом потенциале − частной производной G по количеству i-того
- 67. Химический потенциал Для многокомпонентной системы при T = const и Р = const Критерий самопроизвольного протекания
- 68. Химический потенциал µ = f(T, P, C, природы вещества). При Т = const химический потенциал i-того
- 69. Химический потенциал При Т = const химический потенциал i-того компонента µi в системе зависит от его
- 71. Скачать презентацию































































 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Характеристика металу Алюміній
Характеристика металу Алюміній Стискання газів. Рівняння Менделєєва-Клапейрона
Стискання газів. Рівняння Менделєєва-Клапейрона Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Химический брейн-ринг
Химический брейн-ринг Железо и его соединения
Железо и его соединения  Водород как элемент и простое вещество
Водород как элемент и простое вещество Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Многоатомные спирты
Многоатомные спирты Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Химическая лаборатория
Химическая лаборатория Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Презентация Химия и русский язык
Презентация Химия и русский язык Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Лекарства
Лекарства Получение металлов
Получение металлов Платина. Знаходження в періодичній системі і основні характеристики
Платина. Знаходження в періодичній системі і основні характеристики Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Эпоксидные смолы
Эпоксидные смолы Органические соединения и их классификация
Органические соединения и их классификация Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Изотермический процесс в реакционном объеме. (Тема 6.2)
Изотермический процесс в реакционном объеме. (Тема 6.2) Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности
Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности Оксиди
Оксиди Топливо. Виды топлива
Топливо. Виды топлива Каучук, резина и другие
Каучук, резина и другие Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”