Содержание
- 2. Условия образования химической связи. 1 Виды химической связи. 2 Параметры химической связи. 3 Ковалентная связь. 4
- 3. Фундаментальной основой химической связи явилась теория химического строения А. М. Бутлерова (1861 г.), согласно которой свойства
- 4. Условия образования химической связи: 1 снижение общей энергии многоатомной системы по сравнению с суммарной энергией изолированных
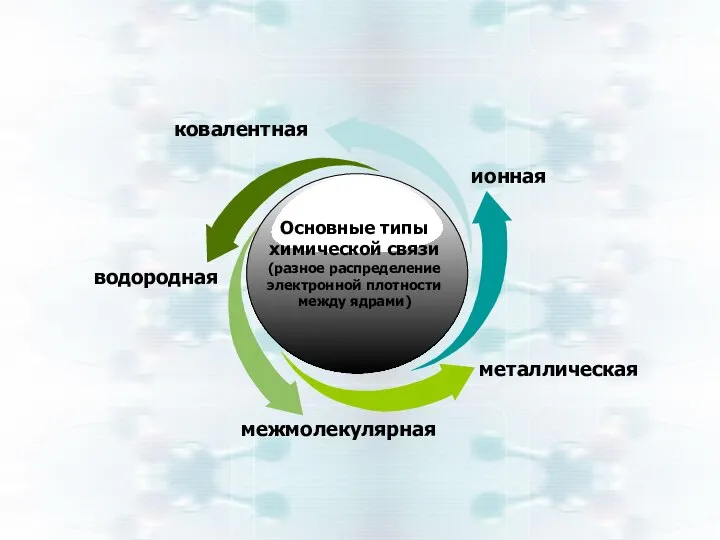
- 5. Основные типы химической связи (разное распределение электронной плотности между ядрами) ковалентная ионная металлическая межмолекулярная водородная
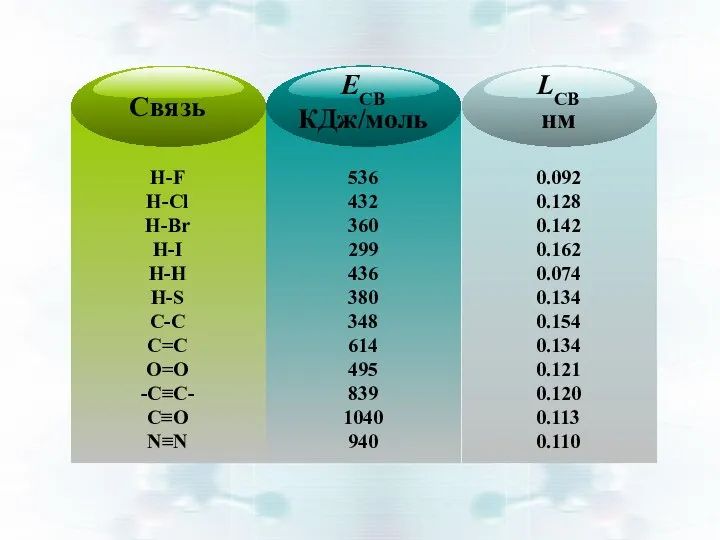
- 6. Энергия связи Есв , кДж/моль: количество энергии, выделяющееся при образовании химической связи СН4 : Есв =
- 7. Длина связи lсв , нм: межъядерное расстояние взаимодействующих атомов lсв зависит от размеров электронных оболочек и
- 8. Кратность связи: количество связей между взаимодействующими атомами Чем выше кратность связи, тем больше Есв и устойчивее
- 9. Чем меньше lсв, тем больше Есв и устойчивее молекула Чем выше кратность связи, тем больше Есв
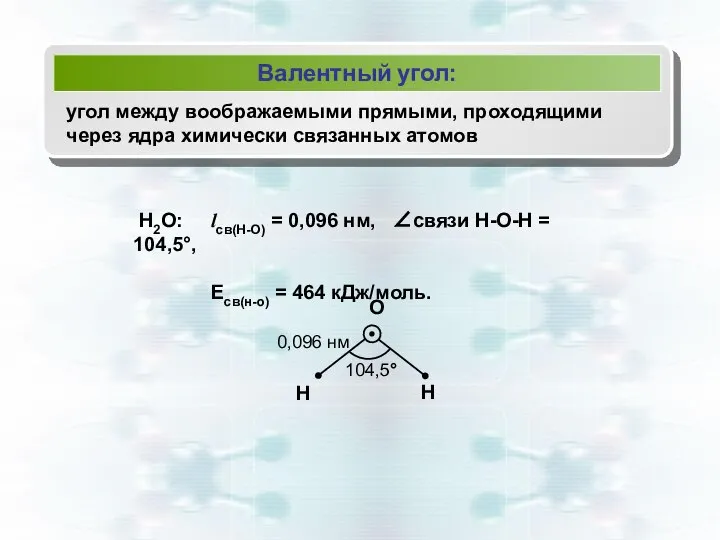
- 11. Валентный угол: угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов Н2О: lсв(Н-О) = 0,096
- 12. КОВАЛЕНТНАЯ СВЯЗЬ: химическая связь, образованная в результате обобществления валентных электронов в области связывания (между ядрами атомов)
- 13. Квантово-механический расчет взаимодействия атомов Н Из уравнения Шредингера ⇒ Есист = f (r ), где r-
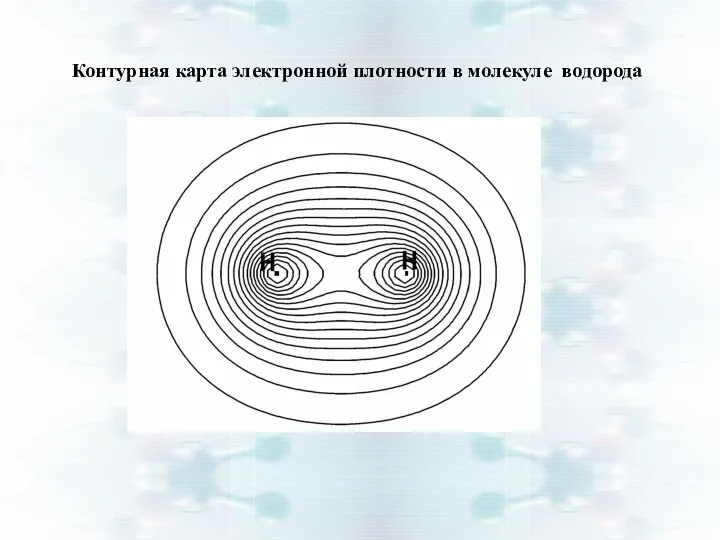
- 14. Контурная карта электронной плотности в молекуле водорода
- 15. Основные положения метода ВС а) перекрывание АО с образованием связывающих электронных пар (обобществление двух электронов); б)
- 16. Основные положения метода ВС а) перекрывание АО с образованием связывающих электронных пар (обобществление двух электронов); б)
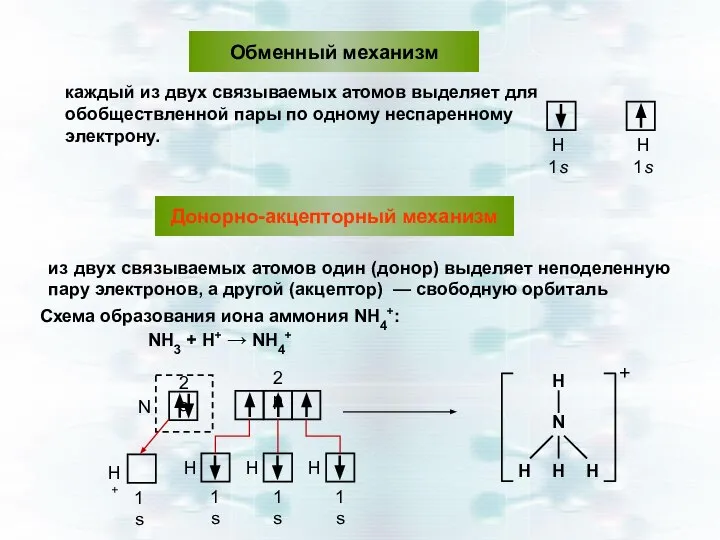
- 17. Обменный механизм каждый из двух связываемых атомов выделяет для обобществленной пары по одному неспаренному электрону. Донорно-акцепторный
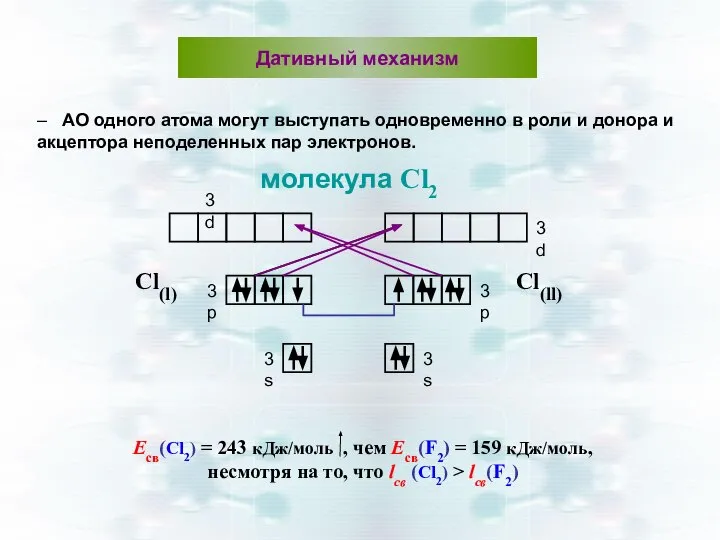
- 18. Есв(Сl2) = 243 кДж/моль , чем Есв(F2) = 159 кДж/моль, несмотря на то, что lсв (Сl2)
- 19. СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
- 20. Молекула NaI Механизм образования связи — обменный. Валентный угол — 180°. Структура молекулы — линейная .
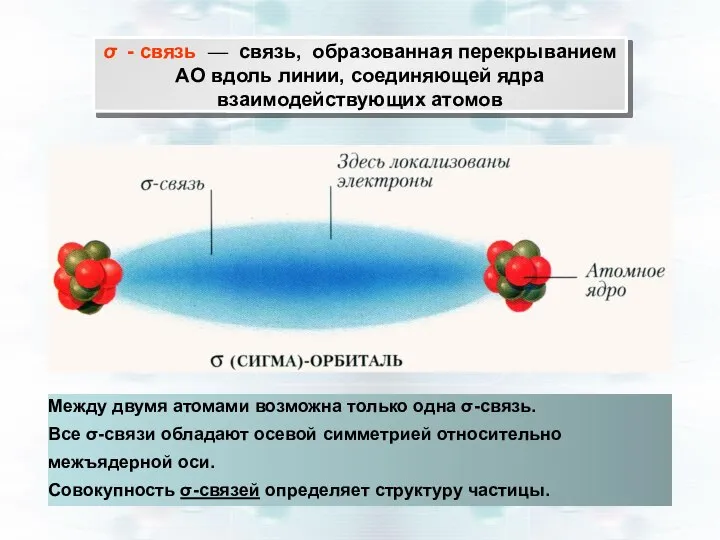
- 21. σ - связь — связь, образованная перекрыванием АО вдоль линии, соединяющей ядра взаимодействующих атомов Между двумя
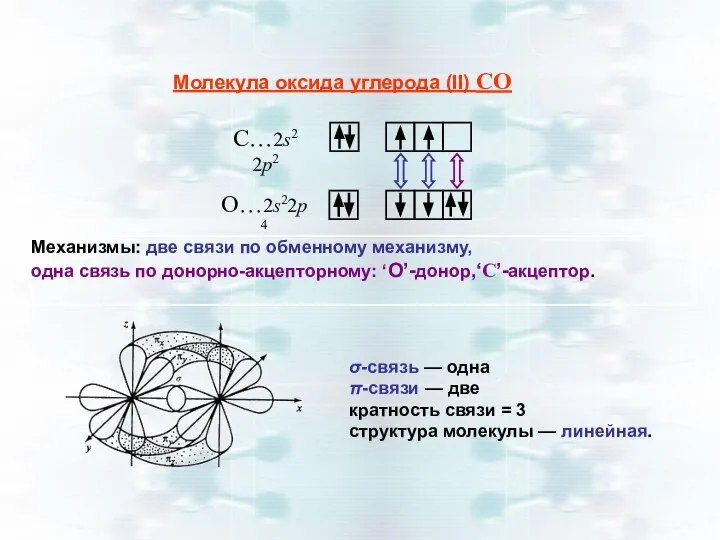
- 22. Молекула оксида углерода (II) СО Механизмы: две связи по обменному механизму, одна связь по донорно-акцепторному: ‘O’-донор,‘C’-акцептор.
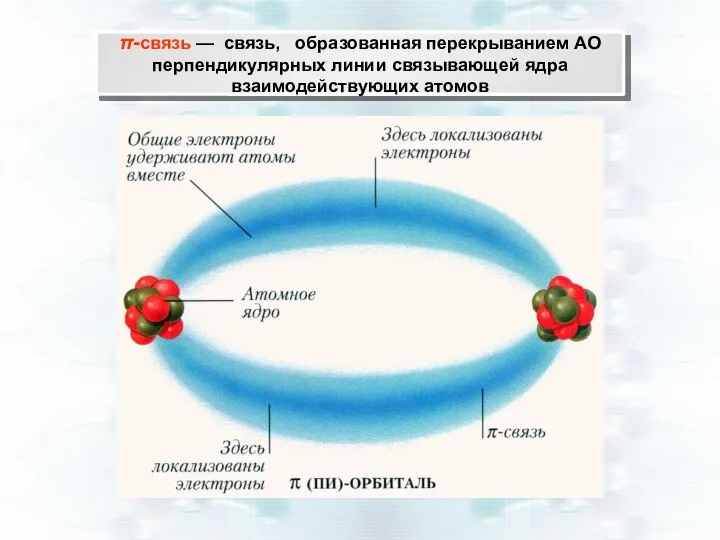
- 23. π-связь — связь, образованная перекрыванием АО перпендикулярных линии связывающей ядра взаимодействующих атомов
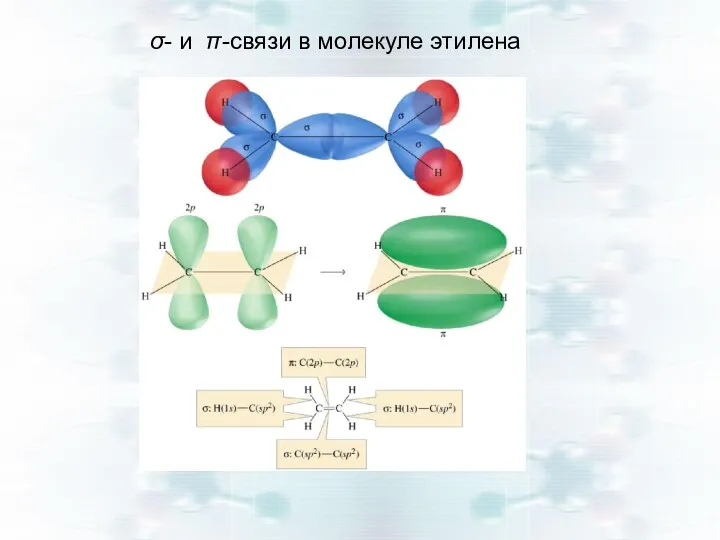
- 24. σ- и π-связи в молекуле этилена
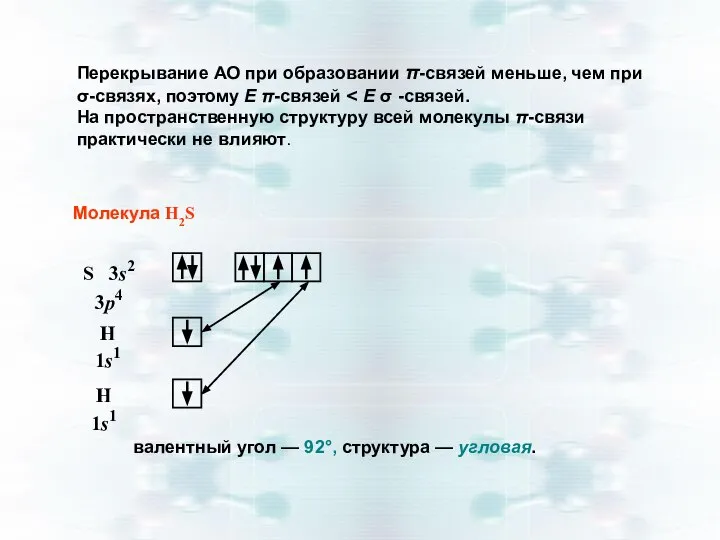
- 25. Перекрывание АО при образовании π-связей меньше, чем при σ-связях, поэтому Е π-связей На пространственную структуру всей
- 26. 3.Полярность ковалентной связи Полярная связь Неполярная связь Молекула НСl : ЭО(Cl) = 3,0; ЭО(Н) = 2,1
- 27. Количественная мера полярности связи — электрический момент диполя связи μсв — произведение эффективного заряда q на
- 28. вывод Чем больше ΔЭО, тем больше μсв ⇨ связь более полярная
- 29. Н2, О2
- 30. ПОЛЯРНОСТЬ МОЛЕКУЛЫ μм — электрический момент диполя молекулы равен векторной сумме электрических моментов диполей всех связей
- 31. Молекула Н2S угловая структура (∠92° ) ЭО(Н) = 2,1 и ЭО(S) = 2,5 ⇒ связь полярная
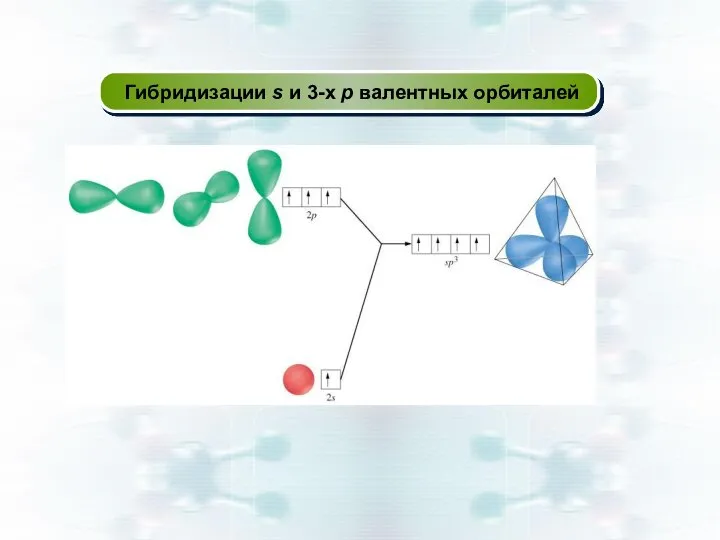
- 32. Теория гибридизации валентных орбиталей Если у атома в образовании σ - связей участвуют разные по типу
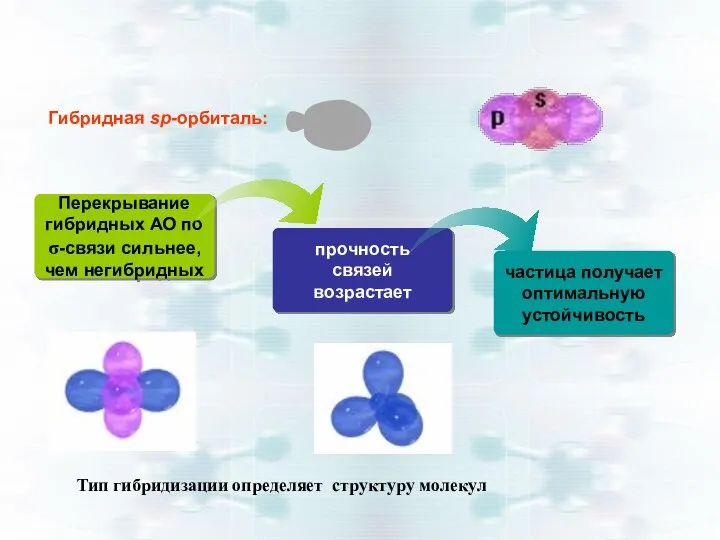
- 33. прочность связей возрастает частица получает оптимальную устойчивость Перекрывание гибридных АО по σ-связи сильнее, чем негибридных Гибридная
- 34. Гибридизации s и 3-х p валентных орбиталей
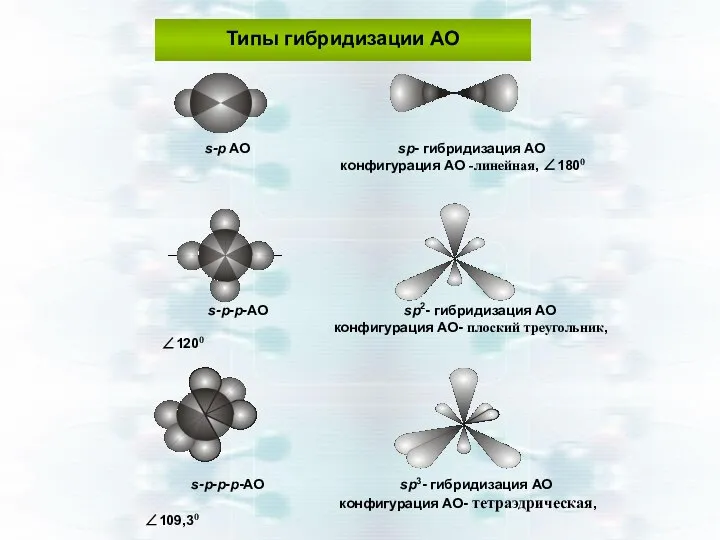
- 35. Типы гибридизации АО s-p AO sp- гибридизация АО конфигурация АО -линейная, ∠1800 s-p-p-АО sp2- гибридизация АО
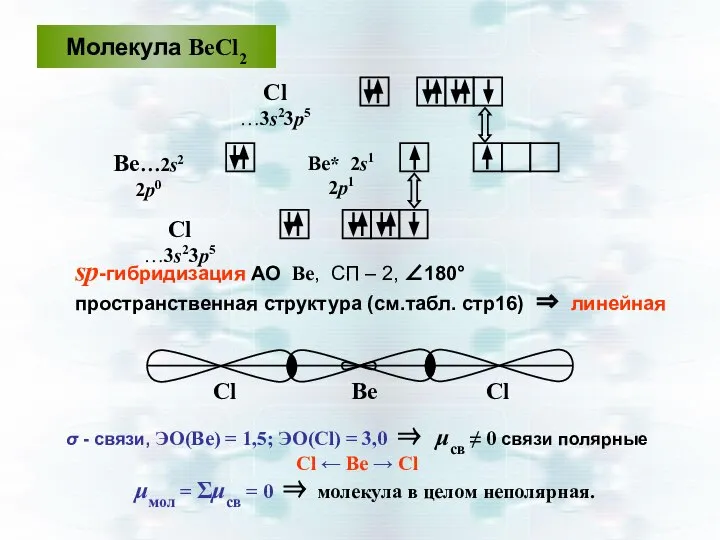
- 37. Молекула ВеСl2 Сl …3s23р5 Ве…2s2 2р0 sp-гибридизация АО Ве, СП – 2, ∠180° пространственная структура (см.табл.
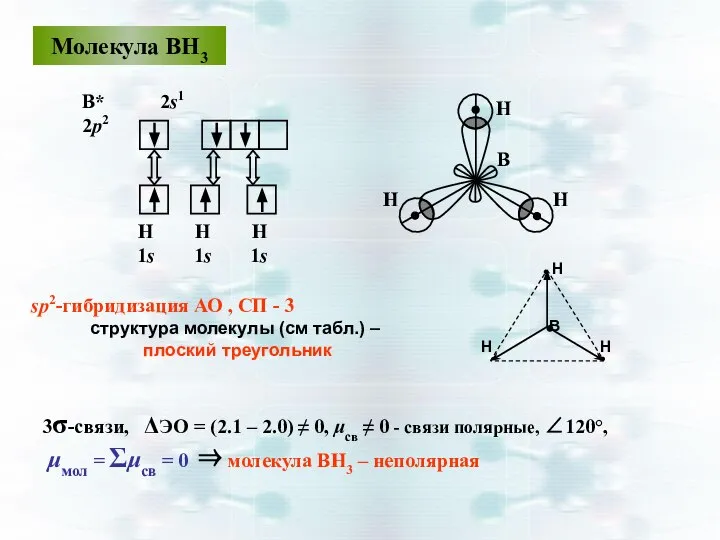
- 38. Молекула ВН3 sp2-гибридизация АО , СП - 3 структура молекулы (см табл.) – плоский треугольник H
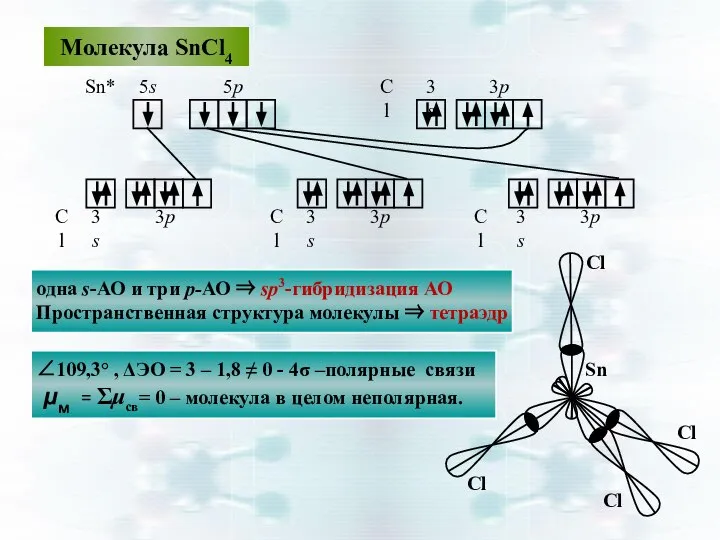
- 39. Молекула SnCl4 5р 5s Sn* Cl Cl Cl Cl 3s 3р 3р 3р 3р 3s 3s
- 40. Часто реальные углы связи отличаются от углов, соответствующих типу гибридизации. Хорошо объясняется теорией Р. Гиллеспи, учитывающая
- 41. 4. Влияние электроотрицательности лиганда (чем более электроотрицателен лиганд (атом – партнер центрального атома), тем сильнее смещение
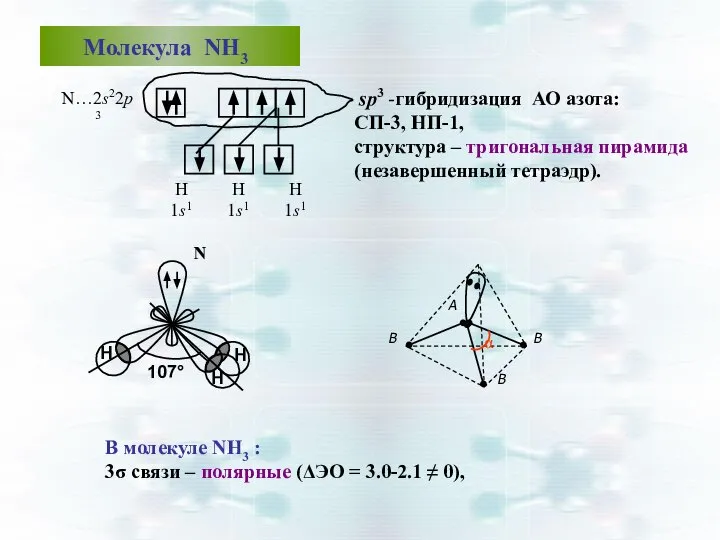
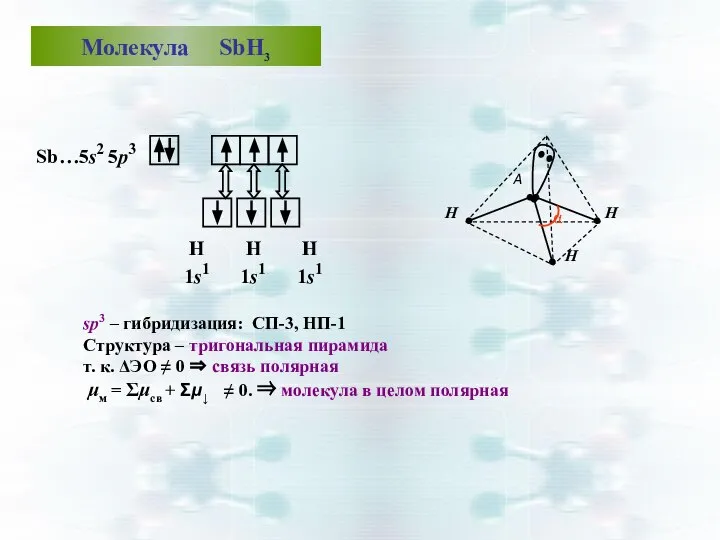
- 42. Молекула NН3 sp3 -гибридизация АО азота: СП-3, НП-1, структура – тригональная пирамида (незавершенный тетраэдр). В молекуле
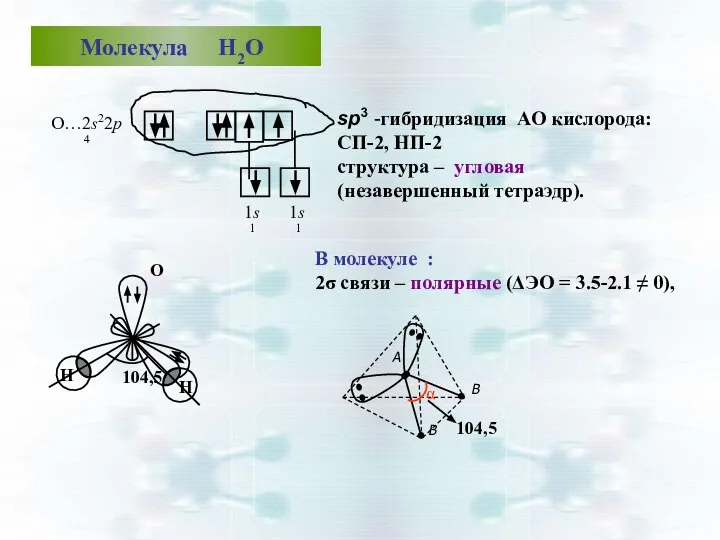
- 43. Молекула Н2О O…2s22р4 В молекуле : 2σ связи – полярные (ΔЭО = 3.5-2.1 ≠ 0), sp3
- 44. sp3 – гибридизация: СП-3, НП-1 Структура – тригональная пирамида т. к. ΔЭО ≠ 0 ⇒ связь
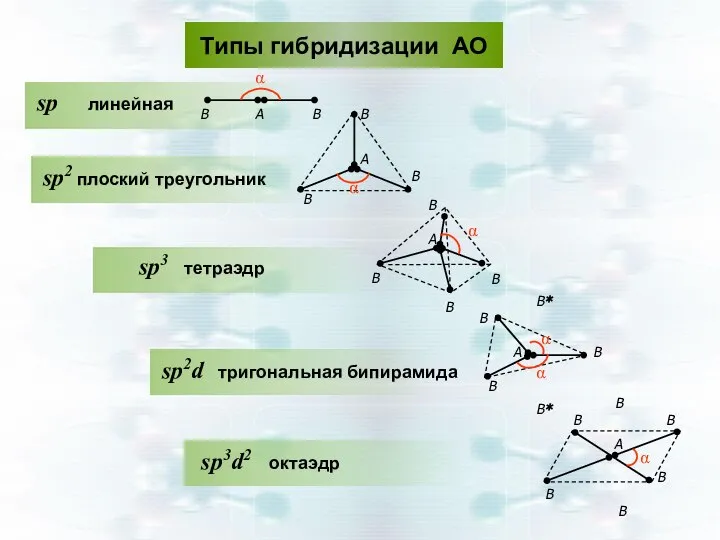
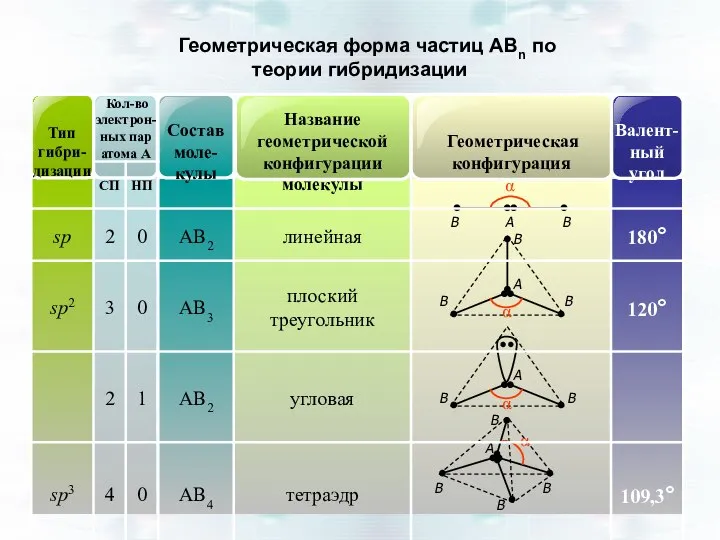
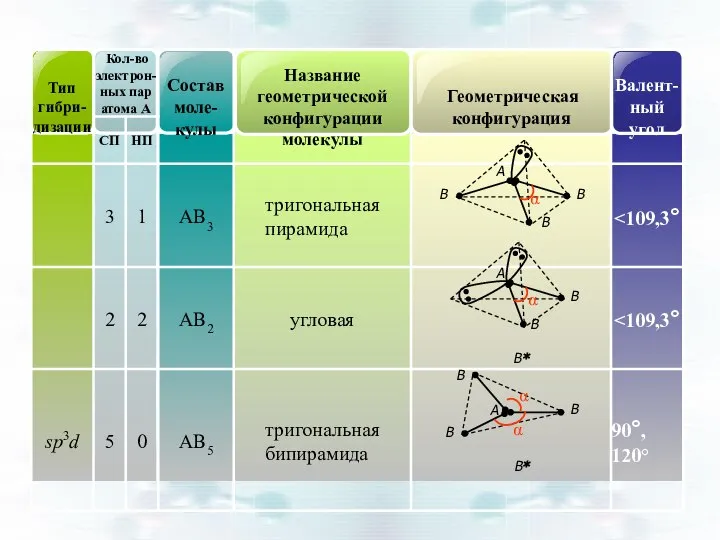
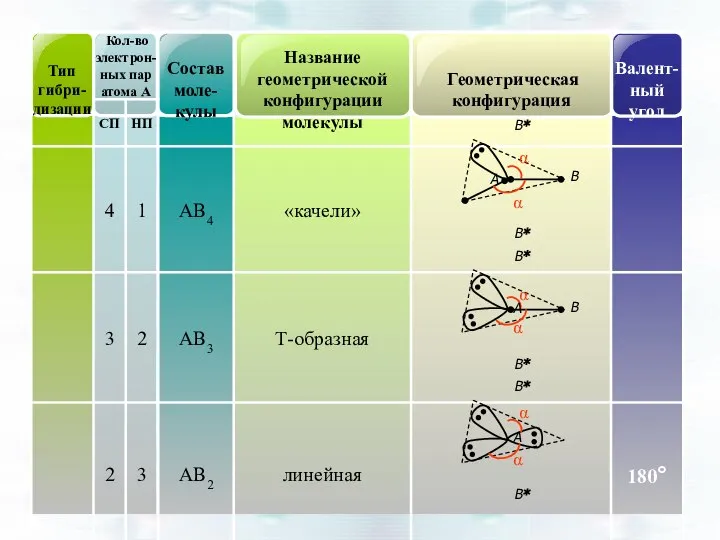
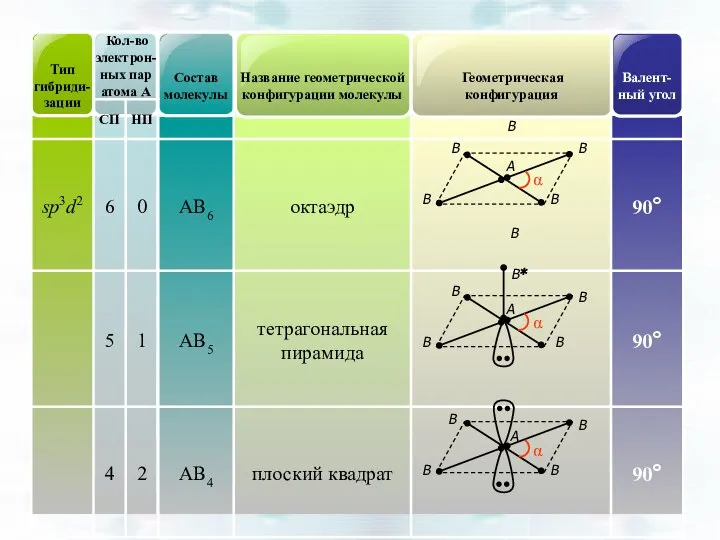
- 45. Геометрическая форма частиц АВn по теории гибридизации
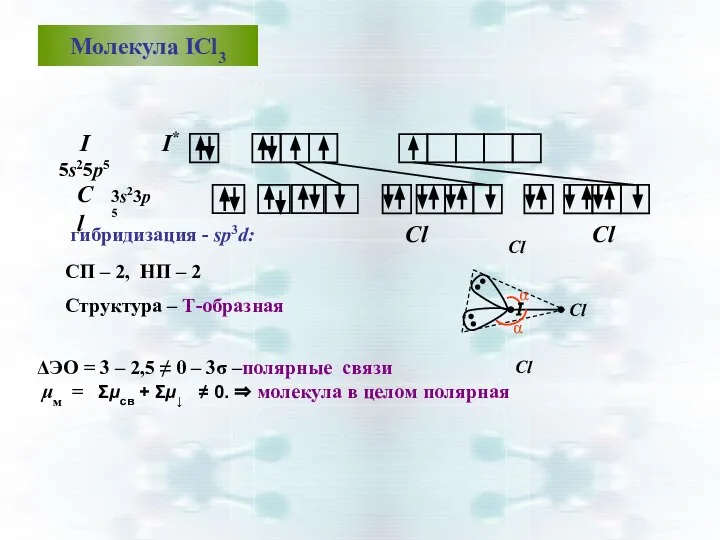
- 49. Молекула ICl3 I 5s25р5 гибридизация - sp3d: CП – 2, НП – 2 Структура – Т-образная
- 51. Скачать презентацию






















 Біохімія білків
Біохімія білків Disinfection without Chlorine and Chemistry
Disinfection without Chlorine and Chemistry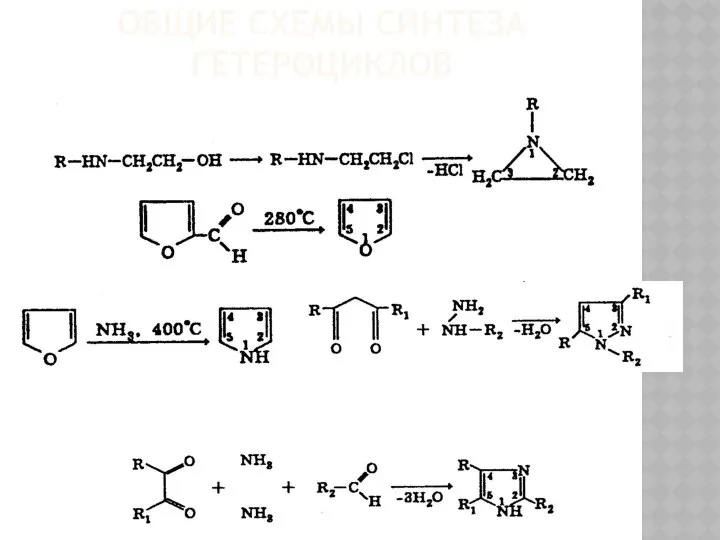 Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Развитие биохимии и биофизики
Развитие биохимии и биофизики Минералы и их свойства
Минералы и их свойства Реакции окисления-восстановления в химическом анализе. (Лекция 8.3)
Реакции окисления-восстановления в химическом анализе. (Лекция 8.3) Хлор
Хлор Химические свойства и получение алканов
Химические свойства и получение алканов Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Ароматические углеводороды. (Лекция 7)
Ароматические углеводороды. (Лекция 7) Гранулирование. Виды грануляции
Гранулирование. Виды грануляции Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод
Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню. Взаємод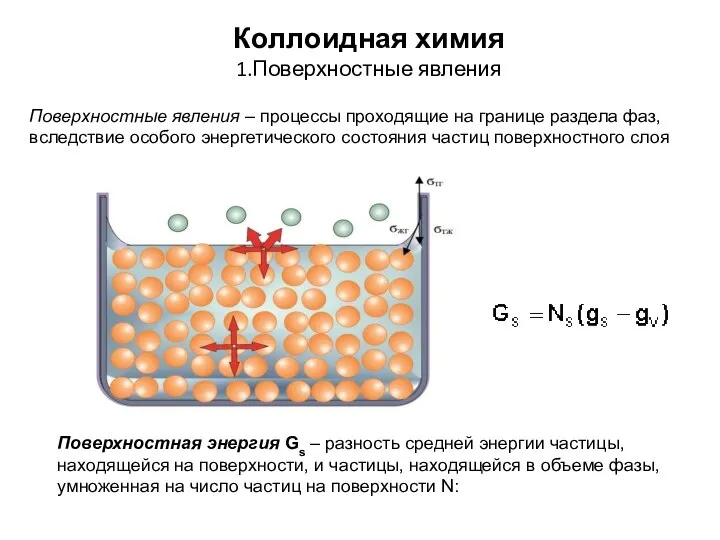 Коллоидная химия. Поверхностные явления
Коллоидная химия. Поверхностные явления Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер
Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Виды химической связи (8 класс)
Виды химической связи (8 класс) Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах
Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах Алкены.10 класс
Алкены.10 класс Галлий
Галлий Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация
Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация Презентация "Гидролиз солей"
Презентация "Гидролиз солей" Древняя античная химия
Древняя античная химия «Способы очищения питьевой воды, основанные на физических принципах»
«Способы очищения питьевой воды, основанные на физических принципах» Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Атом жайлы ақиқат
Атом жайлы ақиқат Химия в профессиях
Химия в профессиях Азотсодержащие органические соединения
Азотсодержащие органические соединения Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке