Содержание
- 2. Карбоновые кислоты – органические соединения, содержащие одну или несколько карбоксильных групп –СООН.
- 3. Благодаря работам известного шведского химика Карла Вильгельма Шееле к концу 18 века стало известно около десяти
- 4. Классификация карбоновых кислот По числу карбоксильных групп непредельные ароматические одноосновные двухосновные многоосновные предельные По типу углеводородного
- 5. Предельные одноосновные карбоновые кислоты – можно рассматривать как производные алканов, в молекулах которых один атом водорода
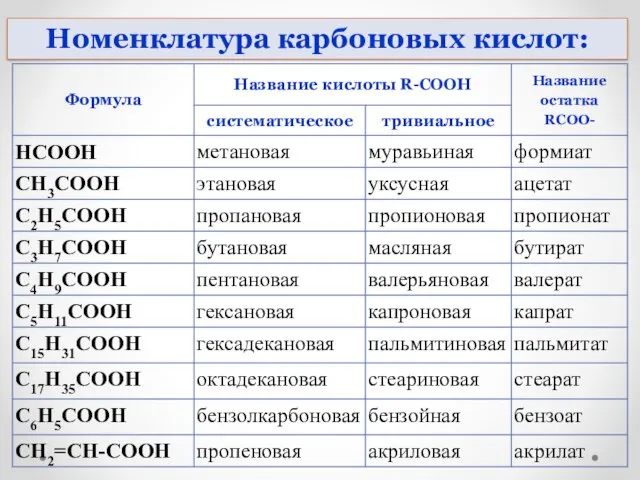
- 6. Номенклатура карбоновых кислот:
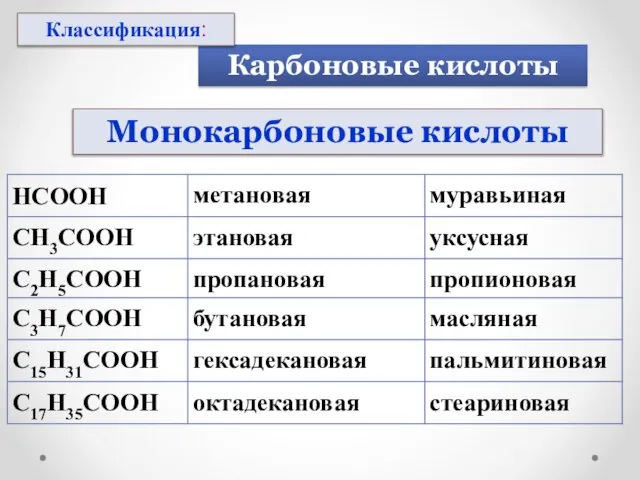
- 7. Монокарбоновые кислоты Карбоновые кислоты Классификация:
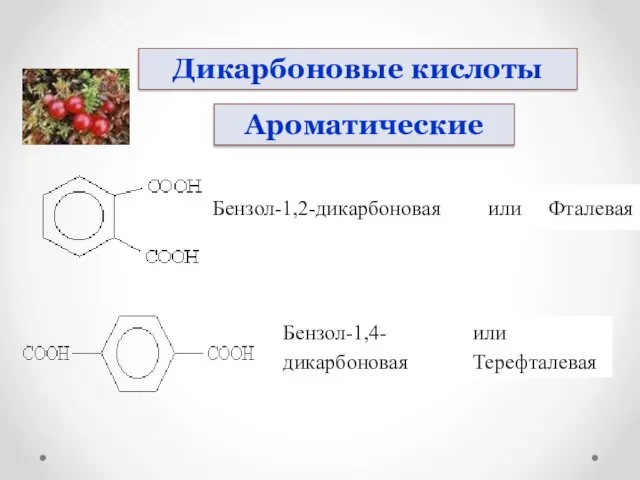
- 8. Этандиовая или Щавелевая кислота Пропандиовая кислота или Малоновая. Бутандиовая кислота или Янтарная. Дикарбоновые кислоты Карбоновые кислоты
- 9. Дикарбоновые кислоты Ароматические
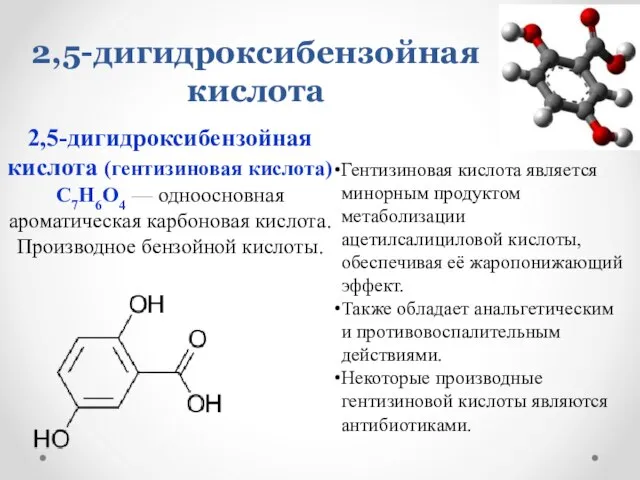
- 10. 2,5-дигидроксибензойная кислота 2,5-дигидроксибензойная кислота (гентизиновая кислота) C7H6O4 — одноосновная ароматическая карбоновая кислота. Производное бензойной кислоты. Гентизиновая
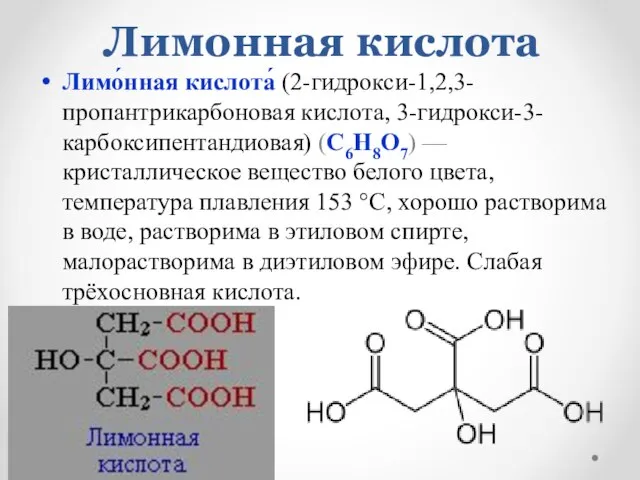
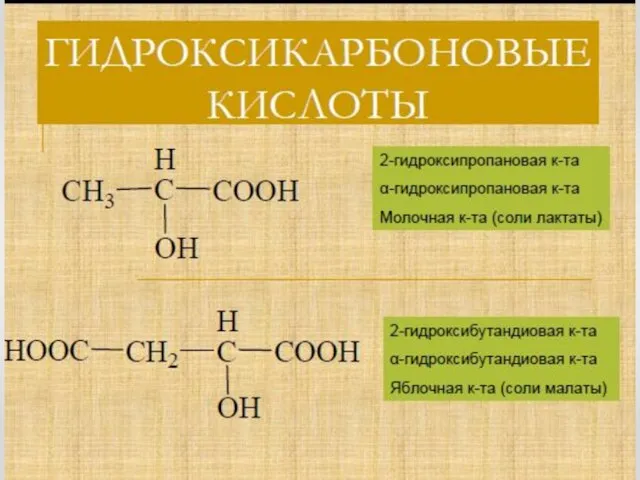
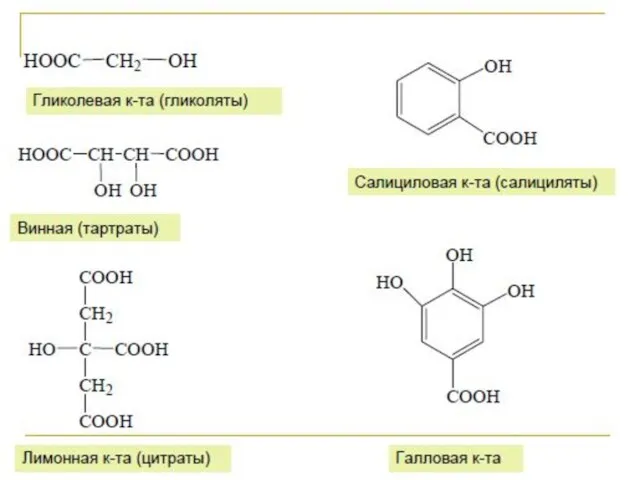
- 11. Лимонная кислота Лимо́нная кислота́ (2-гидрокси-1,2,3-пропантрикарбоновая кислота, 3-гидрокси-3-карбоксипентандиовая) (C6H8O7) — кристаллическое вещество белого цвета, температура плавления 153
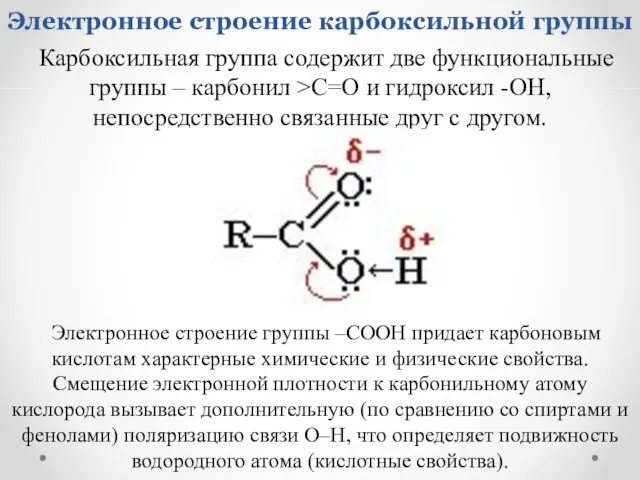
- 12. Электронное строение карбоксильной группы Карбоксильная группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH,
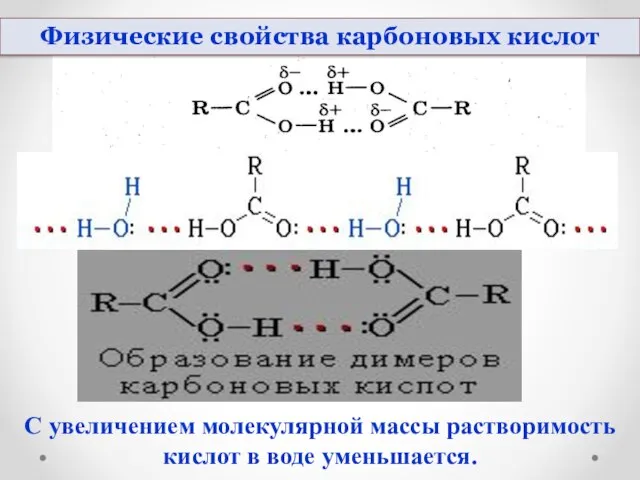
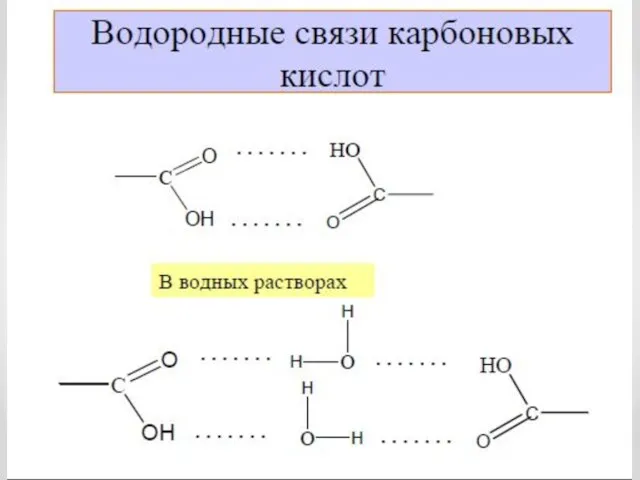
- 13. Физические свойства карбоновых кислот С увеличением молекулярной массы растворимость кислот в воде уменьшается.
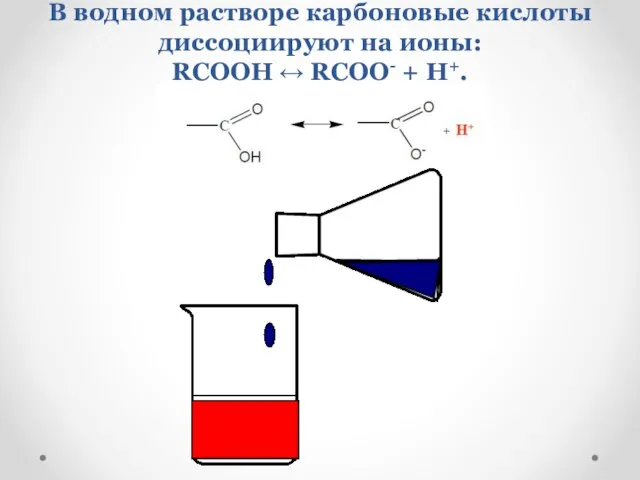
- 15. В водном растворе карбоновые кислоты диссоциируют на ионы: RCOOH ↔ RCOO- + H+.
- 16. Химические свойства карбоновых кислот 1. Образование солей: а) при взаимодействии с металлами: 2RCOOH + Mg →
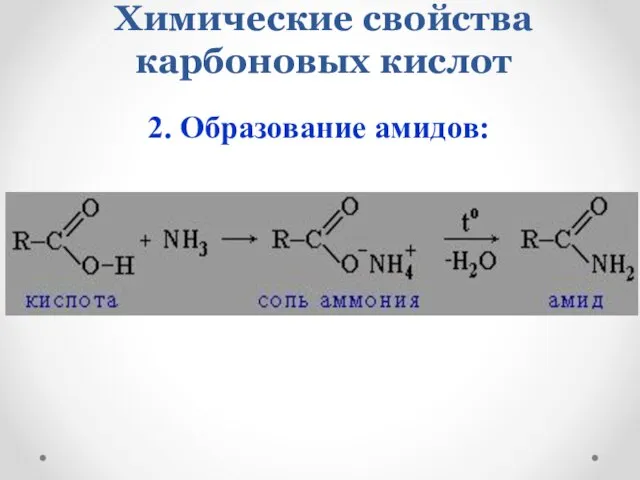
- 17. Химические свойства карбоновых кислот 2. Образование амидов:
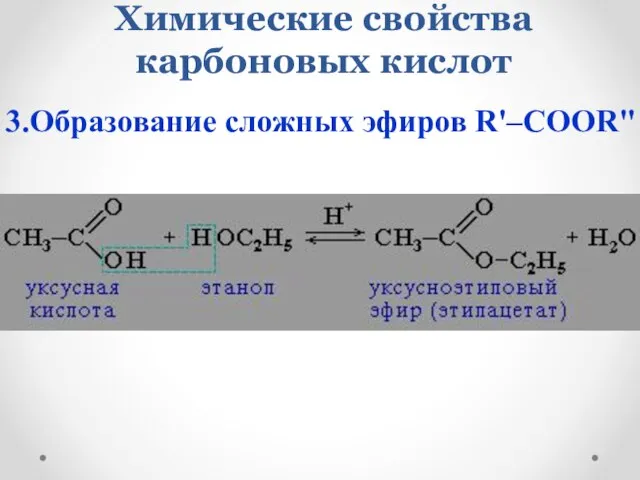
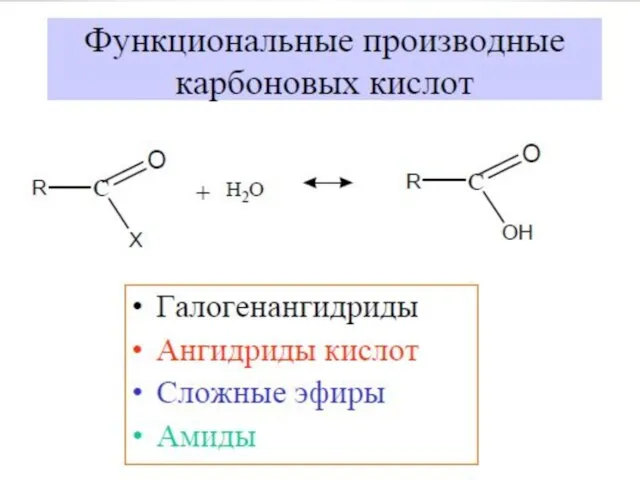
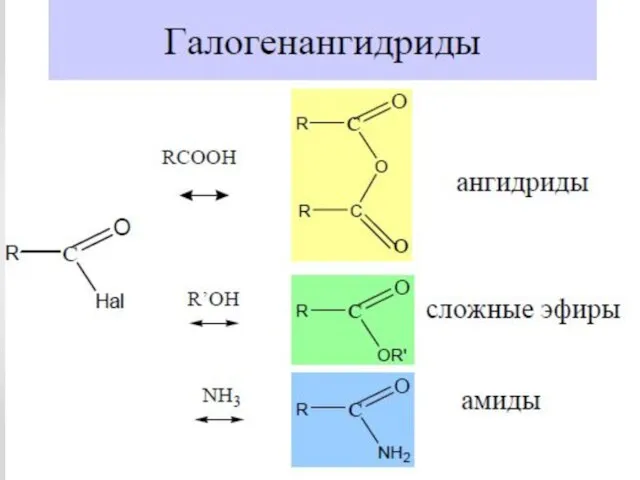
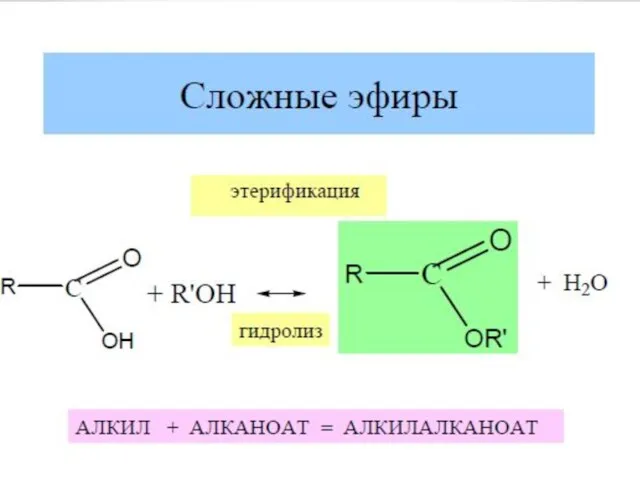
- 18. Химические свойства карбоновых кислот 3.Образование сложных эфиров R'–COOR"
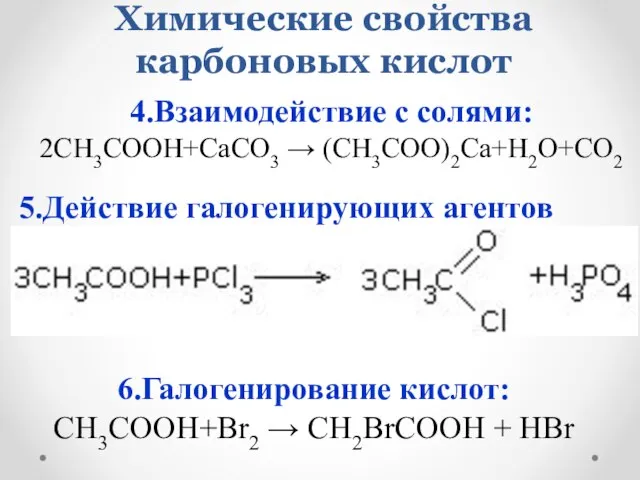
- 19. Химические свойства карбоновых кислот 4.Взаимодействие с солями: 2CH3COOH+CaCO3 → (CH3COO)2Ca+H2O+CO2 5.Действие галогенирующих агентов 6.Галогенирование кислот: CH3COOH+Br2
- 20. Химические свойства карбоновых кислот 7.Непредельные карбоновые кислоты способны к реакциям присоединения: СН2=СН-СООН + Н2 → СН3-СН2-СООН,
- 21. Химические свойства карбоновых кислот 8.Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды,
- 22. Химические свойства карбоновых кислот 9. Реакции декарбоксширования: CH3-CH2-COONa + NaOH → С2Н6↑ + Na2CO3 ССl3СООН →
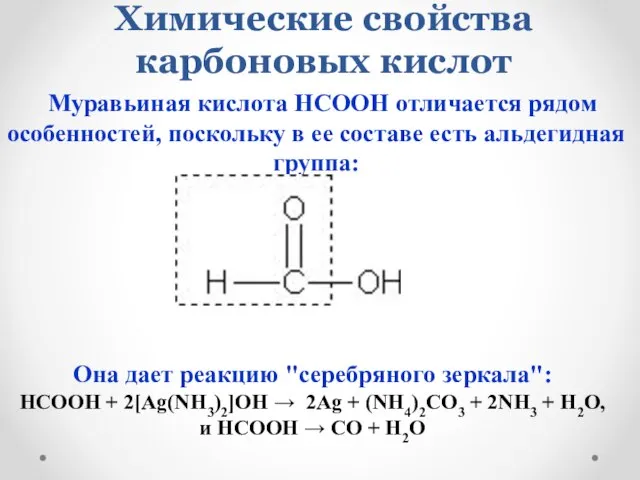
- 23. Химические свойства карбоновых кислот Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная
- 24. Высшие карбоновые кислоты Насыщенные: C15H31COOH – пальмитиновая; C17H35COOH – стеариновая. Ненасыщенные: С17Н33СООН – олеиновая, C17H31COOH –
- 32. Скачать презентацию










 Характеристика и свойства истинных растворов
Характеристика и свойства истинных растворов Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест
Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті” Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 класса Кирако
Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 класса Кирако Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii
Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii Правила безопасни 7-й класс
Правила безопасни 7-й класс Химическая связь
Химическая связь Д. И. Менделеев Автор: Ким Н. В. учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год.
Д. И. Менделеев Автор: Ким Н. В. учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год. Биохимия крови
Биохимия крови Циклоалканы
Циклоалканы Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2)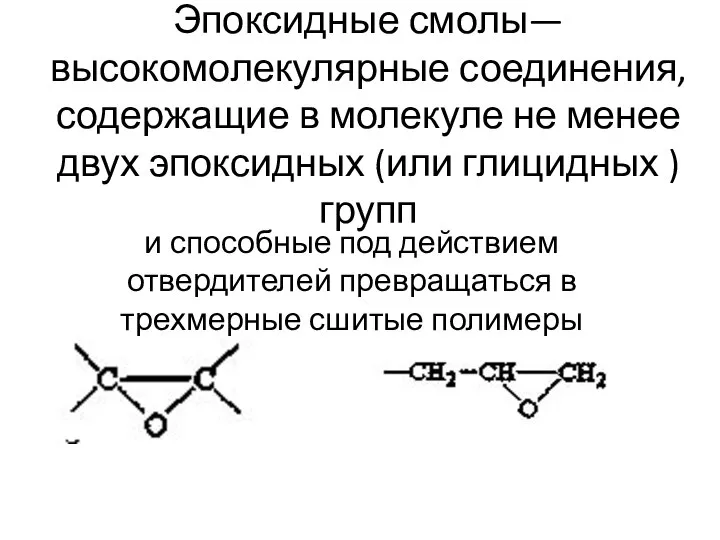 Эпоксидные смолы
Эпоксидные смолы Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Алкадиены: строение,номенклатура,гомологи,изомерия Урок химии в 9 классе Учитель: Дворничена Л.В.
Алкадиены: строение,номенклатура,гомологи,изомерия Урок химии в 9 классе Учитель: Дворничена Л.В.  Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия
Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия  Роль воды в организме человека
Роль воды в организме человека Вода, которую мы пьем
Вода, которую мы пьем Химия в быту
Химия в быту Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основные типы промышленных масел
Основные типы промышленных масел Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола
Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола Polymers
Polymers Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Крахмал. Строение вещества
Крахмал. Строение вещества ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ