Содержание
- 2. 5. Химическая кинетика учение о механизме (стадиях и их последовательности, молекулярности) химических реакций (процессов) исследование закономерностей
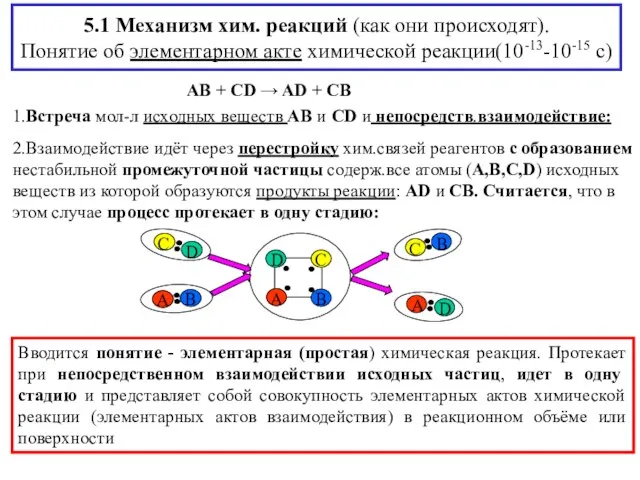
- 3. 5.1 Механизм хим. реакций (как они происходят). Понятие об элементарном акте химической реакции(10-13-10-15 с) AB +
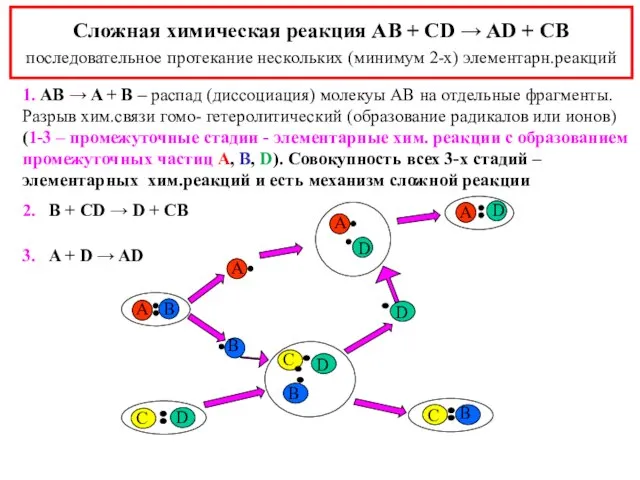
- 4. Сложная химическая реакция AB + CD → AD + CB последовательное протекание нескольких (минимум 2-х) элементарн.реакций
- 5. Частицы (в том числе промежуточные), участвующие в элементарной химической реакции: Молекулы 2 NO + O2 →
- 6. 5.2 Элементарная(одностадийная) химическая реакция: νAA + νBB → νDD -непосредственное взаимодействие исходных веществ. Совокупность элементарн. актов
- 7. Скорость элементарной(простой) реакции v - число элементарных актов (r) в единицу времени t в единице реакционного
- 8. 5.3 Зависимость скорости реакции V от концентрации в-в. Закон действующих масс (Гульберг, Вааге 1879 г) -
- 9. 5.4 Зависимость скорости реакции от температуры Из теории активных соударений: (для элемент.акта реакции)
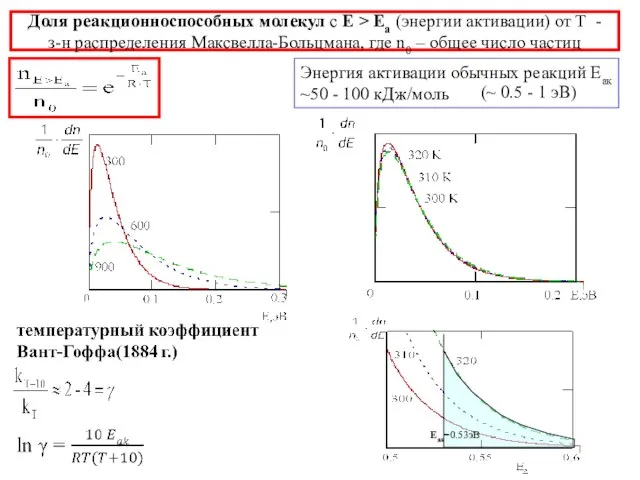
- 10. Доля реакционноспособных молекул с Е > Еа (энергии активации) от Т - з-н распределения Максвелла-Больцмана, где
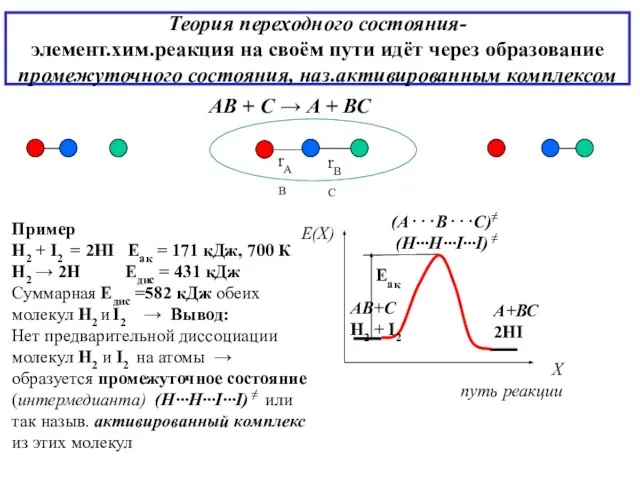
- 11. Теория переходного состояния- элемент.хим.реакция на своём пути идёт через образование промежуточного состояния, наз.активированным комплексом
- 12. 5.5 Формальная кинетика (гомогенные реакции) Сложные химические реакции νAA + νBB → νDD Общая скорость сложных
- 13. 5.6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка
- 14. Кинетическое уравнение необратимой реакции второго порядка
- 15. 5.7 Цепной механизм химической реакции Цепные реакции (особый класс сложных многостадийных реакций) - ряд регулярно повторяющихся
- 16. Примеры 1. Неразветвленный цепной процесс (n=1) H2 + Br2 → 2 HBr 2. Разветвленный цепной процесс
- 17. 5.8 Индуцированные реакции(передача энергии извне)
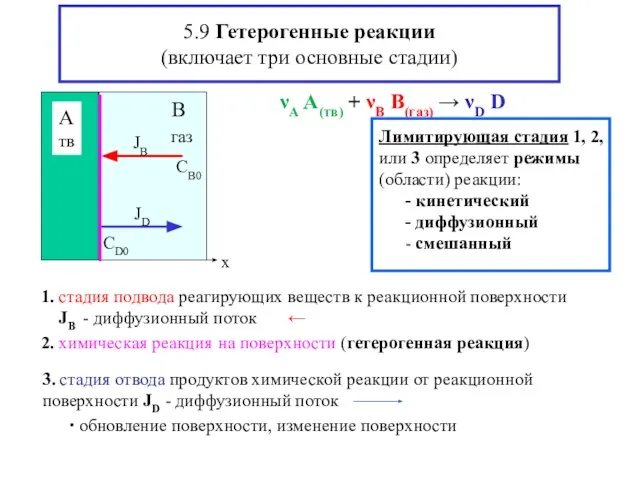
- 18. 5.9 Гетерогенные реакции (включает три основные стадии) νА A(тв) + νВ B(газ) → νD D 2.
- 19. Диффузионный режим – Законы диффузии [выравнивание концентраций за счет тепл.движ.(J –диффузионн.поток в-ва)] νА A(тв) + νВ
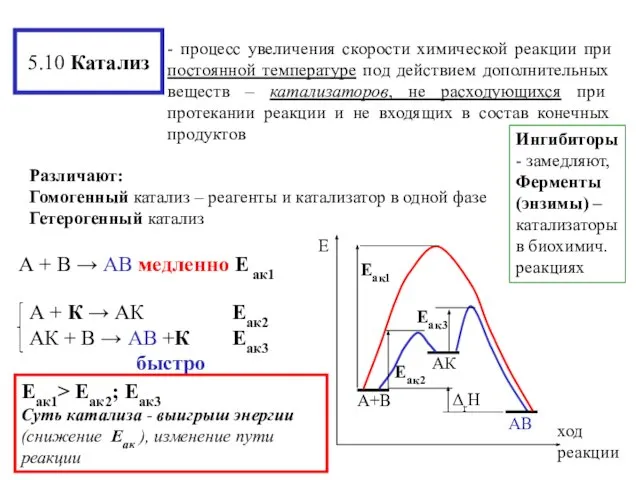
- 20. 5.10 Катализ Ингибиторы - замедляют, Ферменты (энзимы) – катализаторы в биохимич. реакциях Различают: Гомогенный катализ –
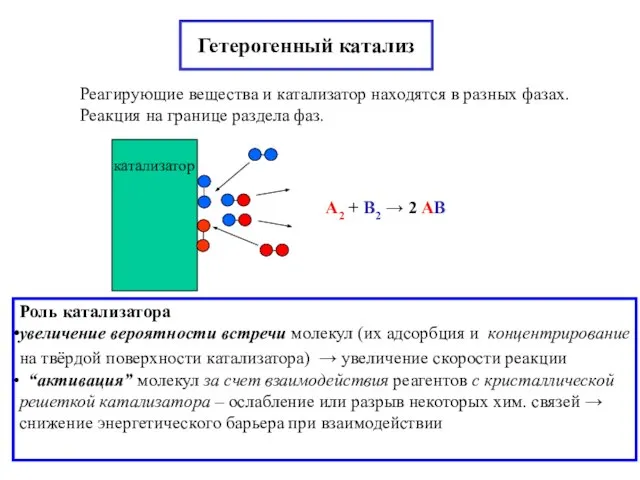
- 21. Гетерогенный катализ Реагирующие вещества и катализатор находятся в разных фазах. Реакция на границе раздела фаз. А2
- 22. 5.11 Горение и взрыв (режимы взрывчатых превращений)
- 24. Скачать презентацию














 Химия и сельское хозяйство
Химия и сельское хозяйство  Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Свойства простых веществ 8 класс
Свойства простых веществ 8 класс  Природа и классификация химических связей
Природа и классификация химических связей Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс
Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс  Спирты. Номенклатура спиртов
Спирты. Номенклатура спиртов Биохимическая классификация гормонов
Биохимическая классификация гормонов Таблица Менделеева
Таблица Менделеева Элементы V А группы. Азот и его соединения
Элементы V А группы. Азот и его соединения Деструкция углеводородов
Деструкция углеводородов Гибридизация атома углерода
Гибридизация атома углерода Алкины. Строение алкинов
Алкины. Строение алкинов Вода. Растворимость, растворы
Вода. Растворимость, растворы ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ. Глицерин. Свойства и применение
Глицерин. Свойства и применение Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Влияние кислотной и щелочной среды на развитие растений
Влияние кислотной и щелочной среды на развитие растений Этанол (эти́ловый спирт)
Этанол (эти́ловый спирт)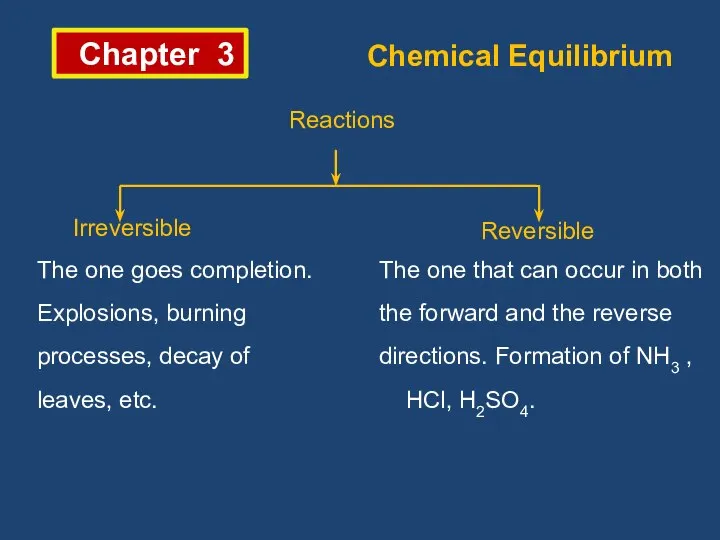 Chemical equilibrium. (Chapter 3)
Chemical equilibrium. (Chapter 3) Группа рассеянных химических элементов
Группа рассеянных химических элементов Медь. Содержание в природе
Медь. Содержание в природе Генетическая связь между основными классами органических соединений
Генетическая связь между основными классами органических соединений Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Углеводы: простые и сложные. Строение, свойства и биологическая роль
Углеводы: простые и сложные. Строение, свойства и биологическая роль Водороды
Водороды Первые русские женщины-химики
Первые русские женщины-химики Хімічнi елементи
Хімічнi елементи Нітрати та нітриди та їх вплив на навколишнє середовище
Нітрати та нітриди та їх вплив на навколишнє середовище