Содержание
- 2. Скорость гомогенной реакции – количество вещества, реагирующего в единице объема за единицу времени, т.е. изменение концентрации
- 3. Скорость гомогенной реакции можно выразить как через скорость образования одного из продуктов реакции, так и через
- 4. В соответствии с уравнением реакции, на каждый израсходованный в реакции моль А расходуется молей вещества В
- 5. Поэтому скорость горения топлива можно выразить через скорость расходования горючих элементов или их смеси в целом,
- 6. Реакции в зависимости от числа вступающих в них молекул подразделяются на: мономолекулярные реакции, в которых реагирует
- 7. Для протекания мономолекулярной реакции достаточно, чтобы один род молекул был способен вступать в реакцию (пришел в
- 8. показатели степеней n1, n2, … принято называть порядком реакции по реагентам А, В, … Сумма n1
- 9. При заданной концентрации реагирующих веществ скорость реакции характеризуется константой скорости реакции, зависящей от температуры. Лекция 6
- 10. E – энергия активации (кДж/моль), k0 – предэкспоненциальный множитель, Размерность k0 зависит от порядка реакции E,
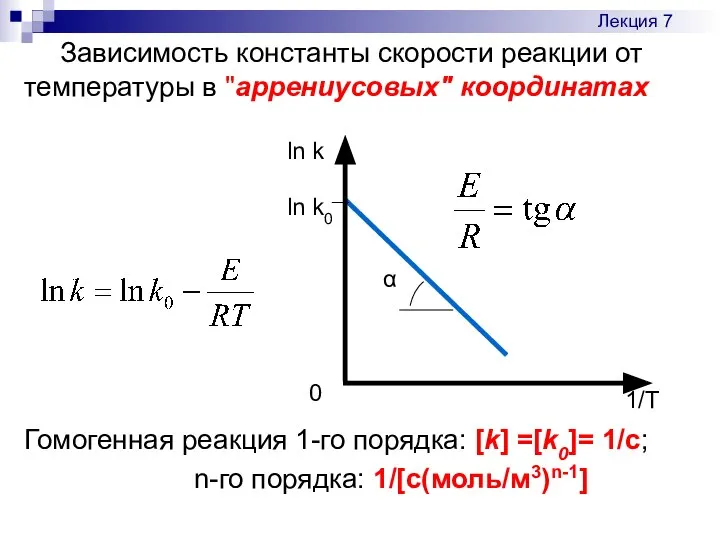
- 11. Зависимость константы скорости реакции от температуры в "аррениусовых" координатах Гомогенная реакция 1-го порядка: [k] =[k0]= 1/с;
- 12. Физический смысл энергии активации Для начала реакции необходимо столкновение реагирующих молекул. Однако не все столкновения между
- 13. Эффективными оказываются лишь столкновения между активными молекулами, которые в момент столкновения обладают некоторым избытком энергии по
- 14. Активация – процесс, при котором изменяется энергия молекул без химического превращения. Теплота активации – теплота, поглощаемая
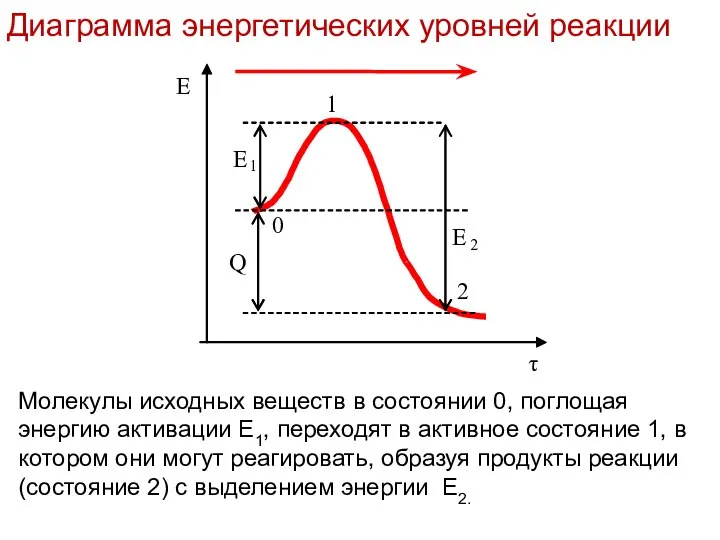
- 15. Лекция 6 Молекулы исходных веществ в состоянии 0, поглощая энергию активации Е1, переходят в активное состояние
- 16. Лекция 7 В экзотермических реакциях энергия Е2, выделяемая на участке 1-2, больше, чем Е1, поглощаемая при
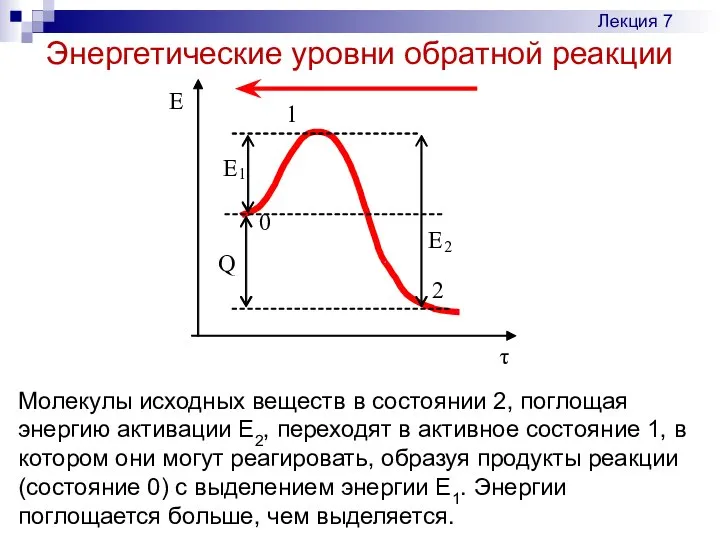
- 17. Энергетические уровни обратной реакции Лекция 7 Молекулы исходных веществ в состоянии 2, поглощая энергию активации Е2,
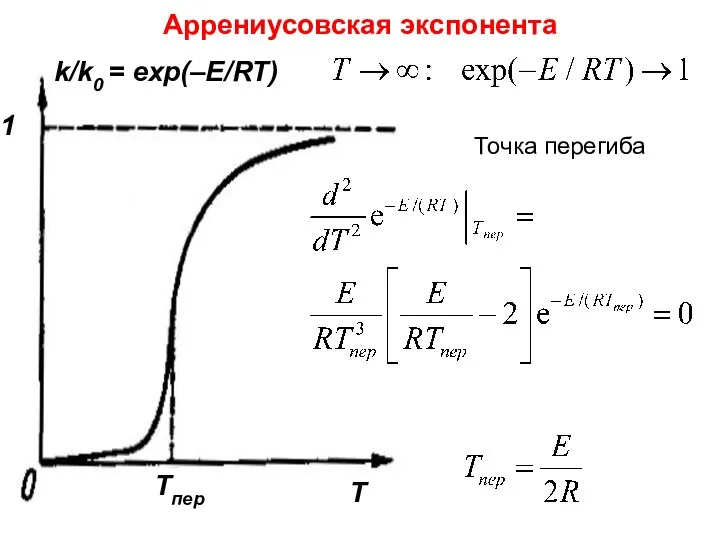
- 18. Лекция 6 Точка перегиба Аррениусовская экспонента
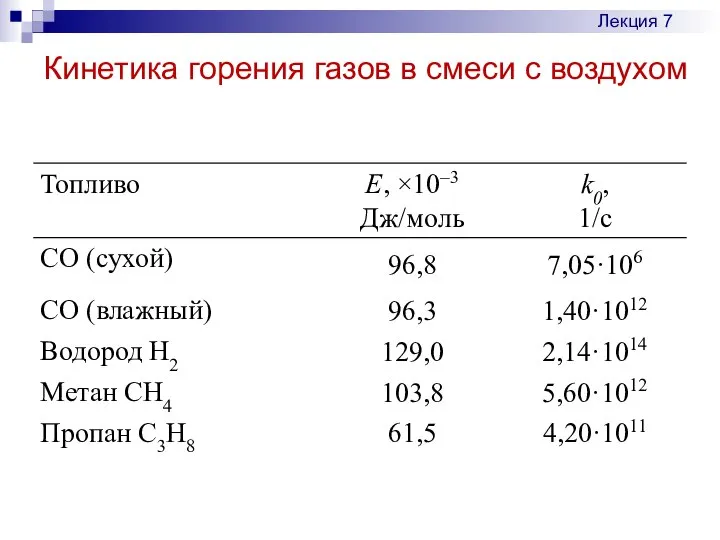
- 19. Кинетика горения газов в смеси с воздухом Лекция 7
- 21. Скачать презентацию













 Положение металлов в ПС, особенности строения их атомов, физические свойства
Положение металлов в ПС, особенности строения их атомов, физические свойства Что такое полупроводники
Что такое полупроводники Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар
Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар Презентация по Химии "Липиды" - скачать смотреть
Презентация по Химии "Липиды" - скачать смотреть  Изучение физико-химических показателей качества сушек
Изучение физико-химических показателей качества сушек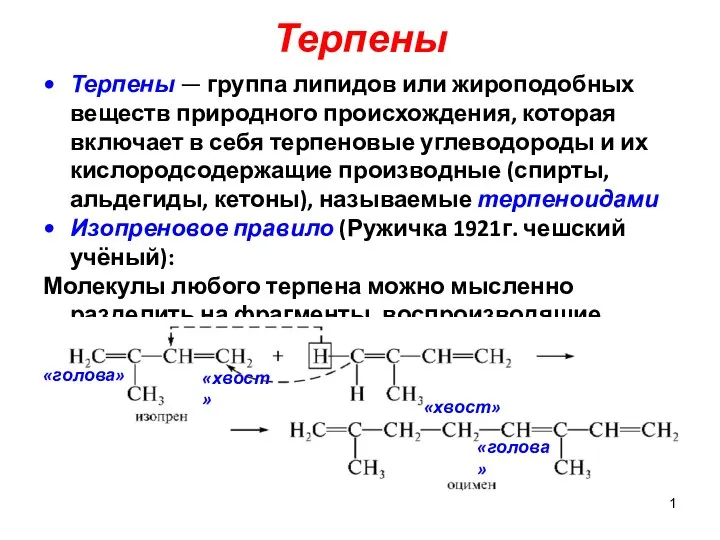 Терпены
Терпены Хімія числа Е в продуктах харчування
Хімія числа Е в продуктах харчування  Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Соли угольной кислоты
Соли угольной кислоты Ионные равновесия в растворах электролитов
Ионные равновесия в растворах электролитов Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление
Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов
Шестичленные гетероциклические соединения с одним и двумя гетероатомами. Конденсированные системы гетероциклов Фуллерены в супрамолекулярной химии (Лекция 7)
Фуллерены в супрамолекулярной химии (Лекция 7) Золото Aurum
Золото Aurum Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Амины
Амины Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Химия атмосферы
Химия атмосферы Абсорбция, адсорбция, конденсация
Абсорбция, адсорбция, конденсация Гидролиз неорганических веществ - солей
Гидролиз неорганических веществ - солей Аттестационная работа. Проектно-исследовательская деятельность студентов на уроках химии и во внеурочное время
Аттестационная работа. Проектно-исследовательская деятельность студентов на уроках химии и во внеурочное время Electrolysis
Electrolysis ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1.История открытия Периодической системы химических элемен
ТЕМА: ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. Менделеева ПЛАН 1.История открытия Периодической системы химических элемен Маркировки
Маркировки Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление
Спирты. Классификация, изомерия, физические и химические свойства спиртов. Типы реакций. Окисление Общая характеристика углерода
Общая характеристика углерода