Содержание
- 2. Кинетика – это раздел химии, изучающий скорость, механизмы, факторы, от которых они зависят. Некоторые реакции протекают
- 3. Скорость химической реакции – это изменение концентрации исходных веществ в единицу времени. .
- 4. Скорость реакции для гомогенных систем: для гетерогенных систем:
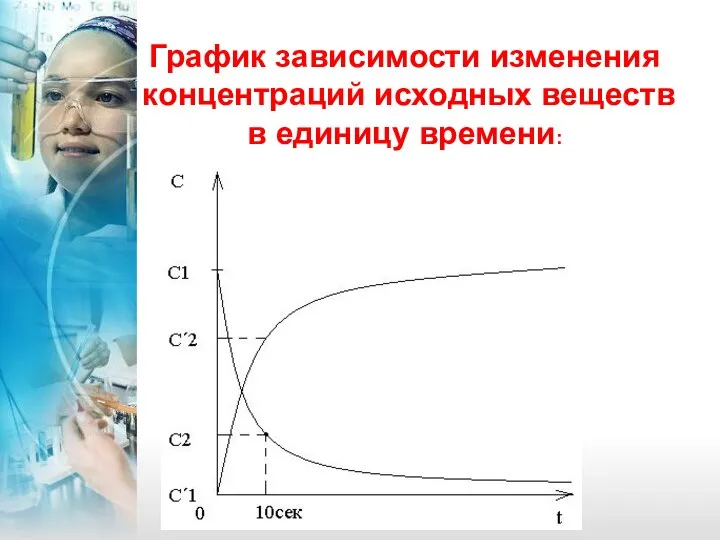
- 5. График зависимости изменения концентраций исходных веществ в единицу времени:
- 6. Мгновенная скорость – это изменение концентрации за бесконечно малый промежуток времени
- 7. Скорость реакции зависит от: - концентрации реагентов - агрегатного состояния (газ, жидкость, тверд.) - природы растворителя
- 8. Зависимость скорости реакции от концентрации впервые была сформулирована в 1867 году Гульдбергом и Вааге и названа
- 9. Например для процесса: aA + bB ↔ cC + dD Скорость прямой реакции: V = k1∙[A]a
- 10. Большинство процессов происходит через несколько элементарных стадий, в которых принимают участие 1, 2, 3 молекулы. Число
- 11. Скорость многостадийной реакции определяется скоростью самой медленной стадии. В зависимости от механизма реакции бывают простые (протекающие
- 12. Сложные реакции могут быть: - последовательные (идут через несколько разных промежуточных стадий, следующих одна за другой)
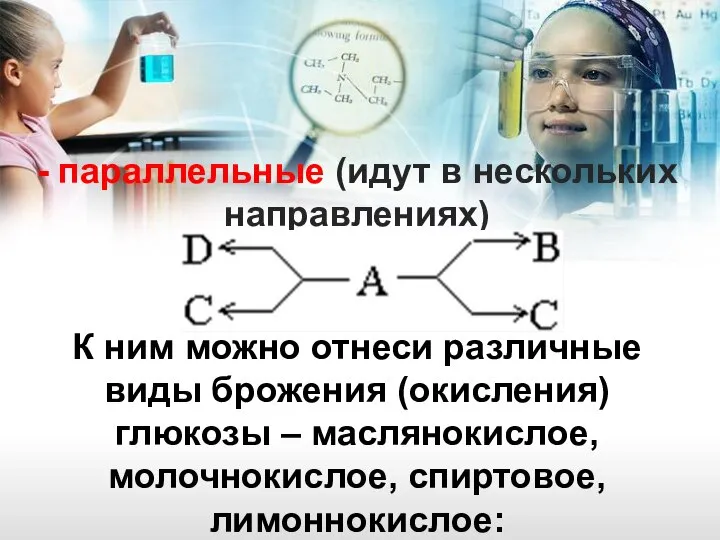
- 13. - параллельные (идут в нескольких направлениях) К ним можно отнеси различные виды брожения (окисления) глюкозы –
- 15. - сопряженные (это такие две реакции, одна из которых вызывает в системе протекание другой реакции, не
- 16. - конкурирующие – это сложные реакции, в которых одно и тоже вещество (А) взаимодействует с несколькими
- 17. Например: при бромировании фенола одновременно протекают две реакции – образование орто- и пара-изомеров:
- 18. Кинетические уравнения могут быть I и II порядка, которые характеризуются константой первого порядка. Она рассчитывается: Ʈ
- 19. К уравнениям второго порядка относятся реакции соединения и обмена: А + В → С А +
- 20. В биохимических процессах нет реакций, имеющих порядок более второго. Количественной характеристикой протекания реакции во времени является
- 21. Период полупревращения Для реакций I порядка: Ʈ½ = 0,693/ k1 Для реакций II порядка: Ʈ ½
- 22. Кинетические закономерности распределения лекарственных препаратов во внутренней среде изучаются фарамакокинетикой. Основная задача этой науки – с
- 23. Экспериментальные методы определения скорости реакций: химические, физические и биохимические методы. Химические: гравиметрия, титриметрия. Физические: спектральные методы,
- 24. Зависимость скорости реакции от температуры – Закон Вант – Гоффа: при повышении температуры на каждые 10°С
- 26. Уравнение Аррениуса:
- 27. Где: k – постоянная скорости реакции; А - предэкспоненциальный множитель, который отражает долю эффективных соударений молекул
- 28. Энергия активации - избыточная энергия, необходимая для вступления реагирующих веществ в реакцию при их столкновении по
- 30. Скорость реакции для газообразных веществ зависит от давления: с повышением давления увеличивается концентрация веществ, следовательно, увеличивается
- 31. Катализаторы изменяют скорость химической реакции, сохраняя при этом свой состав, они понижают энергию активации. А +
- 32. Катализ подразделяют на положительный (каталитический) и отрицательный (ингибирующий). В организме ингибиторы процессов старения – антиоксиданты (зеленый
- 33. Различают катализ гомогенный (реагирующие вещества и катализатор находятся в одной фазе: окисление серы (IV) кислородом ускоряется
- 34. Микрогетерогенный катализ – в нем используют ВМС в коллоидном состоянии, т.е. ферменты и энзимы (инсулин, гидролаза,
- 35. Характерные особенности ферментов: - Высокая эффективность (в тысячи раз эффективнее химических катализаторов). 2 H2O2 → 2
- 36. - Высокая специфичность, которая осуществляет специфический контакт активного центра фермента с субстратом (амилаза, глюкозидаза, каталаза, пероксидаза,
- 37. Активаторами ферментов могут быть ионы металлов и сложные органические молекулы: нуклеотиды, витамины - коферменты. НАД; НАДН
- 38. Теорию ферментативного катализа предложили Мехаэллис и Ментен в 1913 году.
- 39. Они вывели формулу зависимости стационарной скорости ферментативной реакции (Vст) от концентрации субстрата ( Cs)
- 40. Где: Vм, Kм – постоянные величины для определенных ферментов. Vм – это максимально возможная скорость превращения
- 42. Леонор Михаэлис, Мод Ментен и их грустная кривая , говорящая о том, что если что нибудь
- 43. В настоящее время развивается медицинская энзимология – наука, занимающаяся изучением применения ферментов в качестве лекарственных веществ,
- 44. Принцип Ле-Шателье самостоятельно. Уравнение изотермы: ∆G = -2,3∙R∙T∙lg Kpавн. Химическое равновесие: V = V, ∆G =
- 45. Из уравнения видно, что меньшим значениям ΔG отвечают большие величины Кр, т.е. в равновесной смеси преобладают
- 46. Расчет энтальпии:
- 47. По уравнению изобары видно, что экзотермические реакции (∆Н а эндотермические (∆Н > 0) - в прямом
- 49. Скачать презентацию












































 Презентация по Химии "Ярмарок професій" - скачать смотреть
Презентация по Химии "Ярмарок професій" - скачать смотреть  Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т
Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т Тесты для самопроверки
Тесты для самопроверки Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Растворы. Первичные понятия
Растворы. Первичные понятия Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64
Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64 Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice
Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна
Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна  Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В.
Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В. Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Отдельные классы дисперсных систем
Отдельные классы дисперсных систем Воздушные и тепловые свойства почв
Воздушные и тепловые свойства почв Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Своя игра по химии
Своя игра по химии Алкены
Алкены Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Открытие периодического закона Д.И. Менделеева
Открытие периодического закона Д.И. Менделеева Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина
Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности
Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности Коррозия металлов
Коррозия металлов Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Особенности строения, реакционной способности и методы синтеза аренов
Особенности строения, реакционной способности и методы синтеза аренов Презентация по Химии "Классификация углеводородов" - скачать смотреть
Презентация по Химии "Классификация углеводородов" - скачать смотреть  Силикаты. Пироксены. Амфиболы. Полевые шпаты
Силикаты. Пироксены. Амфиболы. Полевые шпаты Мыс айналымы
Мыс айналымы Хроматографический анализ
Хроматографический анализ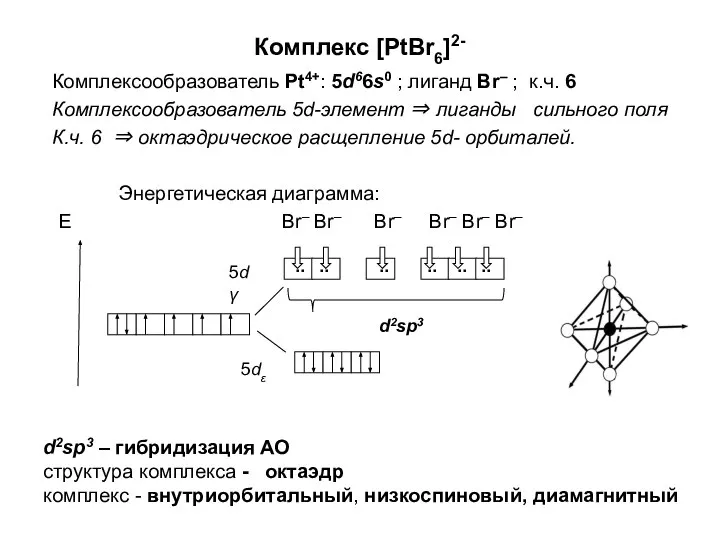 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)