Содержание
- 2. Кислотность и основность – это ключевые понятия, определяющие физико-химические свойства и специфическую биологическую ак-тивность органических соединений
- 3. Теория Бренстеда-Лоури (1923) Й.-Н. Бренстед Т. М. Лоури Кислота - это нейтральная молекула (или ион), способная
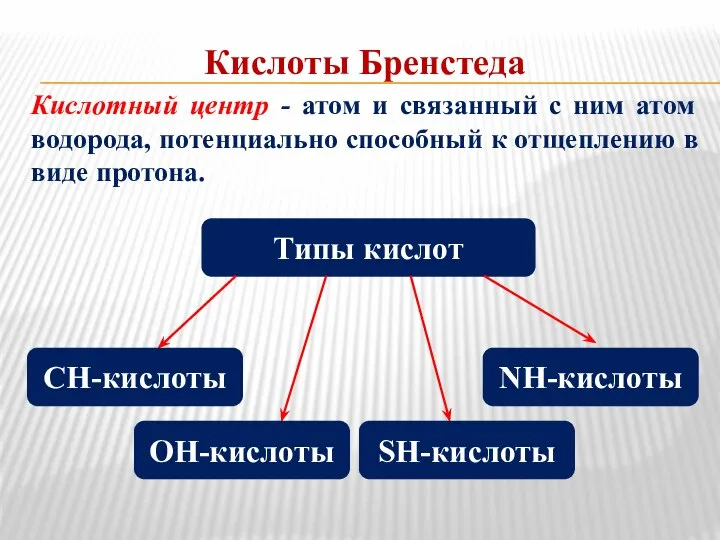
- 4. Кислоты Бренстеда Кислотный центр - атом и связанный с ним атом водорода, потенциально способный к отщеплению
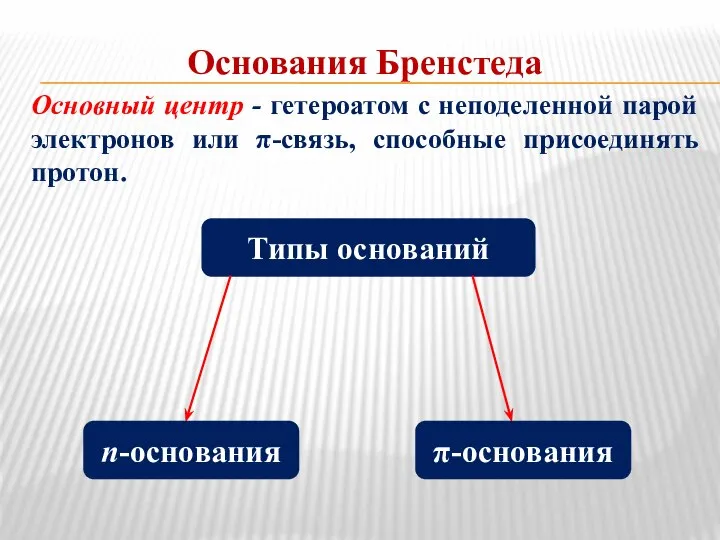
- 5. Основания Бренстеда Основный центр - гетероатом с неподеленной парой электронов или π-связь, способные присоединять протон. Типы
- 6. Факторы, влияющие на кислотность Сила кислоты определяется стабильностью сопряженного основания (аниона) – чем стабильнее анион, тем
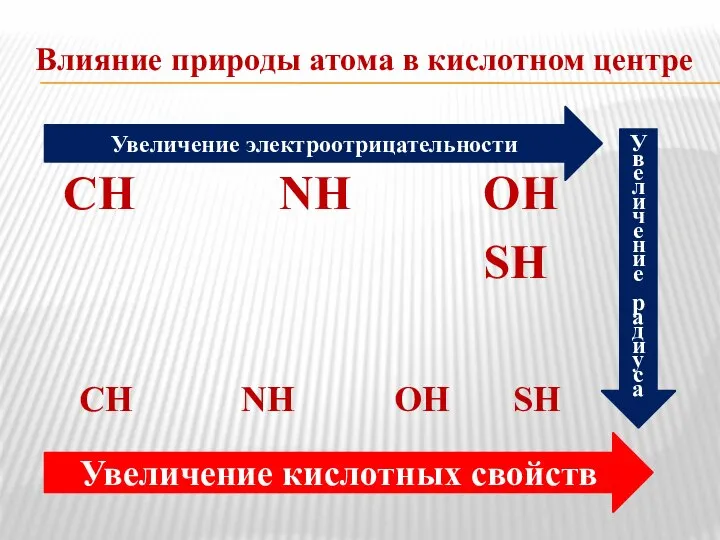
- 7. Влияние природы атома в кислотном центре СН NH ОН SH СН NH ОН SH Увеличение электроотрицательности
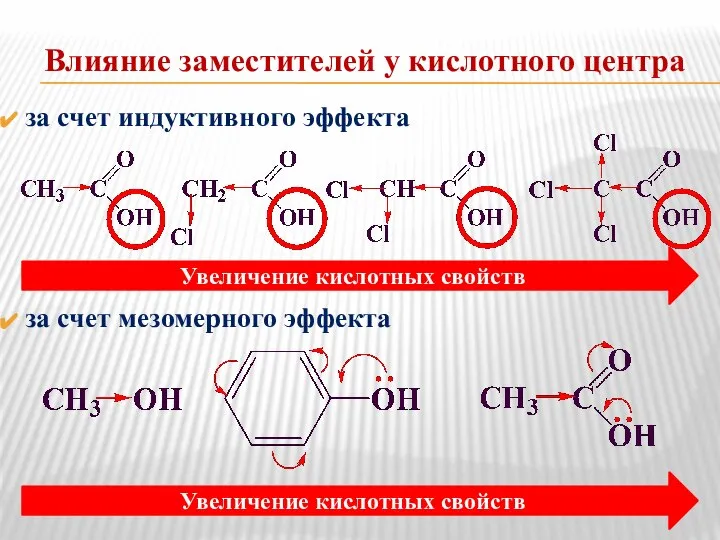
- 8. Влияние заместителей у кислотного центра за счет индуктивного эффекта за счет мезомерного эффекта Увеличение кислотных свойств
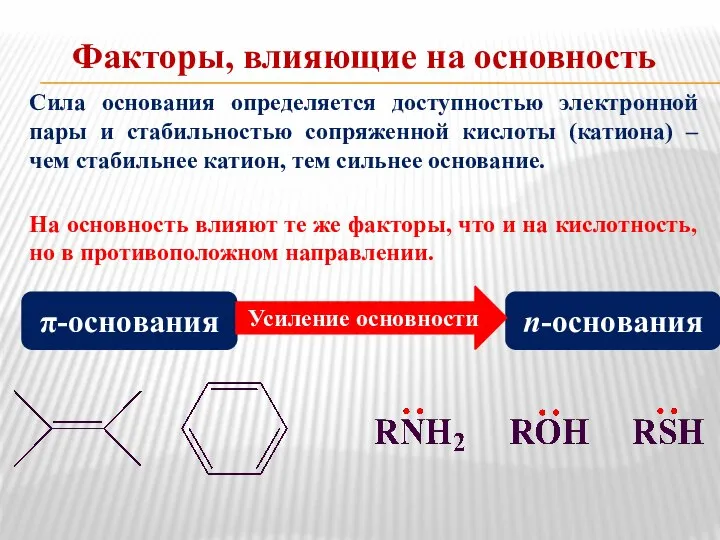
- 9. Факторы, влияющие на основность Сила основания определяется доступностью электронной пары и стабильностью сопряженной кислоты (катиона) –
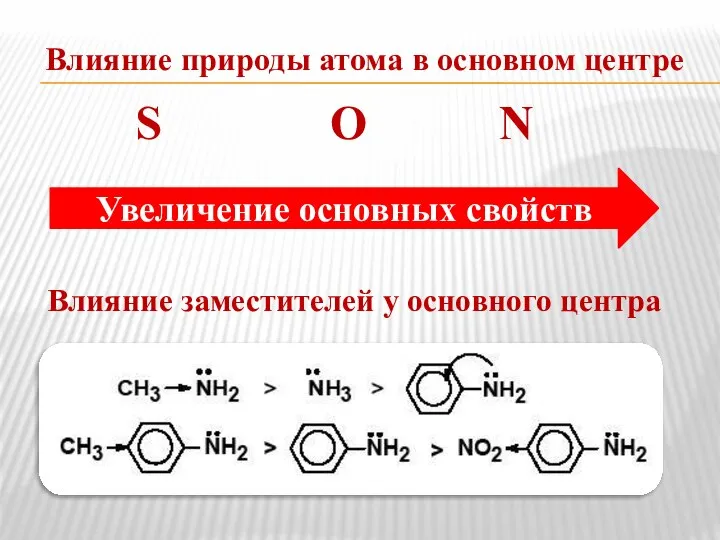
- 10. Влияние природы атома в основном центре S О N Влияние заместителей у основного центра Увеличение основных
- 11. Закономерности влияния заместителей на кислотность и основность Электронодонорные заместители ослабляют кислотность; усиливают основность. Электроноакцепторные заместители усиливают
- 12. Теория Льюиса Кислота - это нейтральная молекула (или ион), являющаяся акцептором электронной пары. Основание - это
- 13. Принцип ЖМКО Пирсона Жесткие кислоты - это кислоты Льюиса, имеющие акцепторные атомы небольших размеров, обладающие большим
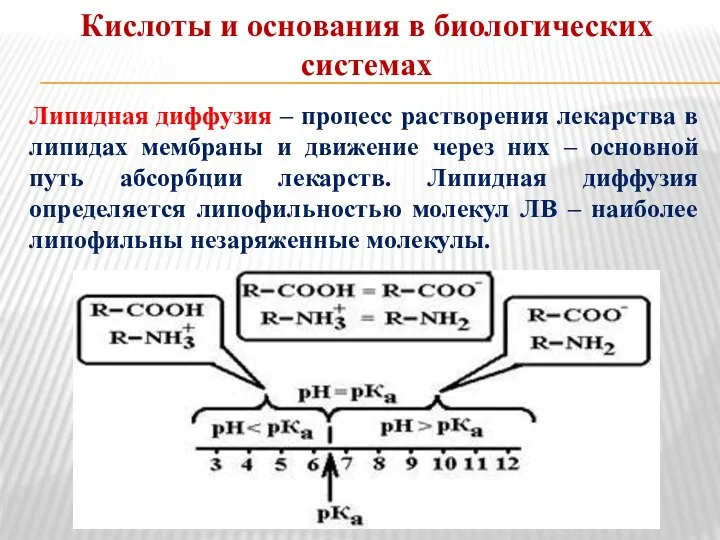
- 14. Кислоты и основания в биологических системах Липидная диффузия – процесс растворения лекарства в липидах мембраны и
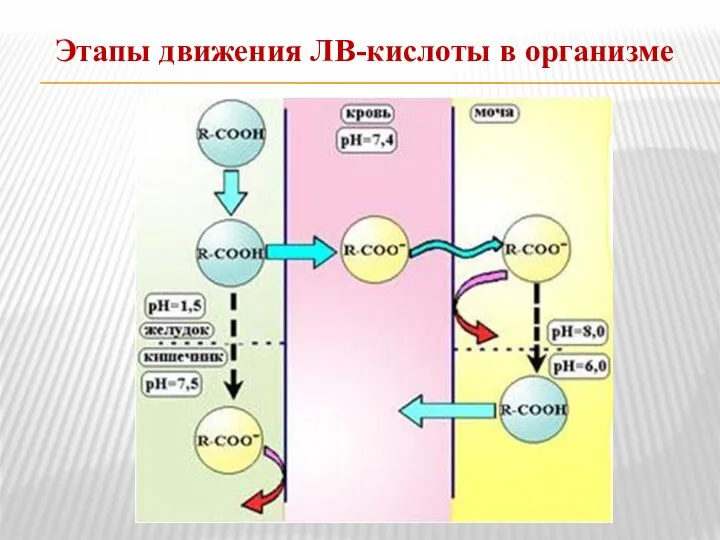
- 15. Этапы движения ЛВ-кислоты в организме
- 17. Скачать презентацию






 Тема урока Валентность и степень окисления 8 класс
Тема урока Валентность и степень окисления 8 класс Полимеры
Полимеры  Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии
Вариации химического состава почек берез дендрария Санкт-Петербургской лесотехнической академии Презентация по Химии "Способы получения металлов" - скачать смотреть
Презентация по Химии "Способы получения металлов" - скачать смотреть  Презентация по Химии "Алгоритм решения задач" - скачать смотреть
Презентация по Химии "Алгоритм решения задач" - скачать смотреть  Нуклеиновые кислоты - полинуклеотиды
Нуклеиновые кислоты - полинуклеотиды Галогены. Способы получения, применение
Галогены. Способы получения, применение 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Координационные соединения
Координационные соединения Федосовой Таисии 8 «в»
Федосовой Таисии 8 «в» Тотығып фосфорлану
Тотығып фосфорлану Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом
Адсорбция. Поглощение газов или паров из газовых смесей или растворов твердым веществом Внеклассная работа по химии Система внеклассной работы по химии
Внеклассная работа по химии Система внеклассной работы по химии Алкены
Алкены Химия 8 класс
Химия 8 класс Минералы. Галенит
Минералы. Галенит Шунгит: минерал, творящий чудеса МОУ «Осташевская СОШ»
Шунгит: минерал, творящий чудеса МОУ «Осташевская СОШ» Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Гидролиз неорганических веществ - солей
Гидролиз неорганических веществ - солей Признаки химических реакций
Признаки химических реакций Полимеры, пластмассы и волокна
Полимеры, пластмассы и волокна Методы решения ОВР с участием органических соединений
Методы решения ОВР с участием органических соединений Коррозионные повреждения
Коррозионные повреждения Амедео Авогадро
Амедео Авогадро Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2) Методы диагностики плазмы
Методы диагностики плазмы Решение заданий С1 вариантов ЕГЭ учитель химии – Новикова Е.В. Окислительно-восстановительные реакции
Решение заданий С1 вариантов ЕГЭ учитель химии – Новикова Е.В. Окислительно-восстановительные реакции Выпускная квалификационная работа Квантово-химическое моделирование свойств координационно-связанной воды
Выпускная квалификационная работа Квантово-химическое моделирование свойств координационно-связанной воды