Содержание
- 2. Ангидрид серной кислоты. Серная кислота. Получение ангидрида серной кислоты (SO3) при катализаторе Pt или V2O5 2SO2
- 3. Аллотропия Явление когда один и тот же химический элемент образует несколько простых веществ, называют аллотропией. Простые
- 4. Флотация Сера на втором месте, после углерода, по количеству аллотропных модификаций. Плотность серы в двое больше
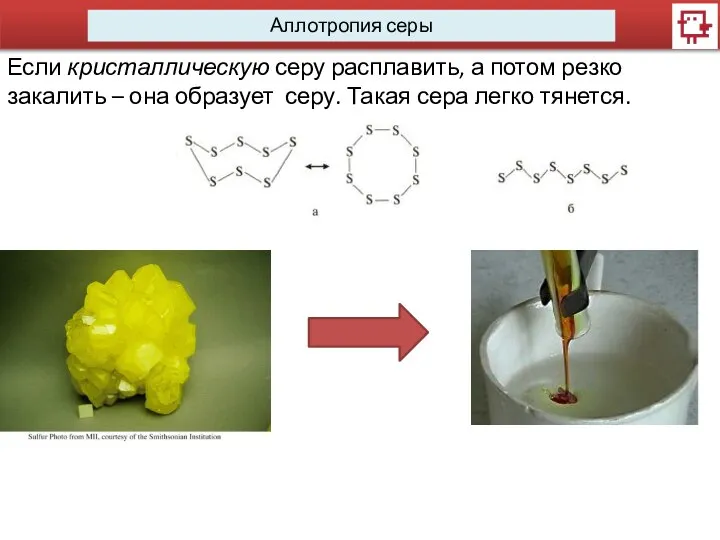
- 5. Аллотропия серы Если кристаллическую серу расплавить, а потом резко закалить – она образует серу. Такая сера
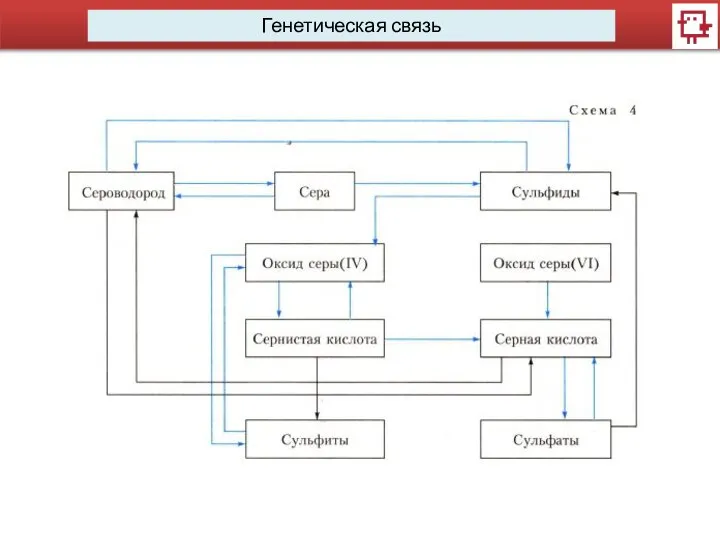
- 6. Генетическая связь
- 7. Применение Сера применяется в : Получении SO2, H2SO4, H2S, CS2 Вулканизация резины Производство пороха Производство инсектицидов
- 8. ДЗ 1. Напишите уравнения реакций, характеризующих следующие превращения: SO2 -> Na2SO3 -> NaHSO3 -> Na2SO3 ->
- 9. Скорость химической реакции Скорость химической реакции определяется изменением концентрации одного из реагирующих веществ в единицу времени.
- 10. Скорость химической реакции Некоторые процессы нужно ускорять (например, в производстве), а некоторые замедлять. Как рассчитать скорость?
- 11. Скорость химической реакции От чего зависит скорость химической реакции? От природы реагирующих веществ Для растворов и
- 12. Химическое равновесие Химическое равновесие характерно для реакций, способных протекать в прямом и обратном направлениях, т.е. из
- 14. Скачать презентацию








 Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит
Анализ лекарственных средств неорганических соединений натрия: натрия гидрокарбонат, натрия тиосульфат, натрия нитрит Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА Коррозия металлов
Коррозия металлов Презентация по химии Общая характеристика реакций органических соединений. Классификация органических реакций и реагентов.
Презентация по химии Общая характеристика реакций органических соединений. Классификация органических реакций и реагентов.  Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна
Верхівцевький НВК. Верхівцевький НВК. Учитель хімії Кукса Наталія Миколаївна  Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Пластмассы. Материалы, устойчивые против агрессивой среды
Пластмассы. Материалы, устойчивые против агрессивой среды Структурные превращения стали 15Х5М при различных режимах термической обработки
Структурные превращения стали 15Х5М при различных режимах термической обработки Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни
Курс «Неорганическая химия» Лектор: Третьяков Юрий Дмитриевич Расписание лекций: вторник – 10:50 – 12:25 пятни Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе
Физические и химические свойства железа Учитель химии МОУ СОШ №97 Новикова Ирина Владимировна Урок химии в 9 классе Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии Презентация на тему: Хром
Презентация на тему: Хром Химический элемент фосфор. Фосфор в составе ДНК и РНК
Химический элемент фосфор. Фосфор в составе ДНК и РНК Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома
Методика изучения периодического закона, периодической системы Д.И. Менделеева и строения атома Классы неорганических веществ
Классы неорганических веществ Пищевая сода
Пищевая сода Вакуумная перегонка мазута
Вакуумная перегонка мазута Галогены
Галогены Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Обмен липидов
Обмен липидов 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Электронное строение атома
Электронное строение атома Органические соединения в атмосфере
Органические соединения в атмосфере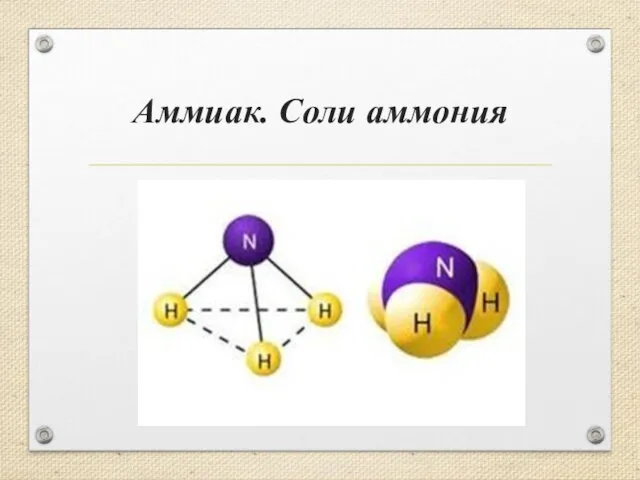 урок
урок Вещества, входящие в состав живых организмов
Вещества, входящие в состав живых организмов