Содержание
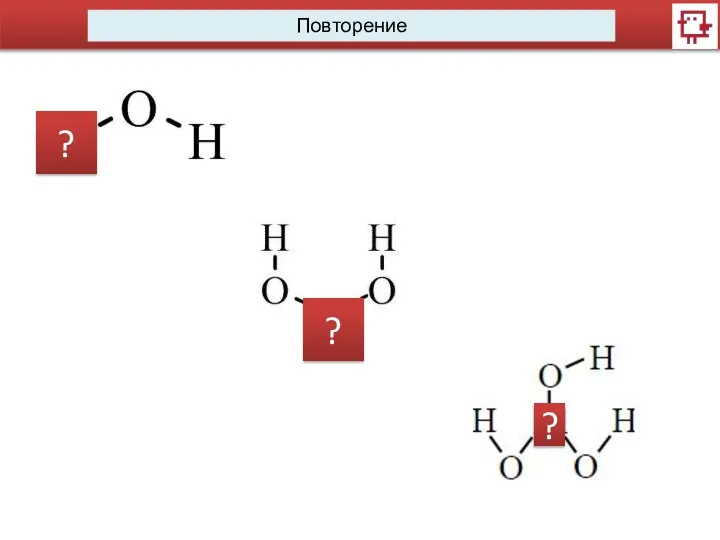
- 2. Повторение ? ? ?
- 3. Повторение CaO + H2O ? CuCl2 + NaOH ? Li2O + H2O ? CaCO3 + SiO2
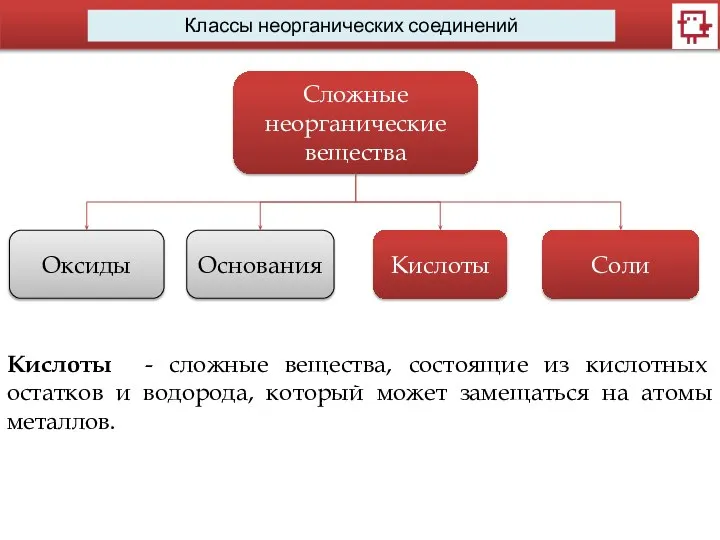
- 4. Классы неорганических соединений Сложные неорганические вещества Оксиды Основания Кислоты Соли Кислоты - сложные вещества, состоящие из
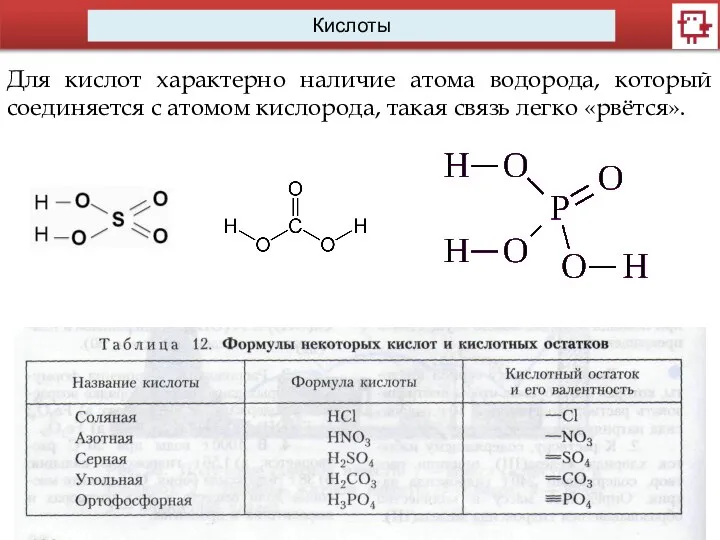
- 5. Кислоты Для кислот характерно наличие атома водорода, который соединяется с атомом кислорода, такая связь легко «рвётся».
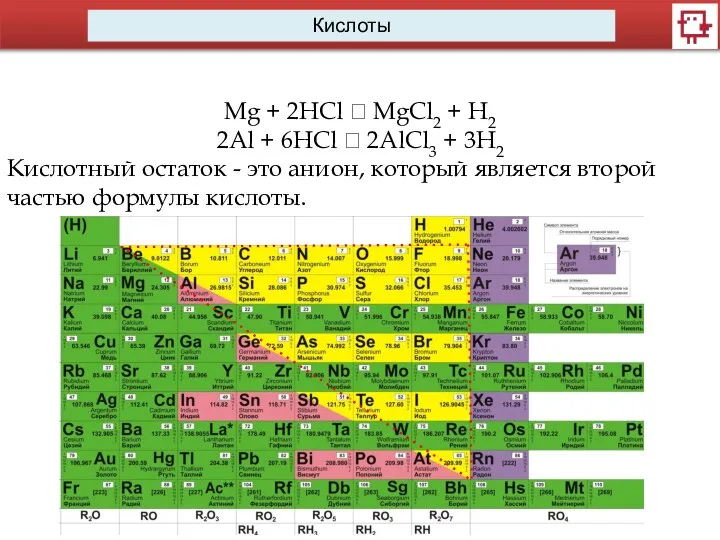
- 6. Кислоты Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотный
- 7. Кислоты Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотные
- 8. Кислоты Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная
- 9. Кислоты Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная
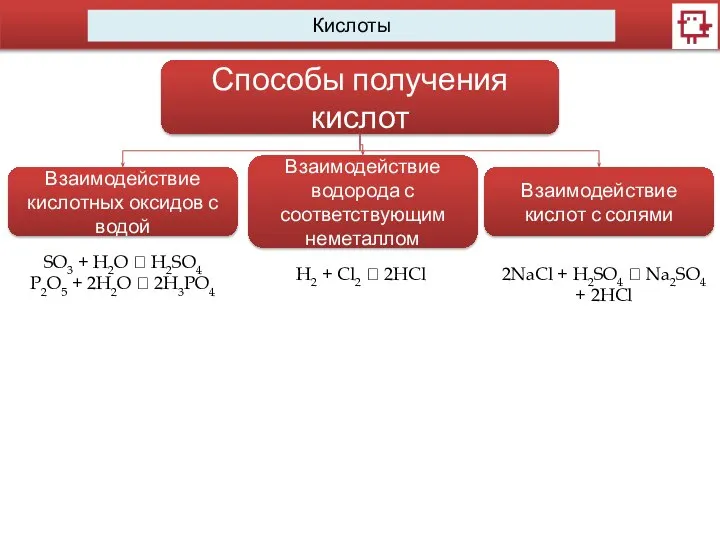
- 10. Кислоты Способы получения кислот Взаимодействие кислотных оксидов с водой Взаимодействие водорода с соответствующим неметаллом Взаимодействие кислот
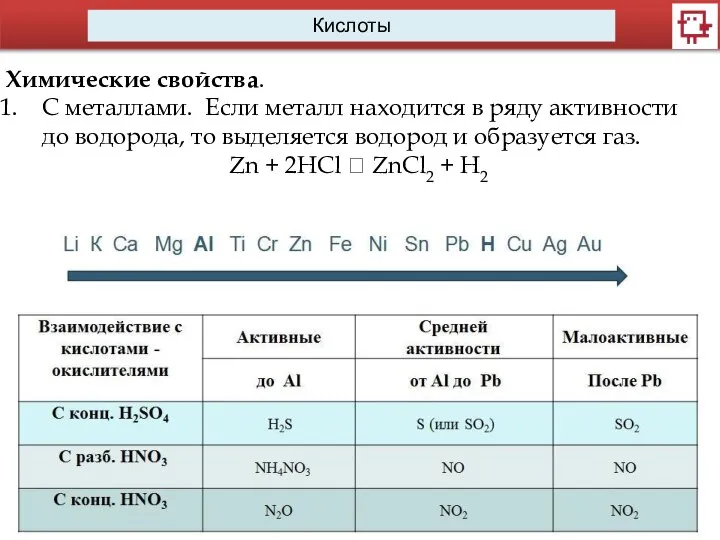
- 11. Кислоты Химические свойства. C металлами. Если металл находится в ряду активности до водорода, то выделяется водород
- 12. Кислоты Химические свойства. 2. C основными оксидами. Образуется соль и вода. CuO + H2SO4 ? CuSO4
- 13. Кислоты Химические свойства. 3. С основаниями. Образуется соль и вода. NaOH + HCl ? NaCl +
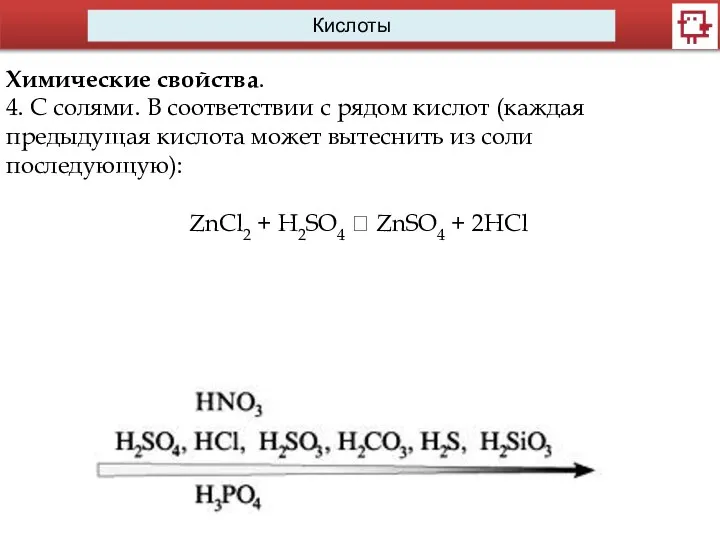
- 14. Кислоты Химические свойства. 4. С солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить
- 16. Скачать презентацию






 Химия и здоровье человека
Химия и здоровье человека Материаловедение. Теория сплавов
Материаловедение. Теория сплавов Термодинамика и теплопередача. Влажный воздух
Термодинамика и теплопередача. Влажный воздух Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8)
Супрамолекулярная химия в живой природе. Валиномицин. Родопсин. Тетрапиррольные макроциклы (Лекция 8) Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Кислород. Сера
Кислород. Сера Химические свойства алкенов
Химические свойства алкенов Анилин
Анилин Углеводы. Химический состав углеводов
Углеводы. Химический состав углеводов МОУ «Масловская средняя общеобразовател
МОУ «Масловская средняя общеобразовател Комплексные соединения
Комплексные соединения An introduction to bonding
An introduction to bonding Observing change. Chemical reactions
Observing change. Chemical reactions Строение атома. Периодический закон
Строение атома. Периодический закон АЛХИМИКИ Автор: Дашков Виталий, ученик 9 класса МОУ «Арбузовская сош»
АЛХИМИКИ Автор: Дашков Виталий, ученик 9 класса МОУ «Арбузовская сош»  Волокна підготував учень 11 класу :
Волокна підготував учень 11 класу :  Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Презентация Стекло, история открытия
Презентация Стекло, история открытия Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно
Презентация по Химии "Синтетические лекарственные средства" - скачать смотреть бесплатно Рідкі кристали Використання
Рідкі кристали Використання  Пролекарственные стратегии в создании клинически используемых лекарственных средств
Пролекарственные стратегии в создании клинически используемых лекарственных средств Промышленные типы месторождений железа
Промышленные типы месторождений железа Природный газ
Природный газ Презентация по Химии "Биополимеры" - скачать смотреть бесплатно
Презентация по Химии "Биополимеры" - скачать смотреть бесплатно Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки Растворы
Растворы Неметаллы: общая характеристика
Неметаллы: общая характеристика