Содержание
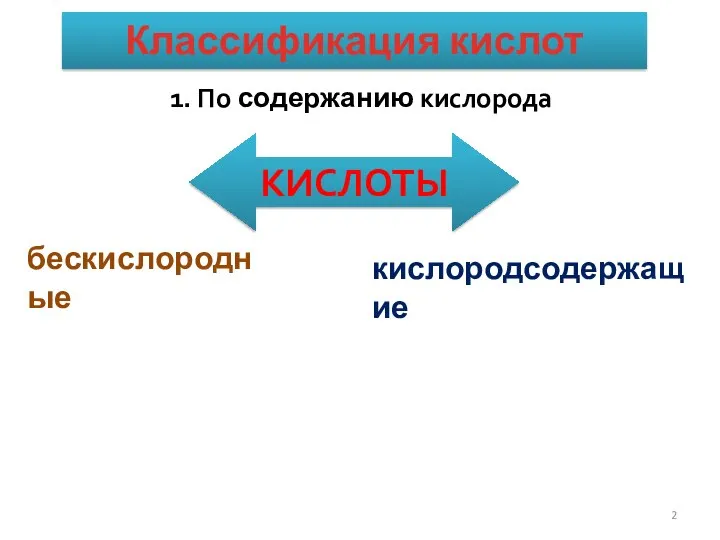
- 2. КЛАССИФИКАЦИЯ КИСЛОТ. 1. По содержанию кислорода КИСЛОТЫ Классификация кислот бескислородные кислородсодержащие
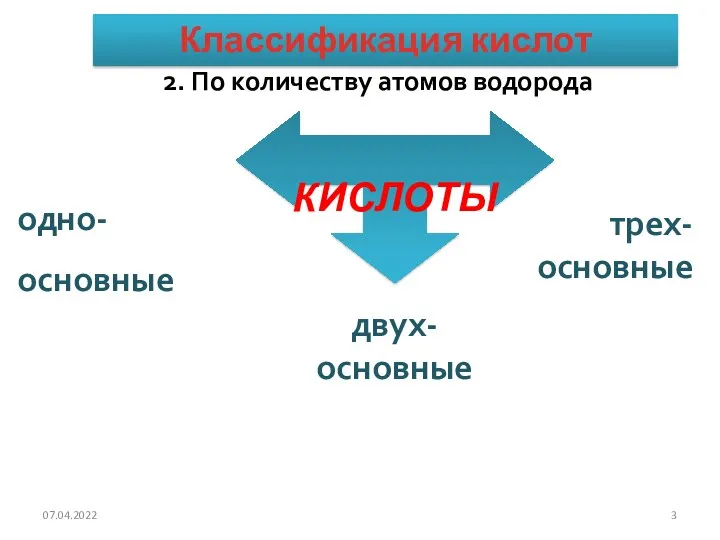
- 3. 2. По количеству атомов водорода КИСЛОТЫ одно- основные двух-основные трех-основные Классификация кислот 07.04.2022
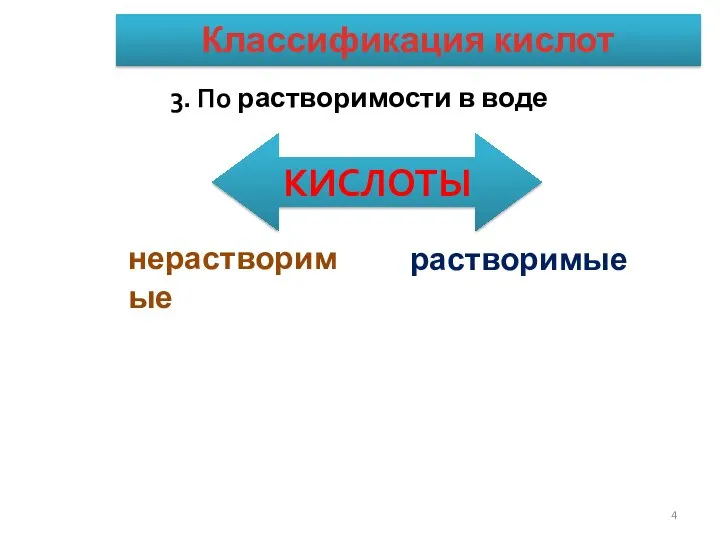
- 4. КЛАССИФИКАЦИЯ КИСЛОТ. 3. По растворимости в воде КИСЛОТЫ нерастворимые растворимые Классификация кислот
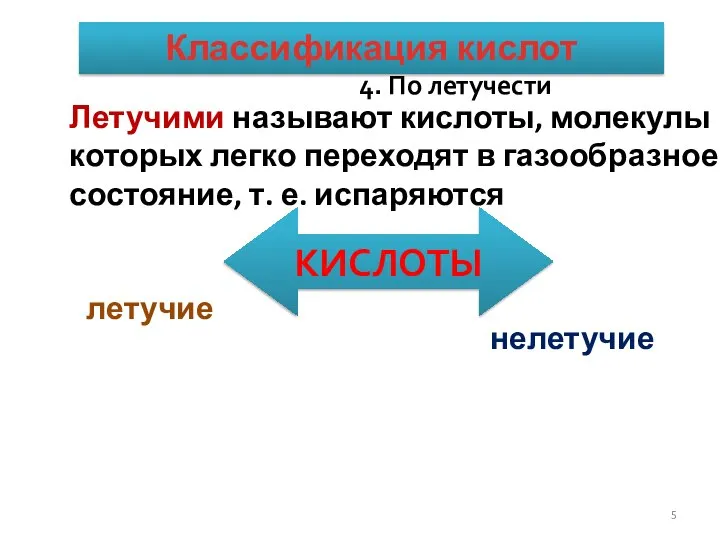
- 5. КЛАССИФИКАЦИЯ КИСЛОТ. 4. По летучести КИСЛОТЫ летучие нелетучие Летучими называют кислоты, молекулы которых легко переходят в
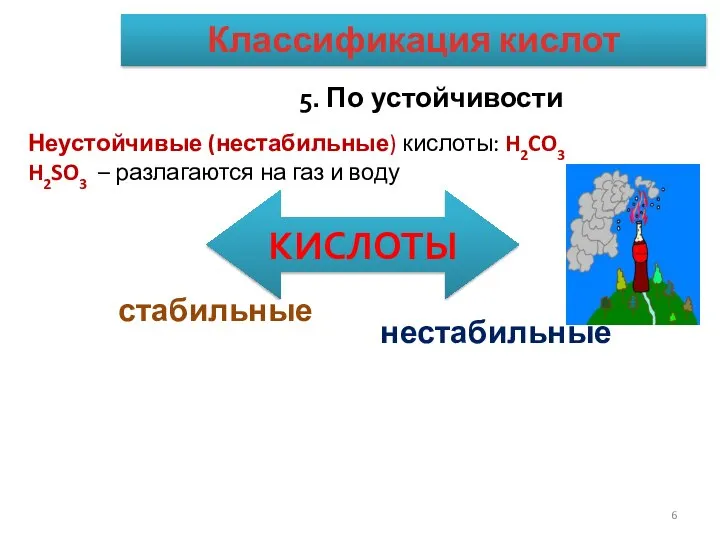
- 6. 5. По устойчивости КИСЛОТЫ стабильные нестабильные Неустойчивые (нестабильные) кислоты: H2CO3 H2SO3 – разлагаются на газ и
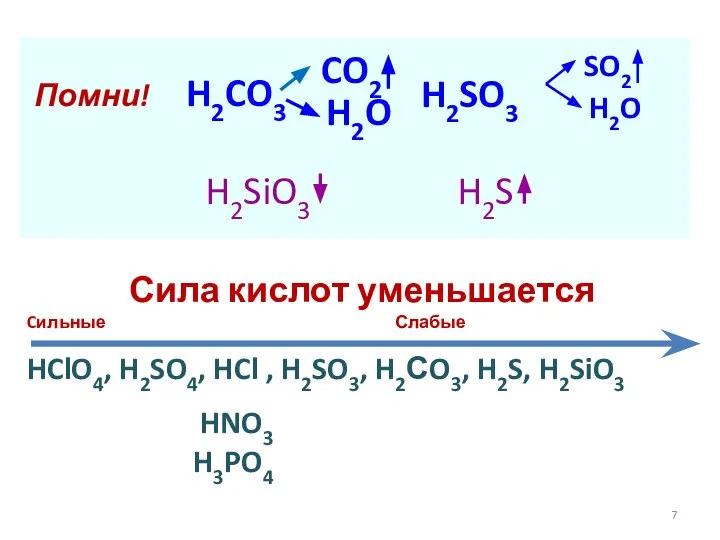
- 7. Помни! H2CO3 CO2 H2O H2SO3 SO2 H2O H2SiO3 H2S Сила кислот уменьшается Cильные Слабые HClO4, H2SO4,
- 8. ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ Едкое вещество—кислота! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора
- 9. Химические свойства кислот
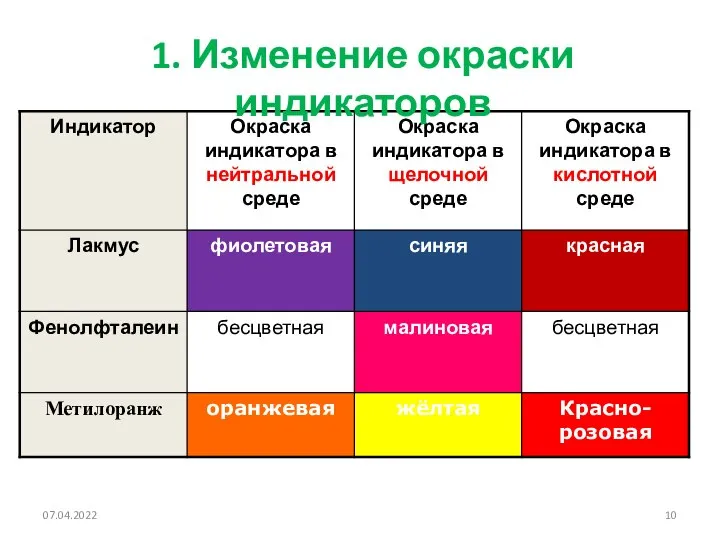
- 10. 1. Изменение окраски индикаторов 07.04.2022
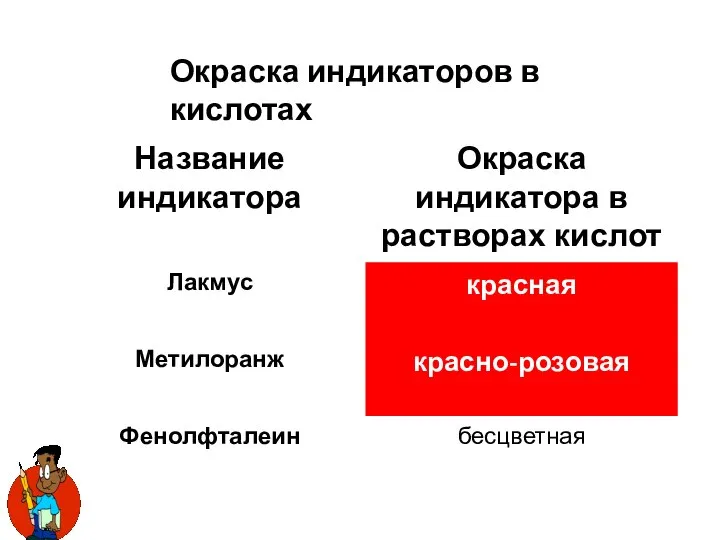
- 11. Окраска индикаторов в кислотах
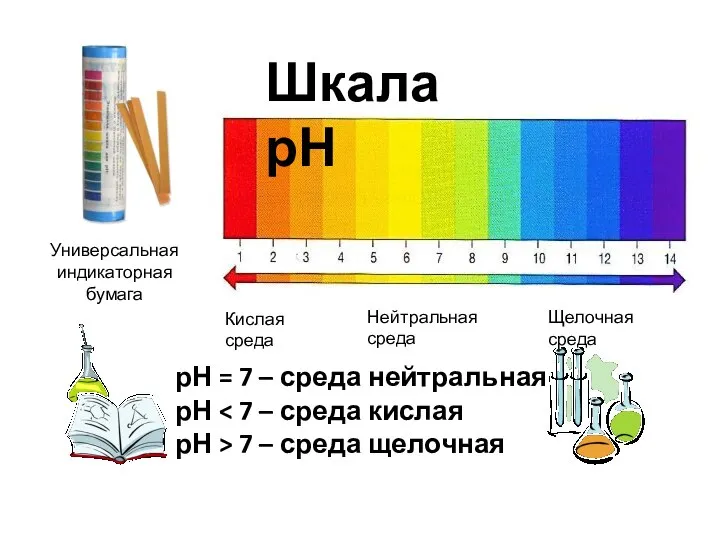
- 12. Универсальная индикаторная бумага Шкала рН Кислая среда Щелочная среда Нейтральная среда рН = 7 – среда
- 13. 2. Взаимодействие с Металлами. Ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al
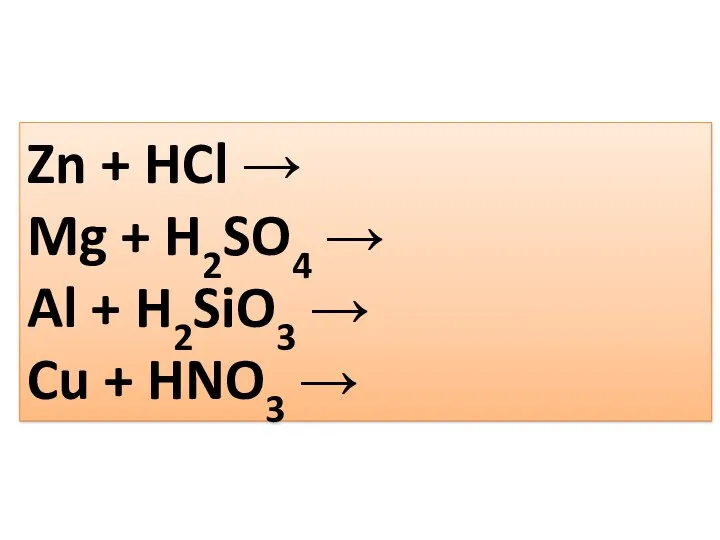
- 14. Zn + HCl → Mg + H2SO4 → Al + H2SiO3 → Cu + HNO3 →
- 15. Кислота + основный оксид → соль + вода Кислота + амфотерный оксид → соль + вода
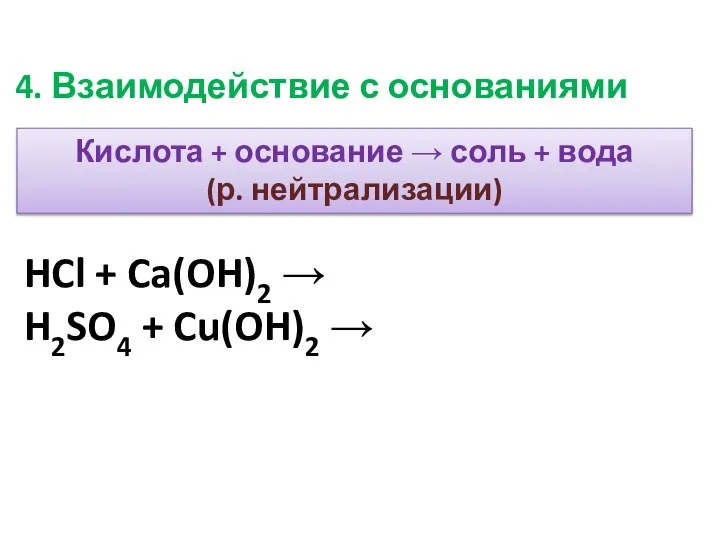
- 16. Кислота + основание → соль + вода (р. нейтрализации) HCl + Ca(OH)2 → H2SO4 + Cu(OH)2
- 17. Кислота + соль → новая кислота + новая соль (р. обмена) Условия протекания реакции: выпадение осадка
- 19. Скачать презентацию





 Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Технологія жирів і жирозамінників
Технологія жирів і жирозамінників Смеси и растворы
Смеси и растворы Термодинамика поверхностных явлений. (Часть 2)
Термодинамика поверхностных явлений. (Часть 2) Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Химическое образование в современной средней (полной) общеобразовательной школе
Химическое образование в современной средней (полной) общеобразовательной школе معطر الجو(الهواء) يستعمل معطر الجو لتلطيف الرائحة االستعمال للحمامات او الغرف
معطر الجو(الهواء) يستعمل معطر الجو لتلطيف الرائحة االستعمال للحمامات او الغرف Промышленный биокатализ
Промышленный биокатализ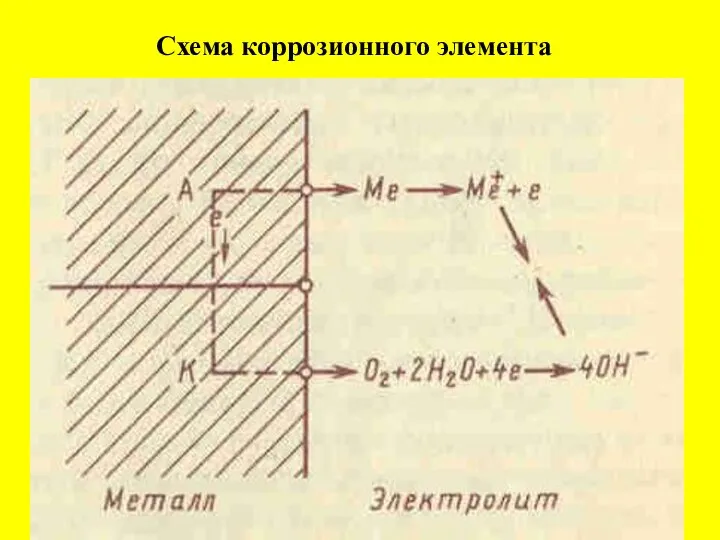 Схема коррозионного элемента
Схема коррозионного элемента Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства
Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства Физические основы методов анализа вещества
Физические основы методов анализа вещества Ванадатты фосфаттар. Орынбасар фосфаттар. Төменгі оксоқышқылдар
Ванадатты фосфаттар. Орынбасар фосфаттар. Төменгі оксоқышқылдар Мұнай
Мұнай Всем известно, всем понятно, что здоровым быть приятно!
Всем известно, всем понятно, что здоровым быть приятно! Алкины. Ацетилен
Алкины. Ацетилен Периодический закон Менделеева и периодическая система химических элементов
Периодический закон Менделеева и периодическая система химических элементов  Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ
Предмет и задачи фармацевтической химии. Общие методы анализа лекарственных средств неорганической природы согласно ГФУ Поливинилацетат
Поливинилацетат Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Карбоновые кислоты. Гидрокси-, оксокислоты. Лекция 2
Карбоновые кислоты. Гидрокси-, оксокислоты. Лекция 2 Интегрированный урок История+Химия
Интегрированный урок История+Химия Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? Термодинамика. 2 закон термодинамики. Энтропия
Термодинамика. 2 закон термодинамики. Энтропия Элективный курс по химии «Лаборатория юных химиков» Для учащихся 8 класса Разработала учитель химии МОУ СОШ №3 Звёздочкина С.А.
Элективный курс по химии «Лаборатория юных химиков» Для учащихся 8 класса Разработала учитель химии МОУ СОШ №3 Звёздочкина С.А. Электрохимические методы. (Лекция 3)
Электрохимические методы. (Лекция 3) «Соединения химических элементов»
«Соединения химических элементов»