Содержание
- 2. Адсорбция — увеличение концентрации вещества на границе раздела фаз. лат. ad — на sorbeo — поглощаю
- 3. Жидкость или твердое тело, на поверхности которых происходит адсорбция - адсорбент. Адсорбируемое вещество до адсорбции -адсорбтив,
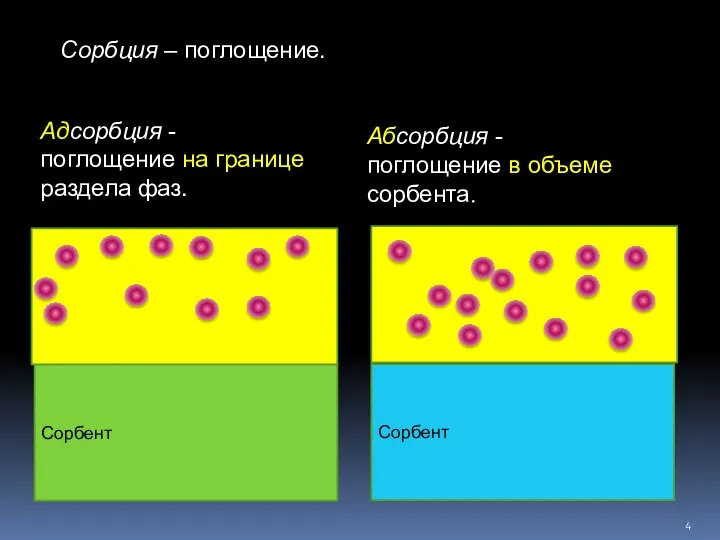
- 4. Сорбция – поглощение. Сорбент Сорбент Абсорбция - поглощение в объеме сорбента. Адсорбция - поглощение на границе
- 5. http://sci-humor.blogspot.com/2009/05/blog-post_25.html
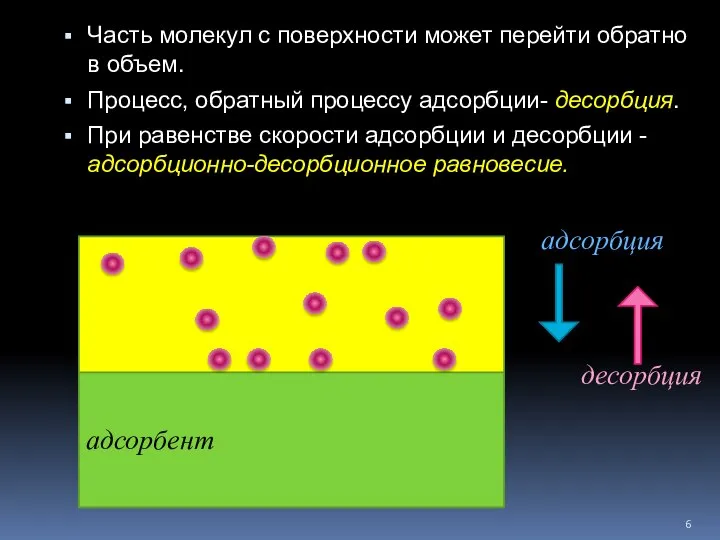
- 6. Часть молекул с поверхности может перейти обратно в объем. Процесс, обратный процессу адсорбции- десорбция. При равенстве
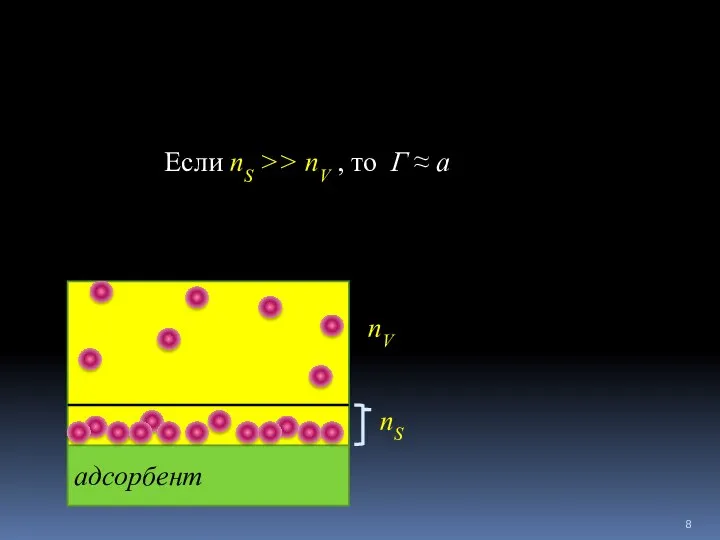
- 7. Количественное выражение адсорбции Избыточная (Гиббсова) адсорбция Г (моль/м2) - избыток количества вещества адсорбата на поверхности адсорбента
- 8. адсорбент Если nS >> nV , то Г ≈ а nS nV
- 9. Физическая адсорбция обусловлена силами межмолекулярного взаимодействия адсорбент — адсорбат. Молекулы адсорбата сохраняют свою индивидуальность. Теплота физической
- 10. Химическая адсорбция (хемосорбция) обусловлена химическим взаимодействием адсорбент — адсорбат, сопровождается образованием поверхностных соединений. Теплота хемосорбции более
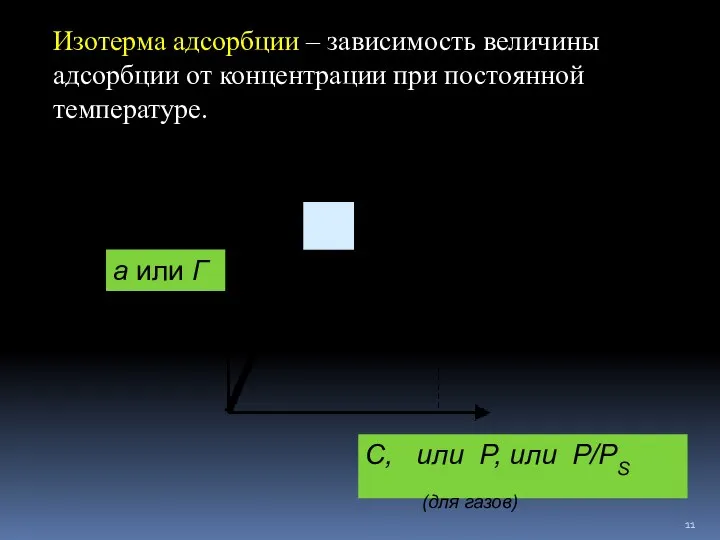
- 11. Изотерма адсорбции – зависимость величины адсорбции от концентрации при постоянной температуре. а или Г С, или
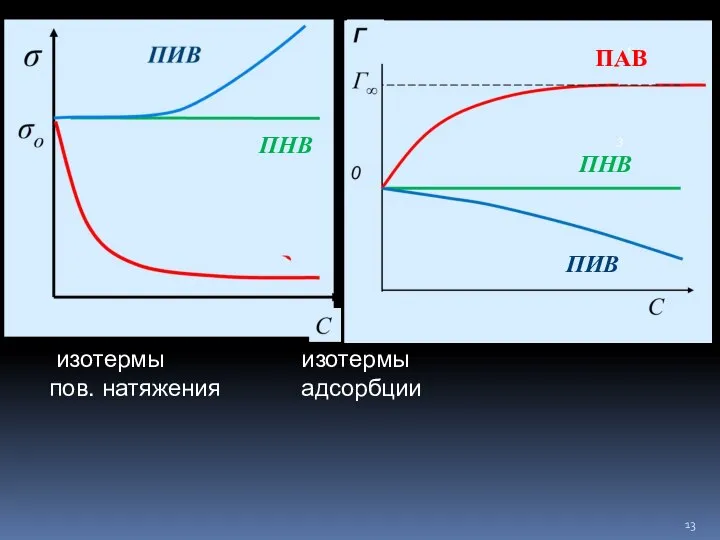
- 12. Адсорбция на границе раздела «жидкость – газ» энергетически выгодна адсорбция тех веществ, которые снижают σ поверхностно-активные
- 13. ПАВ ПИВ изотермы изотермы пов. натяжения адсорбции ПНВ ПНВ
- 14. Для ПАВ – низших гомологов алифатических кислот и спиртов (до С7-С8) эмпирическое уравнение Шишковского: σ=σ0–Вln (1+Ac),
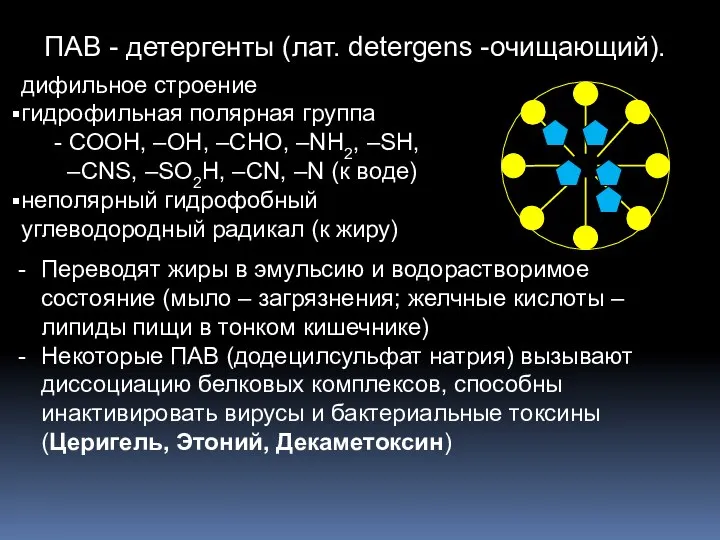
- 15. ПАВ - детергенты (лат. detergens -очищающий). дифильное строение гидрофильная полярная группа - СООН, –ОН, –СНО, –NH2,
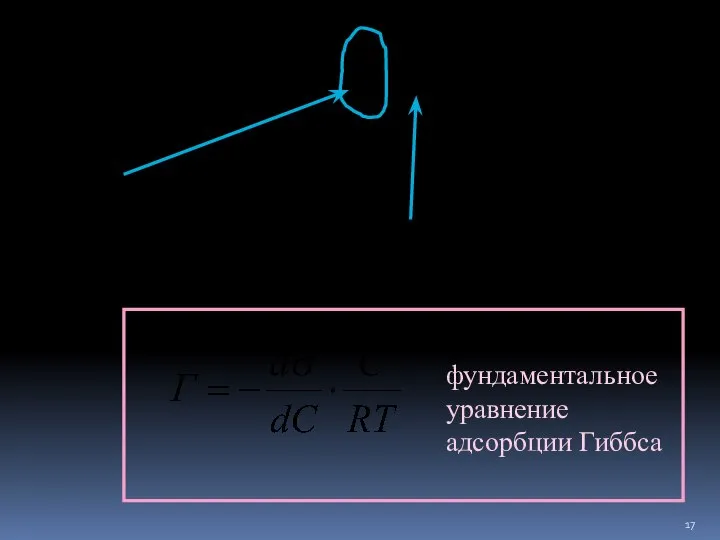
- 16. Адсорбция — самопроизвольный энергетически выгодный процесс. Уравнение адсорбции Гиббса Адсорбция – самопроизвольный энергетически выгодный процесс. Причина
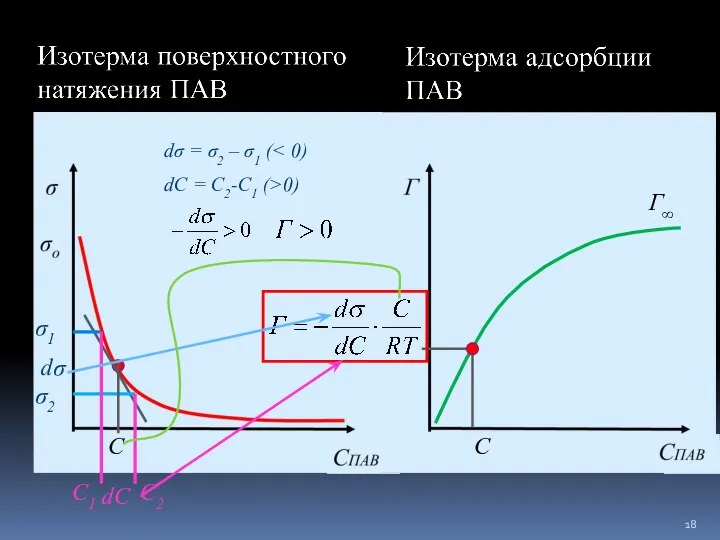
- 17. фундаментальное уравнение адсорбции Гиббса
- 18. dσ dC C C dσ = σ2 – σ1 ( σ1 σ2 dC = C2-C1 (>0)
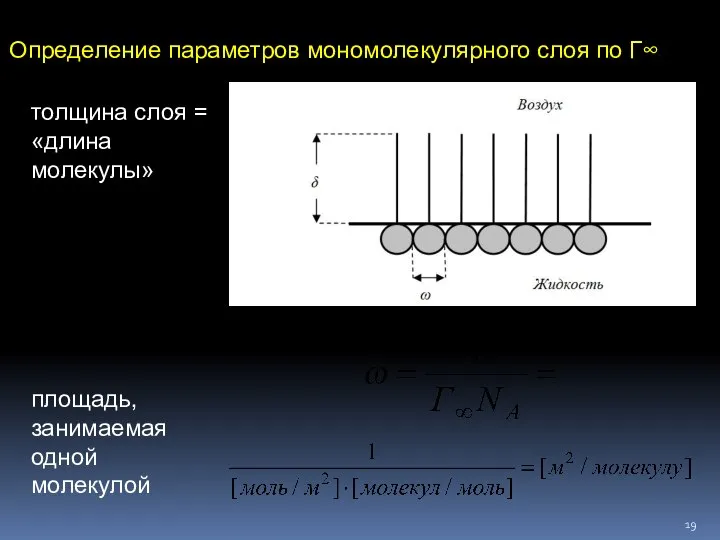
- 19. Определение параметров мономолекулярного слоя по Г∞ толщина слоя = «длина молекулы» площадь, занимаемая одной молекулой
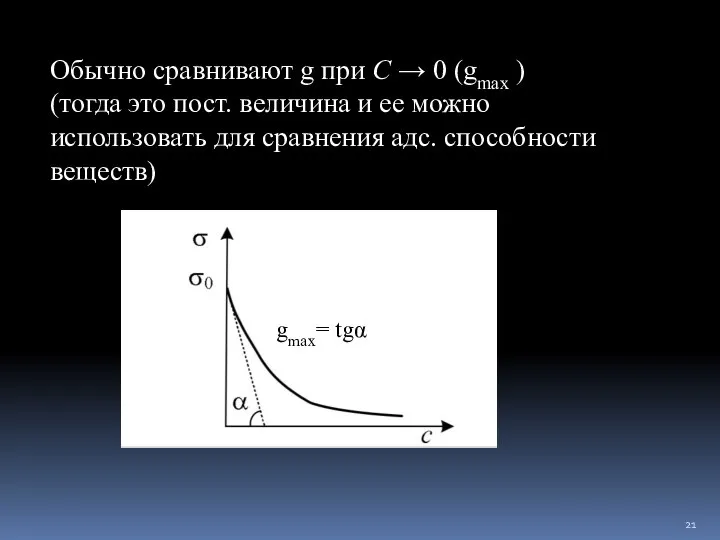
- 20. Поверхностная активность g - способность вещества при адсорбции снижать σ в зависимости от его C в
- 21. gmax= tgα Обычно сравнивают g при С → 0 (gmax ) (тогда это пост. величина и
- 22. ПАВ (σ уменьшается с ростом С, адсорбция самопроизвольна) ПИАВ ПНВ
- 24. Скачать презентацию











 Презентация по Химии "Комплексные соединения" - скачать смотреть
Презентация по Химии "Комплексные соединения" - скачать смотреть  Презентація по темі «Білки та Амінокислоти»
Презентація по темі «Білки та Амінокислоти»  Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви
Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви Презентация по Химии "Вода в моем доме" - скачать смотреть
Презентация по Химии "Вода в моем доме" - скачать смотреть  Состав и свойства помидоров
Состав и свойства помидоров Углеводороды нефти. Алканы. Парафины
Углеводороды нефти. Алканы. Парафины Химическая посуда и её назначение (3)
Химическая посуда и её назначение (3) Гравиметрический анализ в аналитической химии
Гравиметрический анализ в аналитической химии Морфология почв. (Лекция 7)
Морфология почв. (Лекция 7) Доронькин Владимир Николаевич, кандидат химических наук, доцент РГУПС, автор пособий по химии издательства «Легион»
Доронькин Владимир Николаевич, кандидат химических наук, доцент РГУПС, автор пособий по химии издательства «Легион»  Названия алканов
Названия алканов Презентация по Химии "Соли, их состав и названия" - скачать смотреть
Презентация по Химии "Соли, их состав и названия" - скачать смотреть  Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Аттестационная работа. Исследовательская работа «Выращивание кристаллов»
Аттестационная работа. Исследовательская работа «Выращивание кристаллов» Глицерин
Глицерин Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Нарушения водно-электролитного и кислотно-основного обмена
Нарушения водно-электролитного и кислотно-основного обмена Презентация по Химии "Алюминий и его соединения" - скачать смотреть
Презентация по Химии "Алюминий и его соединения" - скачать смотреть  Предельные одноатомные спирты Герасимова Н.Ф. – учитель химии ГОУ СОШ №639 ЮАО г.Москва
Предельные одноатомные спирты Герасимова Н.Ф. – учитель химии ГОУ СОШ №639 ЮАО г.Москва  Ионообменная хроматография
Ионообменная хроматография Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть
Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть  Кислоты вокруг нас
Кислоты вокруг нас Каучук и резиновые материалы
Каучук и резиновые материалы Циклоалканы
Циклоалканы Дикарбоновые кислоты
Дикарбоновые кислоты Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть  Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Кислоты. Состав кислот
Кислоты. Состав кислот