Содержание
- 2. Карбоновые кислоты – большая группа органических соединений, содержащие в молекулах не менее 1 карбоксильной группы –СООН.
- 3. ФИЗИЧЕСКИЕ СВОЙСТВА Карбоновые кислоты – бесцветные жидкие или твердые вещества, растворимые в органических растворителях. Низшие насыщенные
- 4. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ КАРБОНОВЫХ КИСЛОТ: Монокарбоновые насыщенные: НСООН - муравьиная, формиат СН3СООН - уксусная, ацетат СН3СН2СООН -
- 5. Дикарбоновые насыщенные: НООС-СООН - щавелевая, оксалат НООС-СН2-СООН - малоновая, малонат НООС-(СН2)2-СООН - янтарная, сукцинат НООС-(СН2)3-СООН -
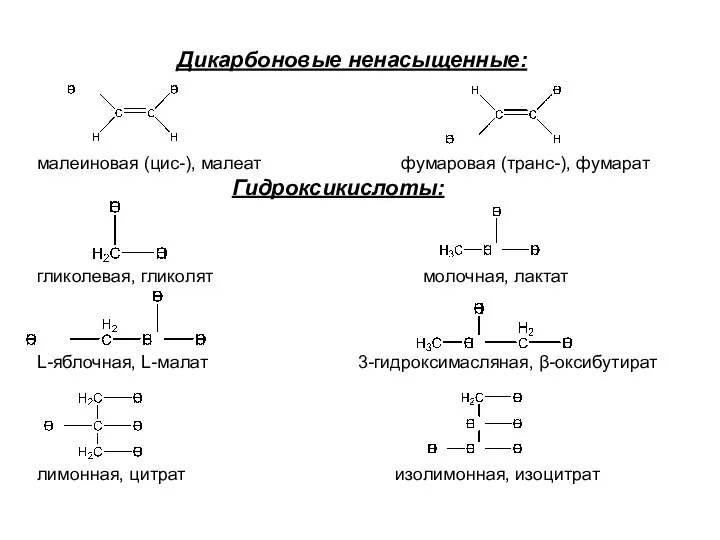
- 6. Дикарбоновые ненасыщенные: малеиновая (цис-), малеат фумаровая (транс-), фумарат Гидроксикислоты: гликолевая, гликолят молочная, лактат L-яблочная, L-малат 3-гидроксимасляная,
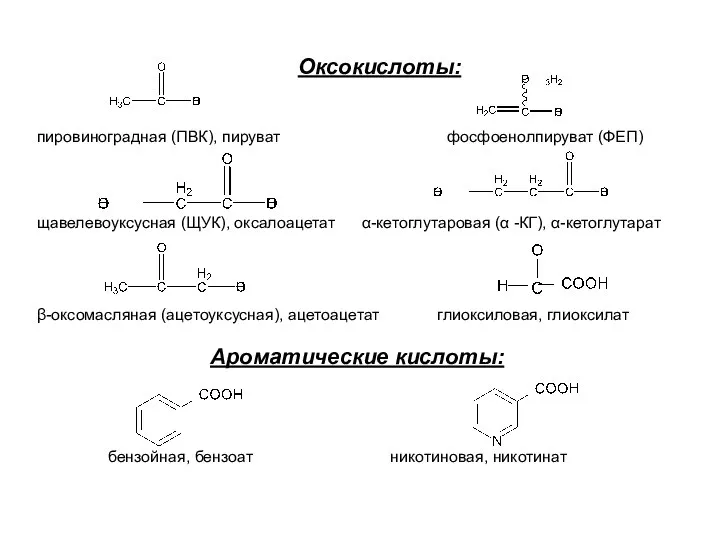
- 7. Оксокислоты: пировиноградная (ПВК), пируват фосфоенолпируват (ФЕП) щавелевоуксусная (ЩУК), оксалоацетат α-кетоглутаровая (α -КГ), α-кетоглутарат β-оксомасляная (ацетоуксусная), ацетоацетат
- 8. СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ Карбоксильная (-СООН) и карбоксилатная (-СОО-) группы полярные, электроноакцепторные (- I, - M) сопряженные
- 9. ОБЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ В молекуле имеется 4 типа реакционных центров: OH-группа обладает заметной
- 10. КАЧЕСТВЕННЫЕ РЕАКЦИИ КАРБОНОВЫХ КИСЛОТ - все растворимые кислоты реагируют с водным NaHCO3: RCOOH + NaHCO3 →
- 11. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN) ПРИ КАРБОНИЛЬНОЙ ГРУППЕ Это многочисленные и разнообразные реакции взаимных превращений производных карбоновых
- 12. Этерификация/гидролиз сложных эфиров: RCOOH + R1OH RCOOR1 + H2O Образование амидов: RCOOH + NH3 → RCOO-
- 13. Реакционная способность RCO-X в реакциях SN (RCO-X + Y → RCO-Y + X) в зависимости от
- 14. ПОВЕДЕНИЕ КИСЛОТ ПРИ НАГРЕВАНИИ Насыщенные карбоновые кислоты термически устойчивы, только их соли декарбоксилируются при нагревании (натриевые
- 15. БИОЗНАЧЕНИЕ НАСЫЩЕННЫХ КАРБОНОВЫХ КИСЛОТ Насыщенные карбоновые кислоты содержатся в пищевых жирах, в организме окисляются в виде
- 16. БИОЗНАЧЕНИЕ НЕНАСЫЩЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ Акриловая, метакриловая кислоты и их эфиры (метилметакрилат) в виде полимеров входят в
- 17. АЦЕТИЛ-КОА – ВАЖНЕЙШИЙ МЕТАБОЛИТ КЛЕТОК Ацетил-КоА - активированная для метаболических целей форма уксусной кислоты: ● образуется
- 18. БИОЗНАЧЕНИЕ ДИКАРБОНОВЫХ КИСЛОТ Щавелевая, янтарная и фумаровая кислоты – метаболиты клеток: щавелевая токсична – вызывает образование
- 19. БИОЗНАЧЕНИЕ ГИДРОКСИ- И ОКСОКИСЛОТ Ряд гидрокси- и оксокислот – метаболиты клеток, используются в пластических и энергетических
- 20. In vivo гидрокси- и оксокислоты с одинаковым скелетом способны взаимопревращаться: L-малат ↔ ЩУК; β-оксибутират ↔ ацетоацетат
- 21. ЦИКЛ КРЕБСА (ЦТК) (ЗНАЧЕНИЕ, РЕАКЦИИ) ЦТК – центральный путь анаэробного окисления ацетил-КоА с целью получения энергии,
- 23. Скачать презентацию


















 Химия. Атомы, молекулы и ионы
Химия. Атомы, молекулы и ионы Свойства фенола
Свойства фенола Природный газ, его добыча и применение
Природный газ, его добыча и применение Биогенные р-элементы-органогены и физиологически активные галогены
Биогенные р-элементы-органогены и физиологически активные галогены Электролитическая диссоциация
Электролитическая диссоциация Таблица взаимодействия с металлами
Таблица взаимодействия с металлами Ионообменные материалы для сорбции биологически активных веществ
Ионообменные материалы для сорбции биологически активных веществ Фосфор. Открытие фосфора
Фосфор. Открытие фосфора Лекарственные растения и сырье, содержащие алкалоиды. (Лекция 15.1)
Лекарственные растения и сырье, содержащие алкалоиды. (Лекция 15.1) Нафта Походження,переробка, використання
Нафта Походження,переробка, використання  Процессы подготовки газа к транспорту
Процессы подготовки газа к транспорту Анализ карбоновых кислот и их производных
Анализ карбоновых кислот и их производных Азот қышқылы
Азот қышқылы Газохроматографический анализ летучих ядов
Газохроматографический анализ летучих ядов Способы получения металлов
Способы получения металлов Состав раствора количественно характеризуется величинами концентраций
Состав раствора количественно характеризуется величинами концентраций Дифузія у побуті
Дифузія у побуті Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Химия элементов семейства Fe Co Ni
Химия элементов семейства Fe Co Ni Хімічні зв’язки Алмакаева 8-Б
Хімічні зв’язки Алмакаева 8-Б  Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Расчет ректификационной колонны
Расчет ректификационной колонны Химические реакции с участием макромолекул
Химические реакции с участием макромолекул Презентация по Химии "Использование проектного метода при изучении химии" - скачать смотреть
Презентация по Химии "Использование проектного метода при изучении химии" - скачать смотреть  Презентация по Химии "Коррозия металлов" - скачать смотреть
Презентация по Химии "Коррозия металлов" - скачать смотреть  Презентация по Химии "Кругообіг Нітрогену" - скачать смотреть бесплатно
Презентация по Химии "Кругообіг Нітрогену" - скачать смотреть бесплатно Спирти. Класифікація спиртів
Спирти. Класифікація спиртів