Содержание
- 2. Количественный химический анализ – это определение количественного состава, т.е. установление количества химических элементов, ионов, атомов, атомных
- 3. Основоположник количественного анализа М.В. Ломоносов
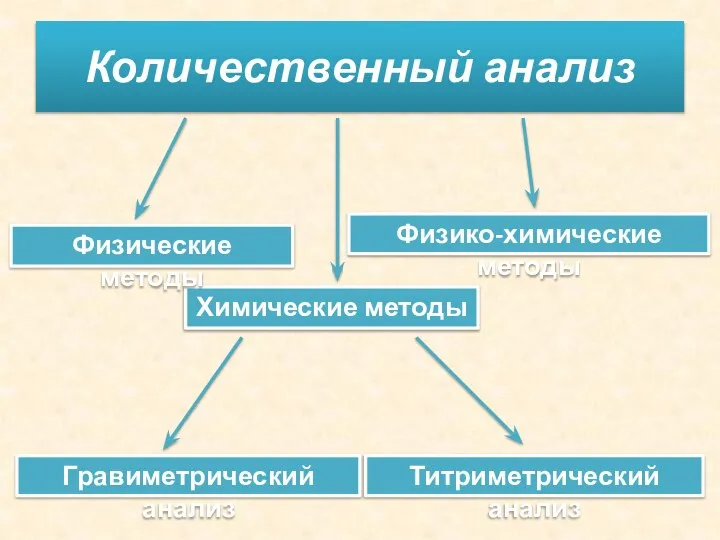
- 4. Количественный анализ Химические методы Физические методы Физико-химические методы Гравиметрический анализ Титриметрический анализ
- 5. Гравиметрический метод анализа Гравиметрическим анализом называют метод количественного химического анализа, который базируется на точном измерении массы
- 6. Титриметрический анализ – метод количественного химического анализа, который базируется на измерении точного объема раствора с точно
- 7. Раствор реагента точно известной концентрации, который применяется для титрования в методе, называют стандартным или титрованным раствором
- 8. Все вещества реагируют и образуются в эквивалентных соотношениях n1 = n2 C1V1 = C2V2 Закон эквивалентов
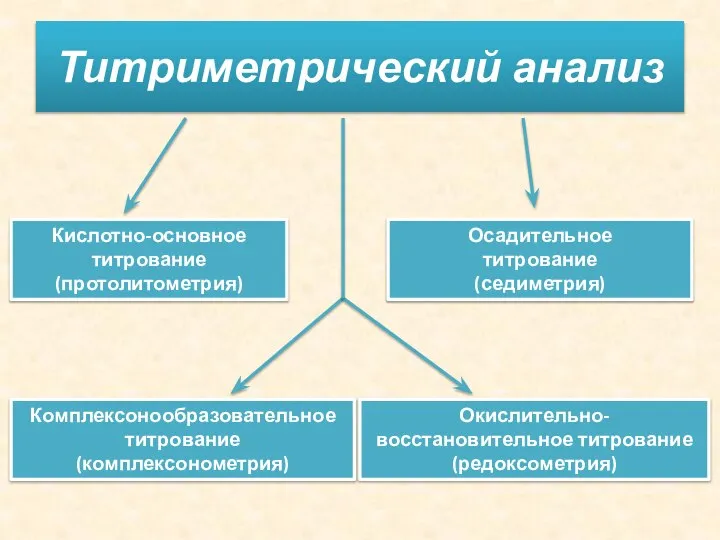
- 9. Титриметрический анализ Комплексонообразовательное титрование (комплексонометрия) Кислотно-основное титрование (протолитометрия) Окислительно-восстановительное титрование (редоксометрия) Осадительное титрование (седиметрия)
- 10. Требования к реакциям, которые используют в титриметрии: 1) Вещества, которые вступают в реакцию, должны реагировать в
- 11. Точка эквивалентности Момент, в который при титровании добавлено строго эквивалентное количество вещества, отвечающее стехиометрическому уравнению взаимодействия,
- 12. План конспекта 1) Что такое индикаторы? 2) Какие они бывают? 3) Для чего они нужны?
- 13. Домашнее задание Составить конспект на тему: «Измерительная посуда, используемая в титримерии»
- 15. Скачать презентацию










 Протолитическая теория кислот и оснований
Протолитическая теория кислот и оснований Презентация по Химии "«Закон сохранения массы вещества»" - скачать смотреть
Презентация по Химии "«Закон сохранения массы вещества»" - скачать смотреть  Презентация по Химии "«Кислоты" - скачать смотреть бесплатно
Презентация по Химии "«Кислоты" - скачать смотреть бесплатно Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Алканы в природе
Алканы в природе Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия"
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина «Биоорганическая химия" Химиялық кинетика және электрохимия
Химиялық кинетика және электрохимия Комплексные соединения
Комплексные соединения Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Презентация Спирты
Презентация Спирты Презентация по Химии "Викторина для любителей и знатков химии" - скачать смотреть
Презентация по Химии "Викторина для любителей и знатков химии" - скачать смотреть  Термодинамические возможности получения меди с применением программного комплекса АСТРА-4
Термодинамические возможности получения меди с применением программного комплекса АСТРА-4 Карбонильные соединения. Эфирные масла. Парфюмерия. Семинар 3. Индустрия красоты
Карбонильные соединения. Эфирные масла. Парфюмерия. Семинар 3. Индустрия красоты Классы неорганических соединений. Индивидуальные задания
Классы неорганических соединений. Индивидуальные задания Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Щелочно-земельные металлы
Щелочно-земельные металлы Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20)
Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20) АМОРФНЫЕ И НАНОКРИСТАЛЛИЧЕСКИЕ МЕТАЛЛЫ И СПЛАВЫ
АМОРФНЫЕ И НАНОКРИСТАЛЛИЧЕСКИЕ МЕТАЛЛЫ И СПЛАВЫ Применение эксклюзионной хроматографии в биологии
Применение эксклюзионной хроматографии в биологии Типы реакций 8 класс
Типы реакций 8 класс Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно
Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно Ферменты
Ферменты Соединения щелочных металлов
Соединения щелочных металлов Синтетические каучуки
Синтетические каучуки Химические свойства металлов
Химические свойства металлов Аттестационная работа. Формирование ИКТ-компетентности обучающихся посредством проектной деятельности по химии
Аттестационная работа. Формирование ИКТ-компетентности обучающихся посредством проектной деятельности по химии