Содержание
- 2. П Л А Н 7.1 Основные понятия химии комплексных соединений (КС). 7.2 Металло-лигандное равновесие в растворах.
- 3. 7.1 Комплексными (координационными) называют соединения, в структурных единицах которых число связей, образованных центральным атомом, превышает его
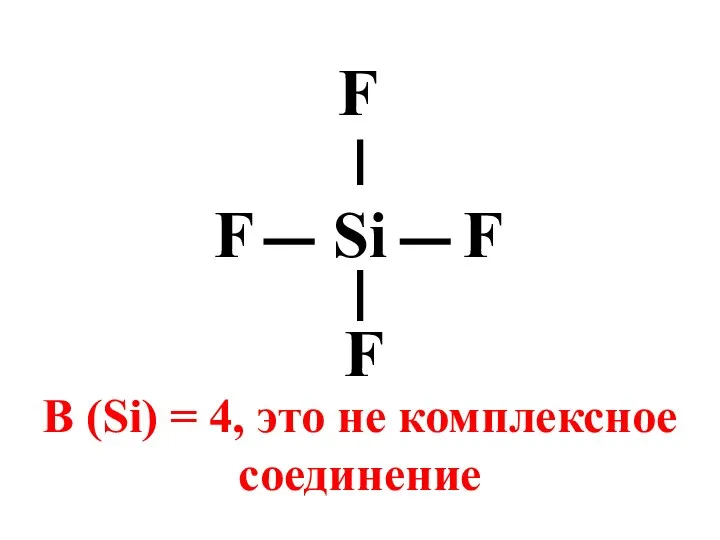
- 4. Si F F F F В (Si) = 4, это не комплексное соединение
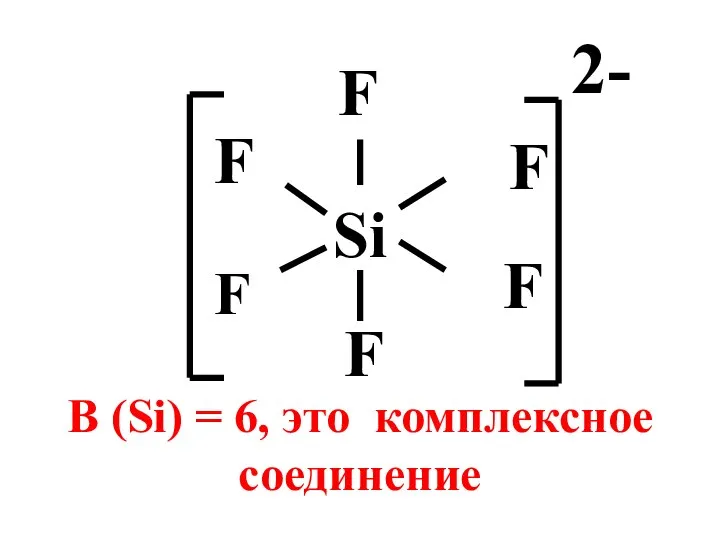
- 5. Si F F F F В (Si) = 6, это комплексное соединение F F 2-
- 6. Альфред Вернер 1866-1919 Швейцарский химик, выдвинувший и развивший координационную теорию строения комплексных соединений. Лауреат Нобелевской премии
- 7. Комплексные соединения состоят из: комплексообразователей (Ме, реже неметаллы: Si, P и др.); лигандов (ионов или полярных
- 8. лиганды [Fe(CO)5] комплексообразователь лиганды
- 9. Важнейшей характеристикой комплексообразователя является его координационное число (к.ч.), т.е. число связей, образованных им с лигандами.
- 10. Степень к.ч. окисления Ме + 1 2 + 2 4, 6 + 3 4, 6 +
- 11. Важнейшей характеристикой лиганда является его дентантность – число связей, образованных с комплексообразователем.
- 12. Классификация лигандов монодентантные лиганды: а) анионы: OH‾, H‾, F‾, Cl‾, Br‾, I‾, CN‾, CNS‾, NO2‾, NO3‾;
- 13. бидентантные лиганды а)анионы: SO42‾, C2O42‾, CO32‾; б)молекулы: NH2 – CH2 – CH2 – NH2 (этилендиамин) NH2
- 14. полидентантные лиганды. Важнейшими из них являются комплексоны – аминополикарбоновые кислоты и их соли.
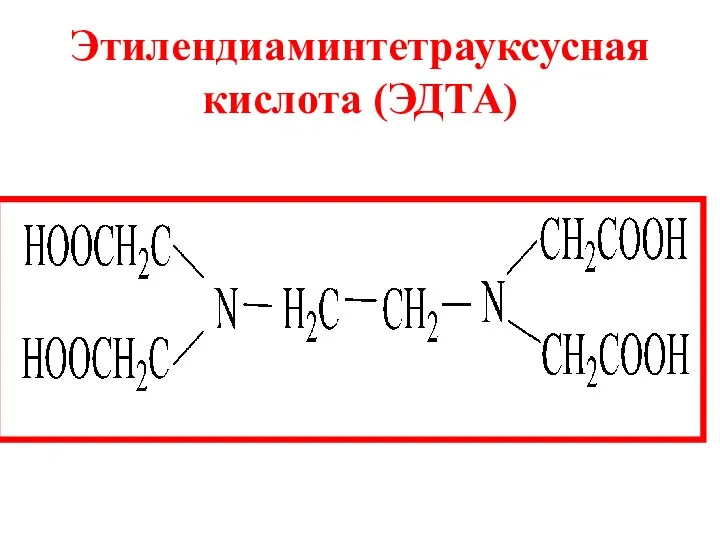
- 15. Этилендиаминтетрауксусная кислота (ЭДТА)
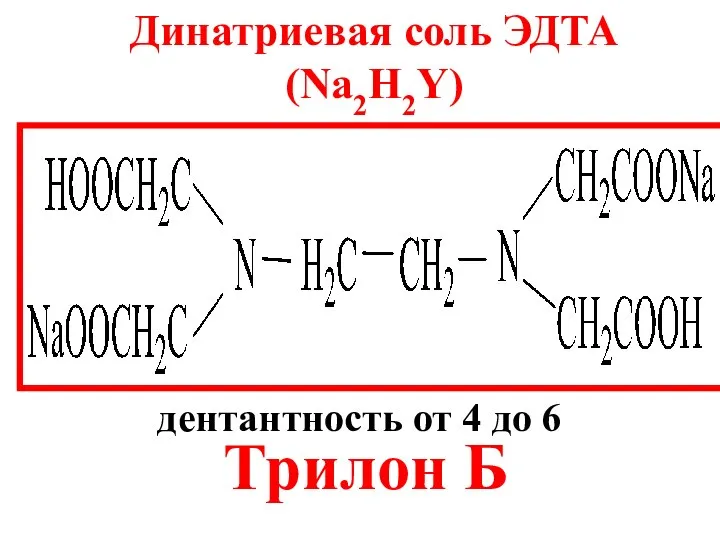
- 16. Динатриевая соль ЭДТА (Na2H2Y) Трилон Б дентантность от 4 до 6
- 17. по природе лигандов Классификация комплексных соединений 1)КС с монодентантными лигандами: аммиакаты [Cu(NH3)4]Cl2 аквакомплексы [Cu(H2O)4]SO4 гидроксокомплексы Na3[Al(OH)6]
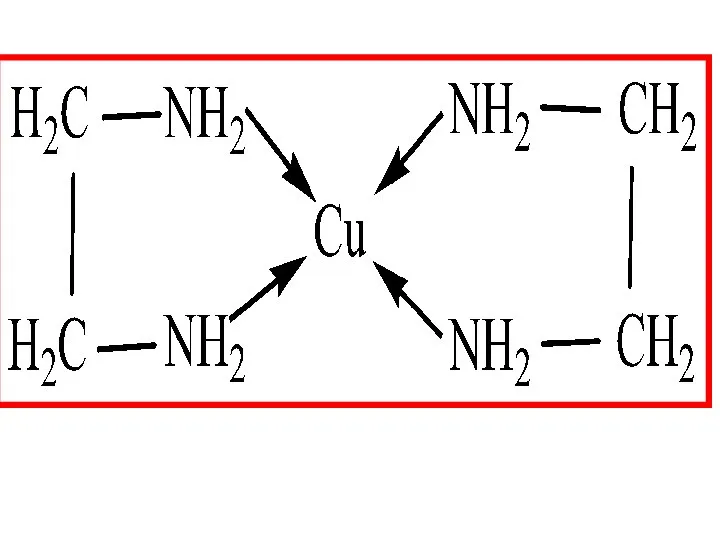
- 18. 2) КС с би- и полидентантными лигадами Особую группу составляют хелатные (клешневидные) комплексы, содержащие би- и
- 20. Наиболее устойчивыми хелатами являются внутрикомплексные соединения, в которых часть связей Me-Lig образованы по обменному, а часть
- 21. Тетацин Na2[CaY]
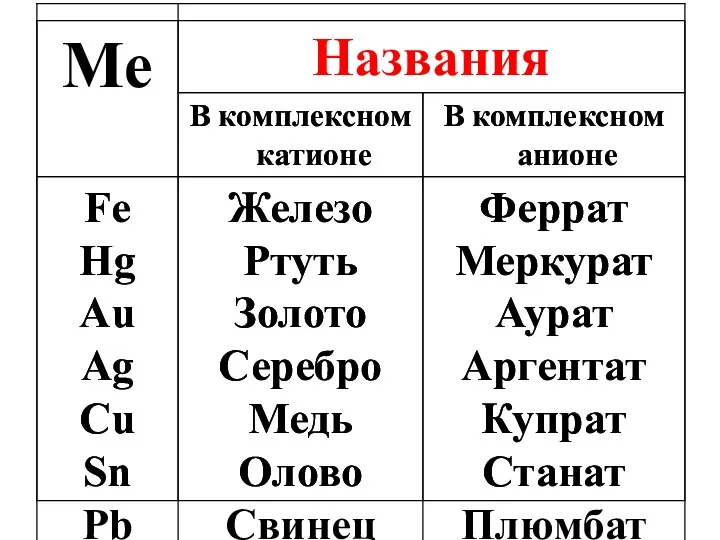
- 22. НОМЕНКЛАТУРА КС (1960, ИЮПАК) 1) вначале называют катионы, затем анионы. Названия комплексных анионов заканчиваются суффиксом –ат;
- 23. 2) В комплексном ионе сначала называют лиганды-анионы, затем лиганды-молекулы, затем лиганды-катионы: NH3 – аммин H2O –
- 24. Названия лигандов-анионов заканчиваются на – о: OH‾ –гидроксо NO2‾ – нитро NO3‾ –нитрато CN‾ – циано
- 26. Na3[Al(OH)6] натрий гексагидроксоалюминат [Cu(NH3)4]SO4 тетраамминмедь(II) сульфат NH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III) [Pt(NH3)2Cl2] дихлородиамминплатина
- 27. 7.2 Комплексные соединения Электролиты Неэлектролиты Кислоты Основания Соли H2[PtCl4] [Ag(NH3)2]OH [Pt(NH3)2Cl2] K4[Fe(CN)6]
- 28. Различают первичную (необратимую) диссоциацию: K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾ и вторичную (обратимую) диссоциацию КС: [Fe(CN)6]4‾
- 29. Константа равновесия, описывающая вторичную диссоциацию КС, называется константой нестойкости (Кн): Кн
- 30. Чем меньше Кн, тем устойчивее комплексное соединение [Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8 1,0∙10‾21 увеличение устойчивости КС
- 31. Устойчивости КС зависит от их строения: а) чем меньше ионный радиус комплексообразователя и больше его заряд,
- 32. s-Me p-Me d-Me Уменьшение ионных радиусов и увеличение комплексообразующей способности. Металлы d- блока являются лучшими комплексообразователями.
- 33. б) чем выше дентантность лиганда, тем устойчивее КС: КC Кн [Co(NH3)4]2+ 1,0·10‾5 [Co(Гли)2] 3,3∙10‾9 [CoY]2‾ 1,0∙10‾16
- 34. Самыми устойчивыми комплексными соединениями являются хелаты. Это явление получило название эффекта хелатирования.
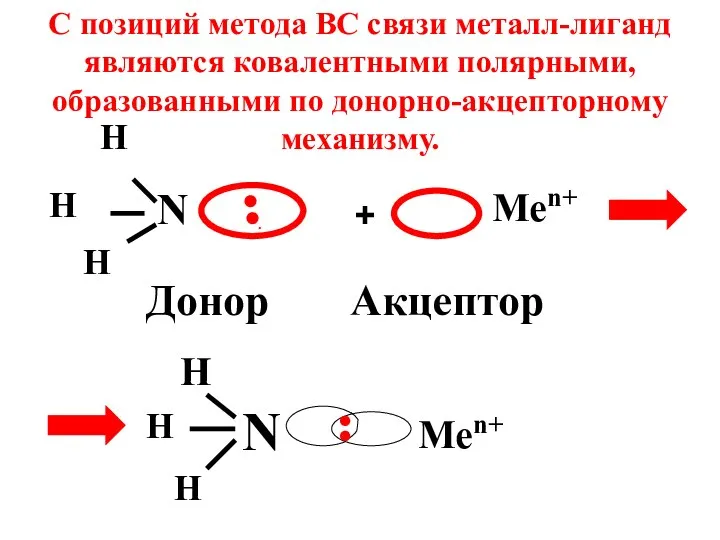
- 35. 7.3 Строение комплексных соединений описывается в рамках метода валентных связей (ВС) и с позиции теории кристаллического
- 36. N H H H .●● Донор + Men+ Акцептор N H H H Men+ С позиций
- 37. Конфигурация комплексного иона определяется типом гибридизации АО комплексообразователя.
- 38. К.ч. Тип гибридизации Конфигурация Примеры 2 sp Lig Lig ● [Ag(NH3)2]+ 4 sp3 [Zn(NH3)4]2+ Линейная Lig
- 39. К.ч. Тип гибридизации Конфигурация Примеры sp3d2 Lig Lig Lig Lig Lig Lig [CoF6]3- [Co(NH3)6]3+ Октаэдрическая
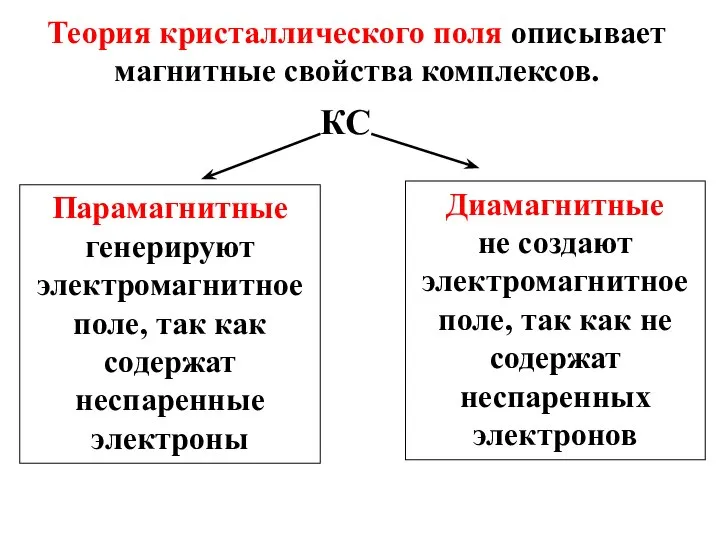
- 40. Теория кристаллического поля описывает магнитные свойства комплексов. КС Парамагнитные генерируют электромагнитное поле, так как содержат неспаренные
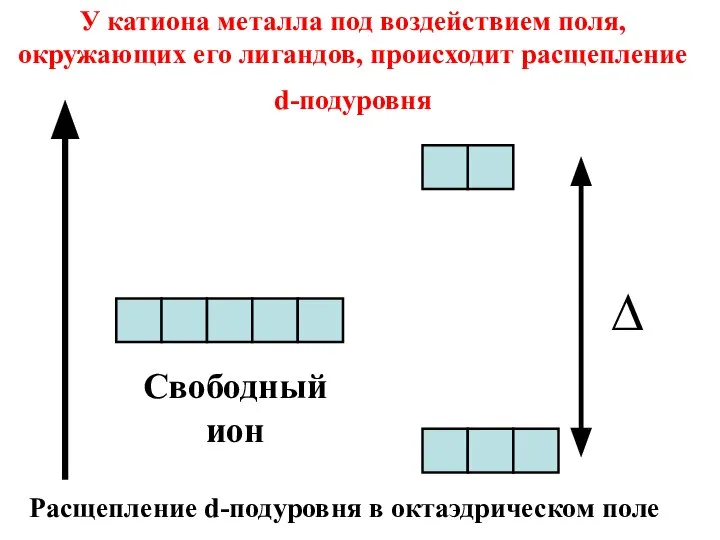
- 41. Свободный ион У катиона металла под воздействием поля, окружающих его лигандов, происходит расщепление d-подуровня ∆ Расщепление
- 42. Величина энергии расщепления (∆) зависит от природы лиганда. Спектрохимический ряд лигандов I‾,Cl‾,F‾, OH‾,H2O,CNS‾, NH3,NO2‾, CN‾ Слабые
- 43. В поле слабых лигандов энергия расщепления (∆) не велика, поэтому электроны равномерно распределяются на всех d-орбиталях
- 44. В поле сильных лигандов энергия расщепления (∆) имеет большое значение, в следствие чего первыми заполняются d-орбитали
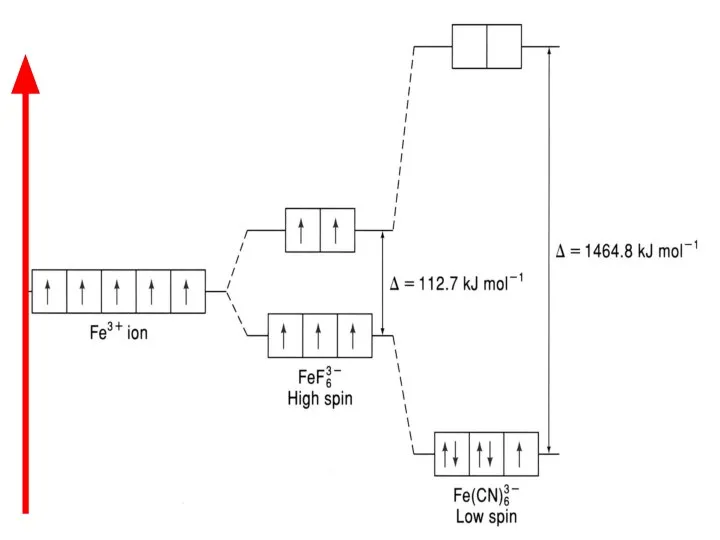
- 45. Пример: [FeF6]3‾ [Fe(CN)6] х – 6 = – 3 х = + 3 х -1 х
- 46. Координационное число Fe3+ равно 6, так как он связан с шестью монодентантными лигандами. Оба комплексных иона
- 48. Ион [FeF6]3- парамагнитен, так как содержит неспаренные электроны на внешнем уровне (высокоспиновый комплекс). Ион [Fe(СN)6] диамагнитен,
- 49. 7.4 В организме человека все металлы, кроме щелочных и, частично, щелочноземельных находятся в виде прочных хелатных
- 50. Важнейшими являются комплексы с белками. К ним относятся многочисленные металлоферменты, а так же гемоглобин (комплекс железа
- 51. В организме непрерывно происходит образование и разрушение комплексов, состоящих из катионов металлов и биолигандов. Обмен с
- 52. Нарушение сложившегося равновесия ведет к ряду патологических явлений: металлоизбыточным и металлодефицитным состояниям.
- 53. При недостатке железа – анемия, при его избытке – сидероз. Недостаток кальция приводит к остеопорозу, а
- 54. По данным ВОЗ дефицит железа в организме человека является одной из наиболее серьезных проблем современности. На
- 55. Выведение ионов тяжелых металлов из организма под действием хелатирующих лигандов называется хелатотерапией. Тетацин применяется как лекарственный
- 56. Комплексоны применяются для лечения мочекаменной болезни CaC2O4 + Na2H2Y ⮀ ⮀[CaY]2‾ + Na2C2O4 + + 2
- 57. Комплексы Pt используются как противоопухолевые препараты. Например, соль Пейроне [Pt(NH3)2Cl2] (синтезирована в 1850, используется как препарат
- 58. Комплексы Au применяют для лечения артритов и туберкулеза Na3[Au(S2O3)2].
- 59. Строение, свойства и биологическая роль КС металлов с биолигандами является объектом изучения бионеорганической химии, возникшей в
- 61. Скачать презентацию




![лиганды [Fe(CO)5] комплексообразователь лиганды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-7.jpg)









![Тетацин Na2[CaY]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-20.jpg)



![Na3[Al(OH)6] натрий гексагидроксоалюминат [Cu(NH3)4]SO4 тетраамминмедь(II) сульфат NH4[Co(NH3)2(NO2)4] аммоний тетранитродиамминкобальтат(III) [Pt(NH3)2Cl2] дихлородиамминплатина](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-25.jpg)
![7.2 Комплексные соединения Электролиты Неэлектролиты Кислоты Основания Соли H2[PtCl4] [Ag(NH3)2]OH [Pt(NH3)2Cl2] K4[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-26.jpg)
![Различают первичную (необратимую) диссоциацию: K4[Fe(CN)6] → 4 K+ + [Fe(CN)6]4‾ и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-27.jpg)

![Чем меньше Кн, тем устойчивее комплексное соединение [Ag(NO2)2]‾ [Ag(NH3)2]+ [Ag(CN)2]‾ 1,3∙10‾3 6,8·10‾8 1,0∙10‾21 увеличение устойчивости КС](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-29.jpg)


![б) чем выше дентантность лиганда, тем устойчивее КС: КC Кн [Co(NH3)4]2+ 1,0·10‾5 [Co(Гли)2] 3,3∙10‾9 [CoY]2‾ 1,0∙10‾16](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-32.jpg)



![К.ч. Тип гибридизации Конфигурация Примеры 2 sp Lig Lig ● [Ag(NH3)2]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-37.jpg)
![К.ч. Тип гибридизации Конфигурация Примеры sp3d2 Lig Lig Lig Lig Lig Lig [CoF6]3- [Co(NH3)6]3+ Октаэдрическая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-38.jpg)



![Пример: [FeF6]3‾ [Fe(CN)6] х – 6 = – 3 х =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-44.jpg)

![Ион [FeF6]3- парамагнитен, так как содержит неспаренные электроны на внешнем уровне](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-47.jpg)







![Комплексоны применяются для лечения мочекаменной болезни CaC2O4 + Na2H2Y ⮀ ⮀[CaY]2‾](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-55.jpg)
![Комплексы Pt используются как противоопухолевые препараты. Например, соль Пейроне [Pt(NH3)2Cl2] (синтезирована](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-56.jpg)
![Комплексы Au применяют для лечения артритов и туберкулеза Na3[Au(S2O3)2].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405624/slide-57.jpg)

 Презентация по Химии "Презентация Теория строения органических веществ А.М. Бутлерова" - скачать смотреть
Презентация по Химии "Презентация Теория строения органических веществ А.М. Бутлерова" - скачать смотреть  Закон постоянства состава вещества
Закон постоянства состава вещества Карбоновые кислоты
Карбоновые кислоты Титан. Структура, применение, свойства (11 класс)
Титан. Структура, применение, свойства (11 класс) Современные тенденции развития химии
Современные тенденции развития химии Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн Автор учитель МОУ СОШ №3 города Волгореченска Звёздочкина С.А.
Автор учитель МОУ СОШ №3 города Волгореченска Звёздочкина С.А.  Общие свойства металлов
Общие свойства металлов Investigation of the conditions for the synthesis of a silver - containing composite
Investigation of the conditions for the synthesis of a silver - containing composite Химические реакции (11 класс)
Химические реакции (11 класс) Идеи и прогнозы Д. И. Менделеева в области улучшения плодородия почв.
Идеи и прогнозы Д. И. Менделеева в области улучшения плодородия почв. Железо. Электронное строение железа
Железо. Электронное строение железа Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность Сахарное производство Автор: Чунихина Елена Ивановна, учитель химии.
Сахарное производство Автор: Чунихина Елена Ивановна, учитель химии. Устройство лабораторного штатива
Устройство лабораторного штатива Д.І.Менделєєв Визначні дати в його житті.
Д.І.Менделєєв Визначні дати в його житті.  Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики
Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики Простейшие операции с веществом (химический практикум)
Простейшие операции с веществом (химический практикум) Азотная кислота и ее соли - нитраты
Азотная кислота и ее соли - нитраты Теория химического строения А. М. Бутлерова. Часть II. Раздел 2
Теория химического строения А. М. Бутлерова. Часть II. Раздел 2 Взаимосвязь обмена веществ
Взаимосвязь обмена веществ Химическая связь. Метод молекулярных орбиталей
Химическая связь. Метод молекулярных орбиталей Алкилирование. Понятие
Алкилирование. Понятие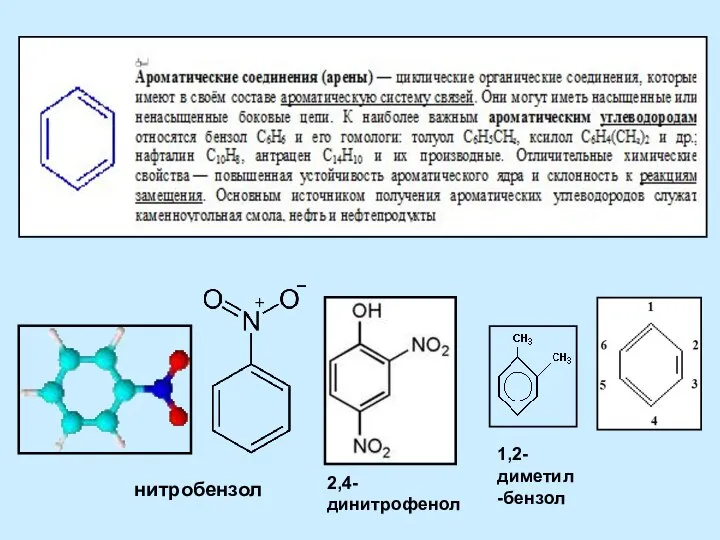 Ароматические соединения (арены)
Ароматические соединения (арены) Кристаллические и аморфные тела
Кристаллические и аморфные тела Физические и химические свойства алкенов. 10 класс
Физические и химические свойства алкенов. 10 класс