Содержание
- 2. Содержание
- 3. в восковых покрытиях листьев, цветов и семян растений, входят в состав пчелиного воска встречаются в природе
- 4. Среди животных алканы встречаются в качестве ферромонов у насекомых - муха цеце (C18H38, C39H80, C40H82). Некоторые
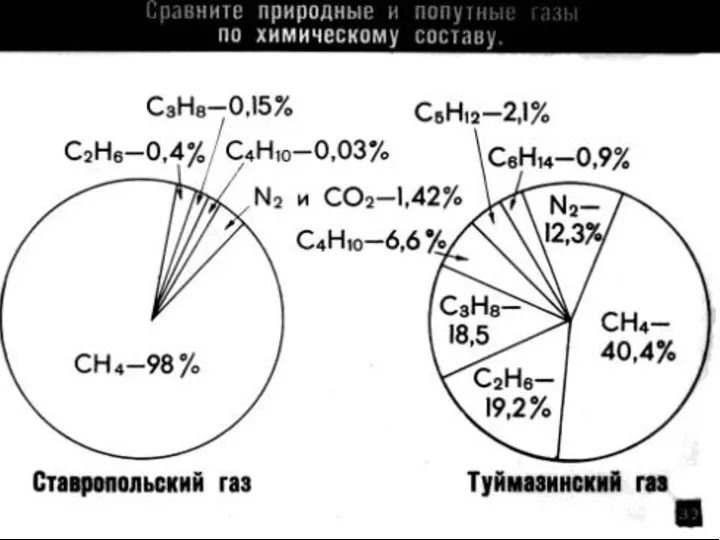
- 5. Накапливается в каменноугольных шахтах, содержится в природном газе и в попутных нефтяных газах. Метан образуется в
- 7. Метан и этан содержатся в атмосфере планет Солнечной системы: на Юпитере, Сатурне, Уране, Нептуне. Метан найден
- 9. Применение алканов 1-3 – производство сажи 1 – картрижи 2 – резина 3 – типографическая краска
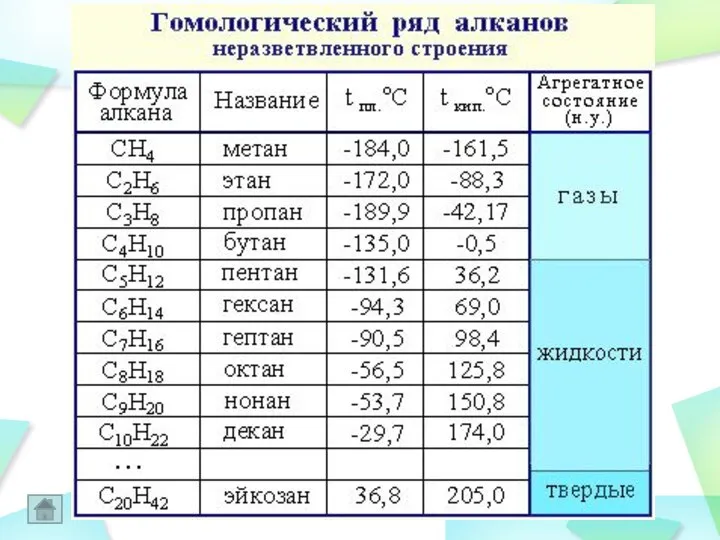
- 10. Алканы, парафины , предельные , насыщенные УВ. лат. parrum affinis имеющий мало сродства, малоактивный. алифатические (ациклические)
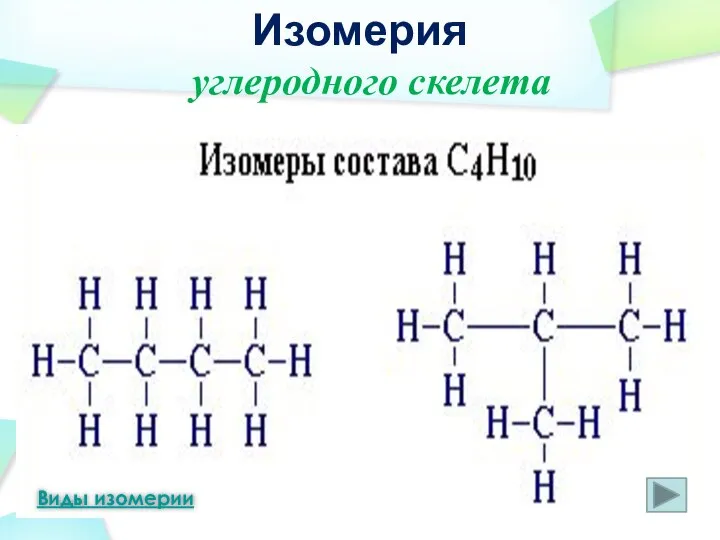
- 12. Шаростержневая модель молекулы бутана Шаростержневая модель молекулы изобутана Изомерия Виды изомерии углеродного скелета
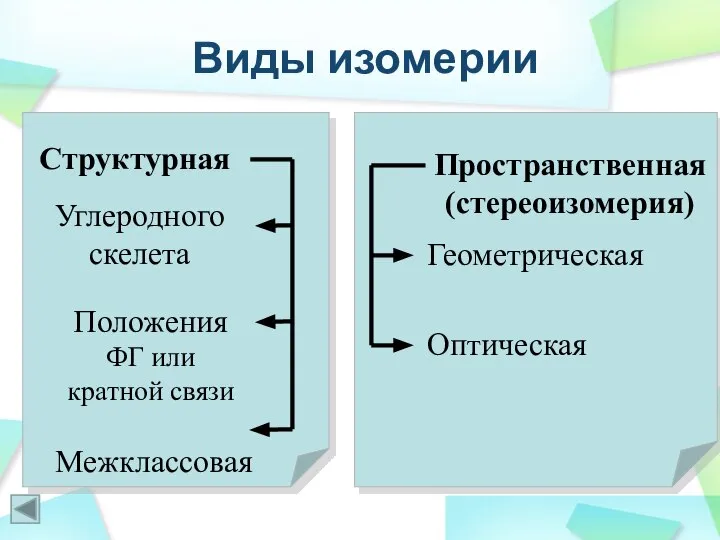
- 13. Виды изомерии
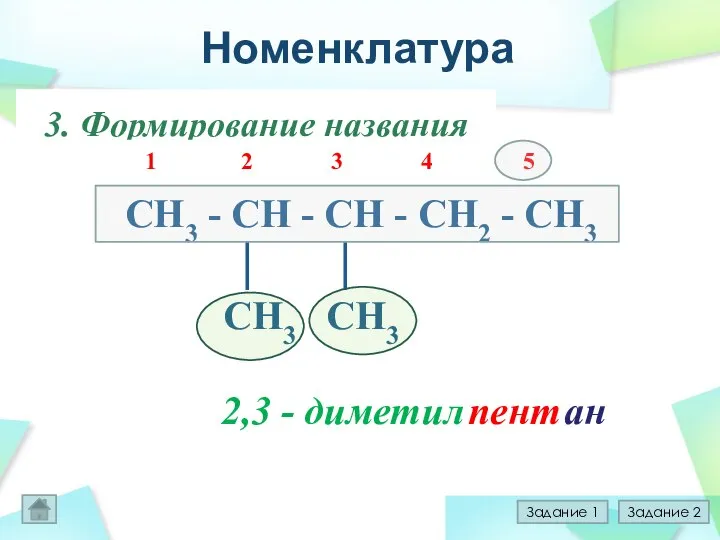
- 14. Номенклатура 1.Выбор главной цепи CH3 - CH - CH - СН2 - CH3 │ │ CH3
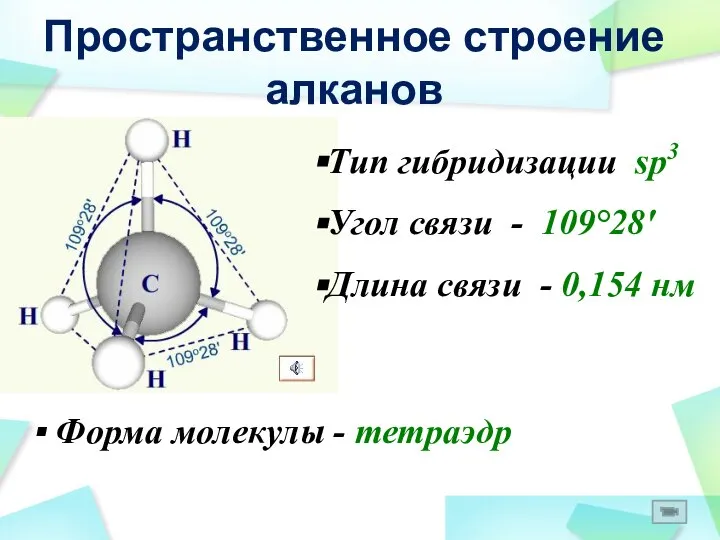
- 16. Пространственное строение алканов Тип гибридизации sp3 Угол связи - 109°28' Форма молекулы - тетраэдр Длина связи
- 17. Схема образования химических связей в молекуле этана
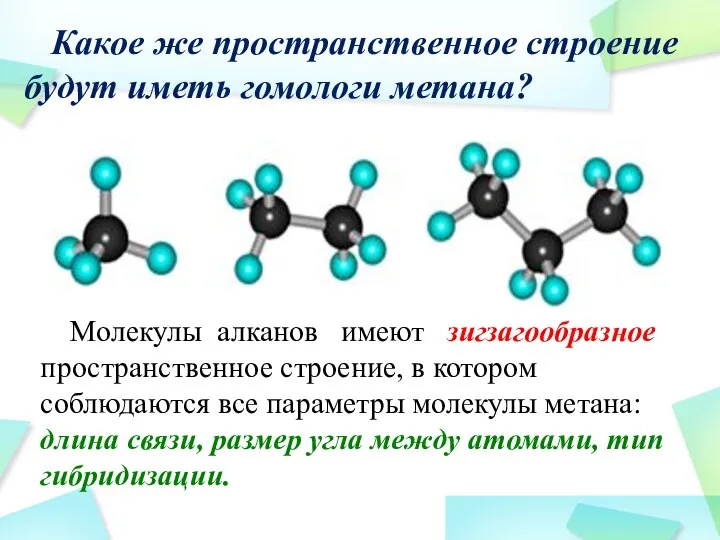
- 18. Какое же пространственное строение будут иметь гомологи метана? Молекулы алканов имеют зигзагообразное пространственное строение, в котором
- 19. Модели молекул этана и бутана
- 21. Вывод: Алканы при обычных условиях инертны Реакции возможны только в жестких условиях Вступают в реакции замещения,
- 22. Химические свойства Реакция замещения Реакция отщепления (элиминирования) Реакция окисления Реакция изомеризация
- 23. Реакции замещения 1. Галогенирование C H4 + Cl2 hv→ CH3Cl + HCl C H3Cl + Cl2
- 24. 1.Галогенирование начинается только под действием инициатора радикальных реакций (УФ-свет, радикальные реагенты, нагревание) 2.Реакционная способность в ряду
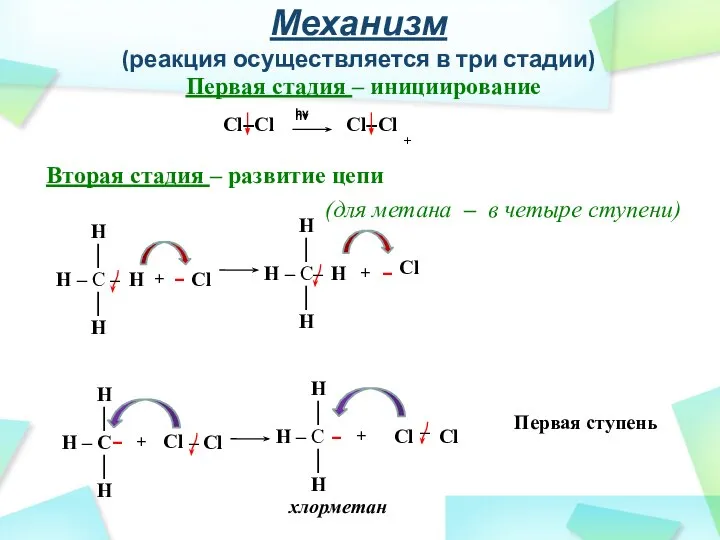
- 25. + Механизм (реакция осуществляется в три стадии) Первая стадия – инициирование Вторая стадия – развитие цепи
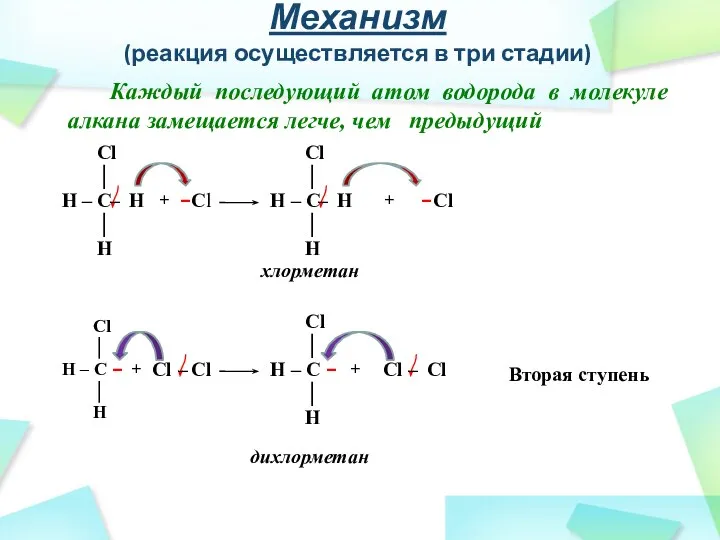
- 26. Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем
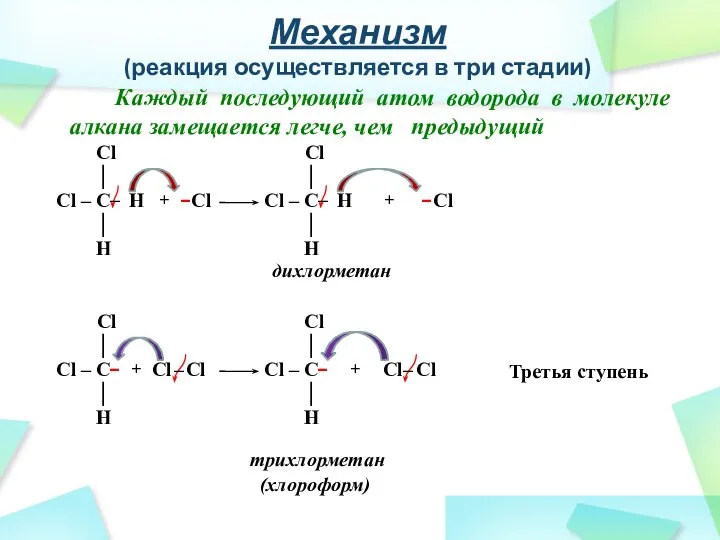
- 27. Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем
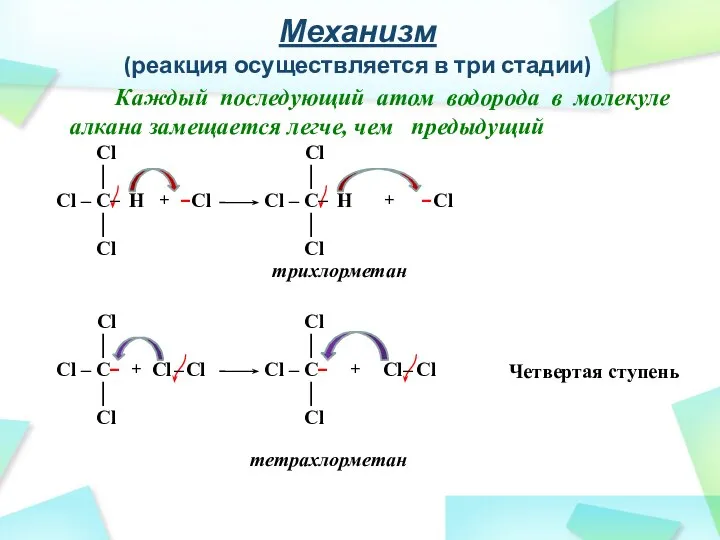
- 28. Механизм (реакция осуществляется в три стадии) Каждый последующий атом водорода в молекуле алкана замещается легче, чем
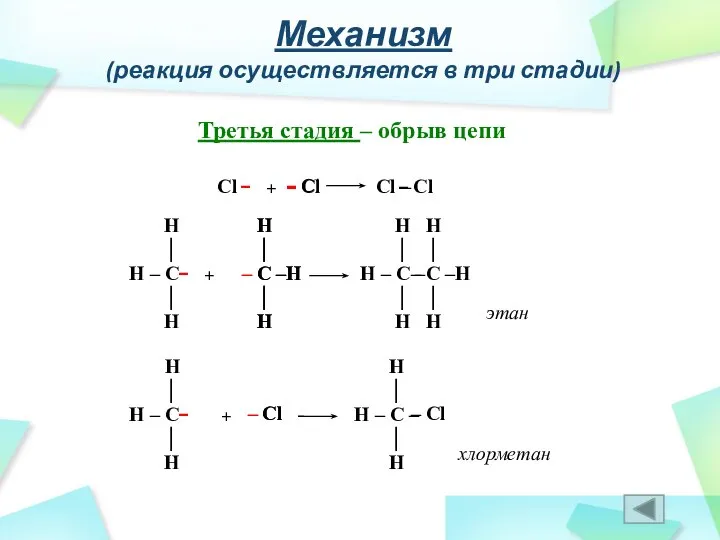
- 29. Механизм (реакция осуществляется в три стадии) Третья стадия – обрыв цепи Cl – Cl + Cl
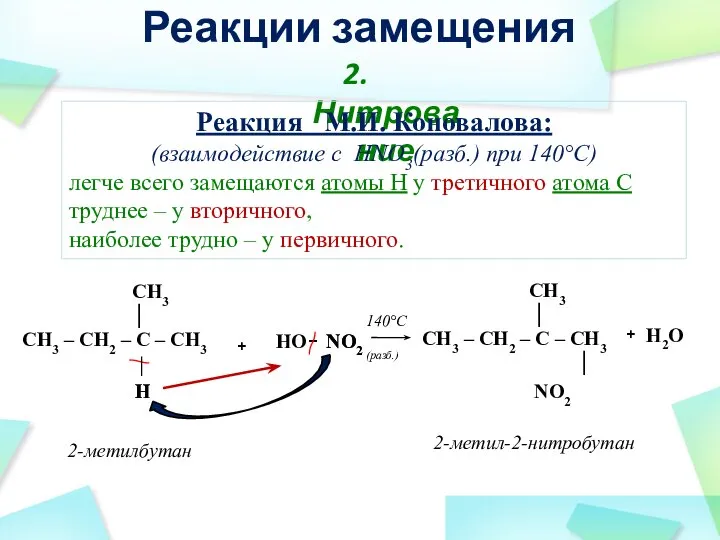
- 30. H + H2O + 2-метил-2-нитробутан 2-метилбутан CH3 │ CH3 – CH2 – C – CH3 │
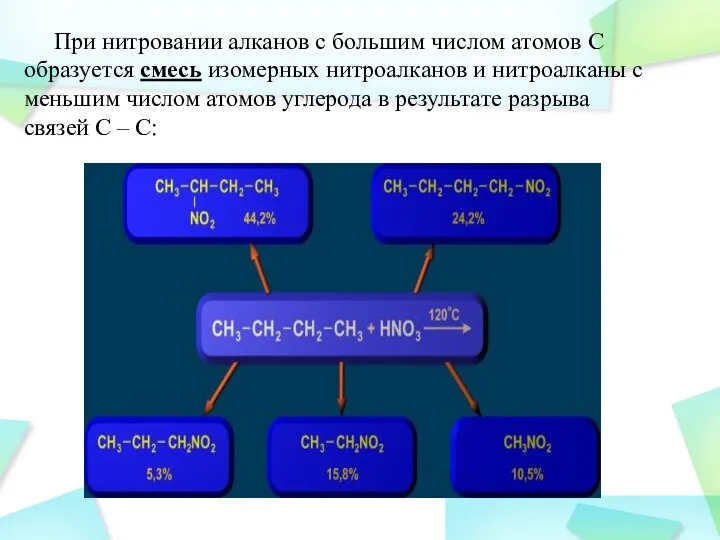
- 31. При нитровании алканов с большим числом атомов С образуется смесь изомерных нитроалканов и нитроалканы с меньшим
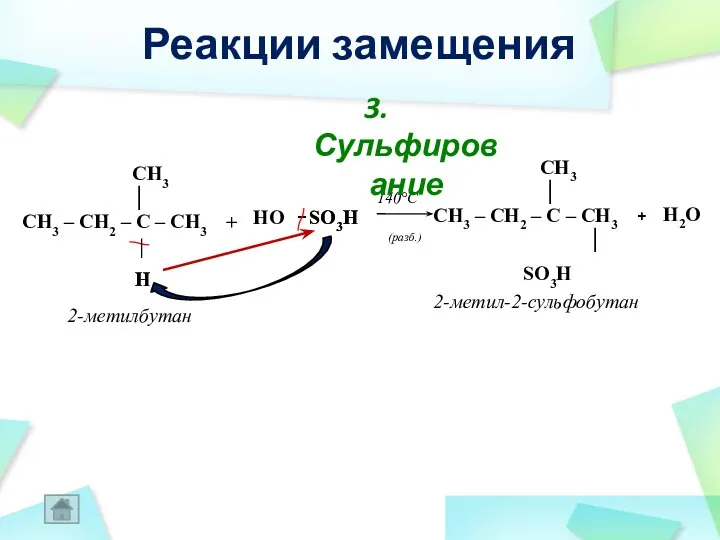
- 32. H + H2O + 2-метил-2-сульфобутан 2-метилбутан CH3 │ CH3 – CH2 – C – CH3 │
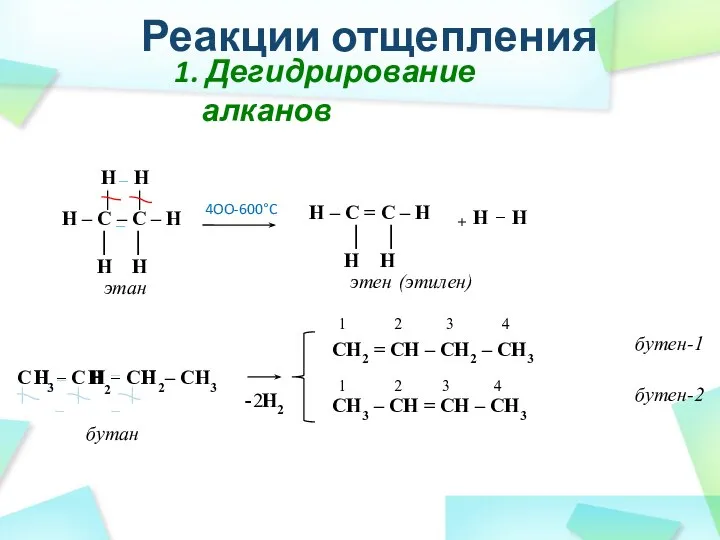
- 33. C C C – CH3 2 1. Дегидрирование алканов CH2 = CH – CH2 – CH3
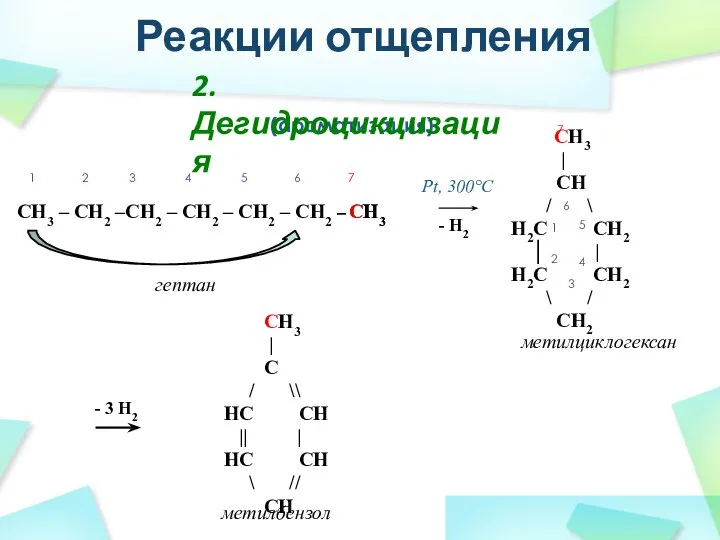
- 34. Реакции отщепления (ароматизация) CH3 – CH2 –CH2 – CH2 – CH2 – CH2 – Pt, 300°C
- 35. а) Полное разложение б) Неполный пиролиз 2CH4 этин (ацетилен) метан 1000°C CH4 1200°C C +2 Н2
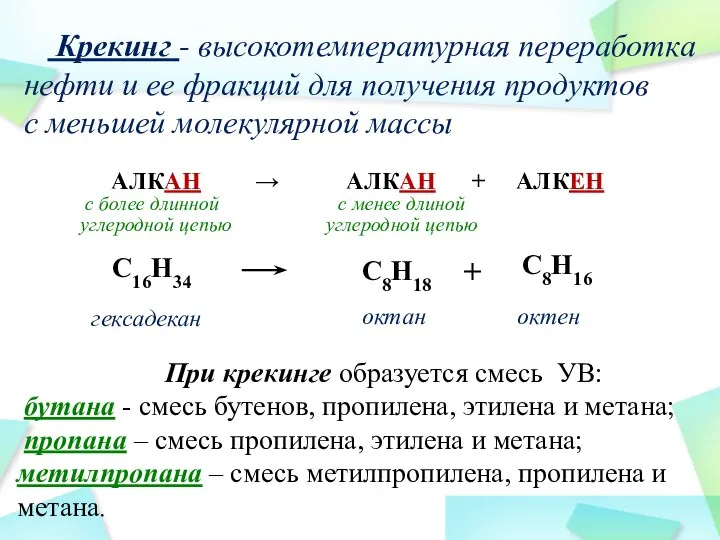
- 36. C16H34 C8H18 + C8H16 гексадекан октан октен При крекинге образуется смесь УВ: бутана - смесь бутенов,
- 37. Крекинг бутана В.Г. Шухов (1891) Температура – 470—650°С; Давление – 7 МПа
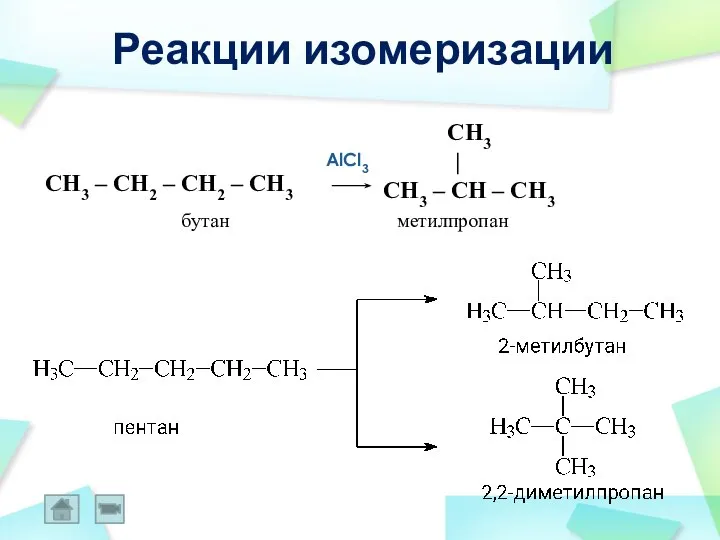
- 38. Реакции изомеризации AlCl3 CH3 | CH3 – CH – CH3 CH3 – CH2 – CH2 –
- 39. Реакции окисления CH4 + 2О2 (при сильном недостатке кислорода) (при недостатке кислорода) 2 CO + 4
- 40. При обычных условиях алканы устойчивы к действию окислителей При каталитическом окислении из алканов получают кислородосодержащие органические
- 41. Получение алканов Выделение УВ из природного сырья Синтез Вюрца Декарбоксилирование натриевых солей карбоновых кислот Гидрирование циклоалканов
- 42. Выделение УВ из природного сырья Основной способ получения алканов это разделение различных фракций нефти. Нефть –
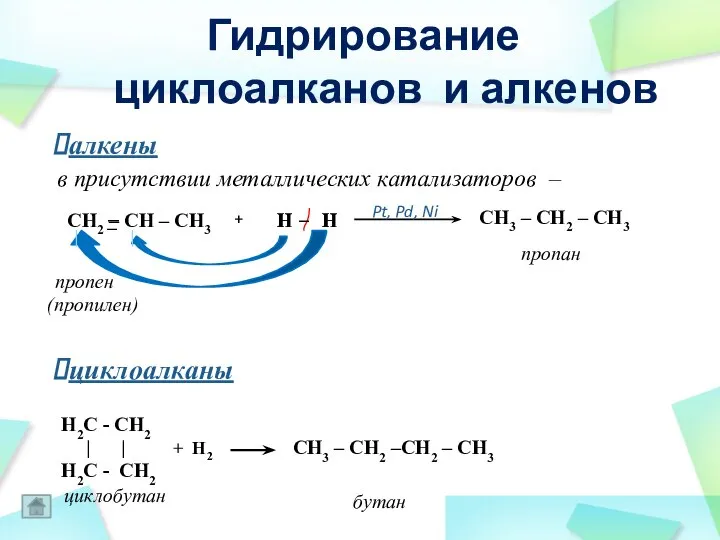
- 43. Гидрирование циклоалканов и алкенов пропан CH3 – CH2 – CH3 CH2 – CH – CH3 –
- 44. (взаимодействие галогеналканов с активными металлами) Проводят с целью получения алканов с более длинной углеродной цепью Если
- 45. Декарбоксилирование натриевых солей карбоновых кислот (реакция Дюма ) при сплавлении солей карбоновых кислот со щелочью: R-COONa
- 47. Скачать презентацию























 Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей Основы химической кинетики
Основы химической кинетики Хром. Использование хрома
Хром. Использование хрома Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика Теорія взаємного впливу атомів у молекулах органічних речовин
Теорія взаємного впливу атомів у молекулах органічних речовин Распределение электронов в атомах. Энергетические уровни
Распределение электронов в атомах. Энергетические уровни Реакции ионного обмена
Реакции ионного обмена Аффинная хроматография
Аффинная хроматография Металеві властивості феруму
Металеві властивості феруму Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ
Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ  Минералогия. Оксиды
Минералогия. Оксиды Робота учня 11-В класу: Андрійка Андрія
Робота учня 11-В класу: Андрійка Андрія  Решение задач Скорость химических реакций 11 класс
Решение задач Скорость химических реакций 11 класс  Соединения железа
Соединения железа Биологически активные гетероциклические соединения. Нуклеиновые кислоты
Биологически активные гетероциклические соединения. Нуклеиновые кислоты Марки бензина
Марки бензина Презентация по химии Карбоновые кислоты и их производные
Презентация по химии Карбоновые кислоты и их производные  Основные сведения о строении атома
Основные сведения о строении атома Химия вокруг нас
Химия вокруг нас Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Классы неорганических веществ
Классы неорганических веществ Сопряжение электронной плотности, как фактор обеспечения стабильности молекул
Сопряжение электронной плотности, как фактор обеспечения стабильности молекул Железы внутренней секреции
Железы внутренней секреции  Решение расчётных задач
Решение расчётных задач Осадочные породы. (Лекция 9.2)
Осадочные породы. (Лекция 9.2) VI группа периодической системы Д.И. Менделеева
VI группа периодической системы Д.И. Менделеева Стартап. Производство минерального удобрения
Стартап. Производство минерального удобрения