Содержание
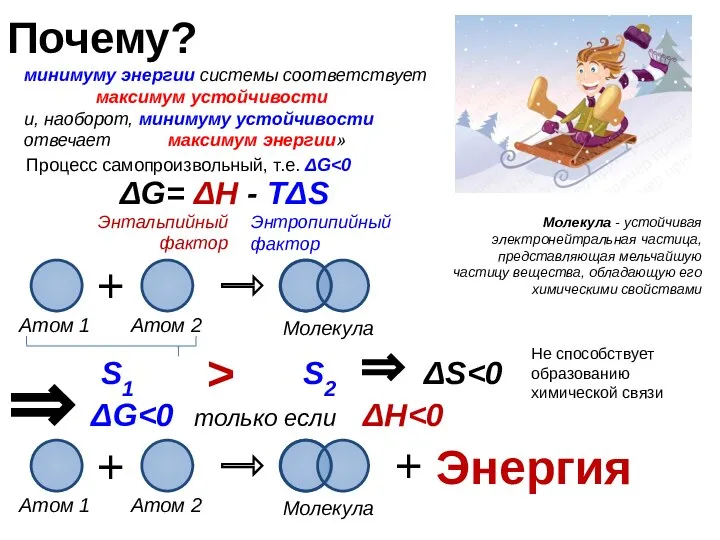
- 2. Почему? минимуму энергии системы соответствует максимум устойчивости и, наоборот, минимуму устойчивости отвечает максимум энергии» Атом 1
- 3. Химическая связь… ХИМИЧЕСКАЯ СВЯЗЬ это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной
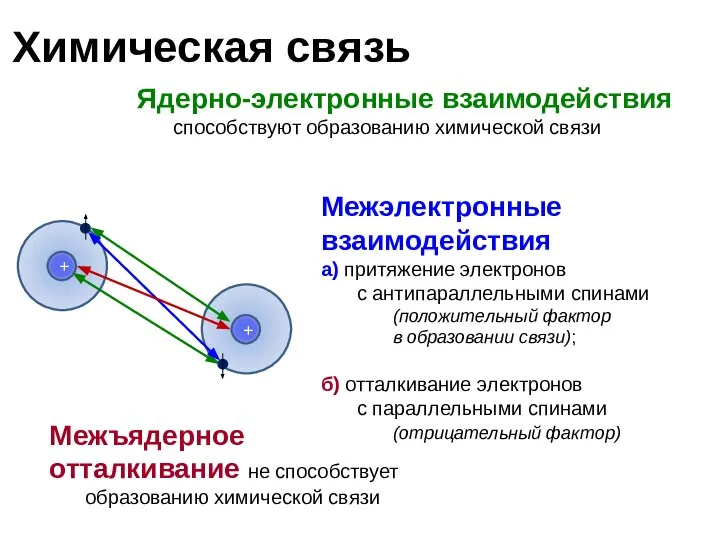
- 4. Химическая связь Ядерно-электронные взаимодействия способствуют образованию химической связи Межэлектронные взаимодействия а) притяжение электронов с антипараллельными спинами
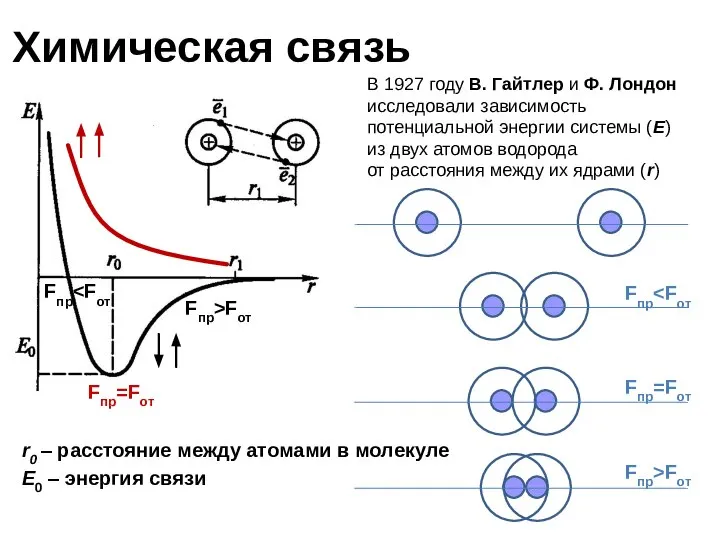
- 5. Химическая связь r0 – расстояние между атомами в молекуле E0 – энергия связи В 1927 году
- 6. Химическая связь Длина связи (r) – межъядерное расстояние взаимодействующих атомов Зависит от размеров электронных оболочек и
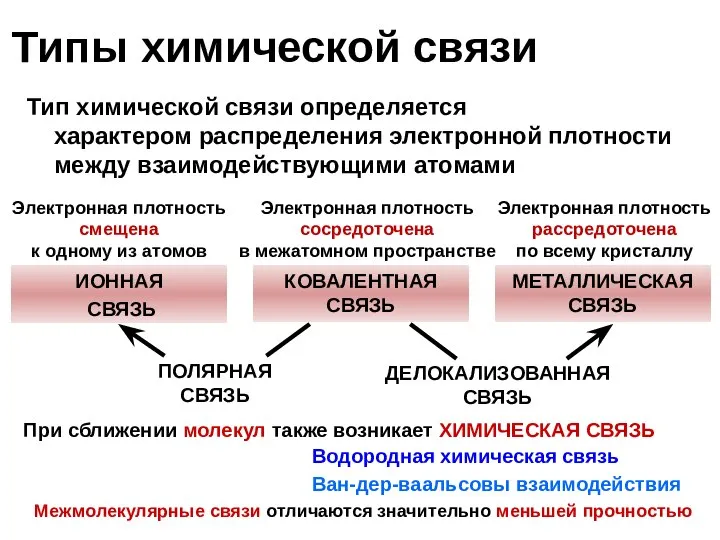
- 7. ИОННАЯ СВЯЗЬ КОВАЛЕНТНАЯ СВЯЗЬ МЕТАЛЛИЧЕСКАЯ СВЯЗЬ ПОЛЯРНАЯ СВЯЗЬ ДЕЛОКАЛИЗОВАННАЯ СВЯЗЬ Межмолекулярные связи отличаются значительно меньшей прочностью
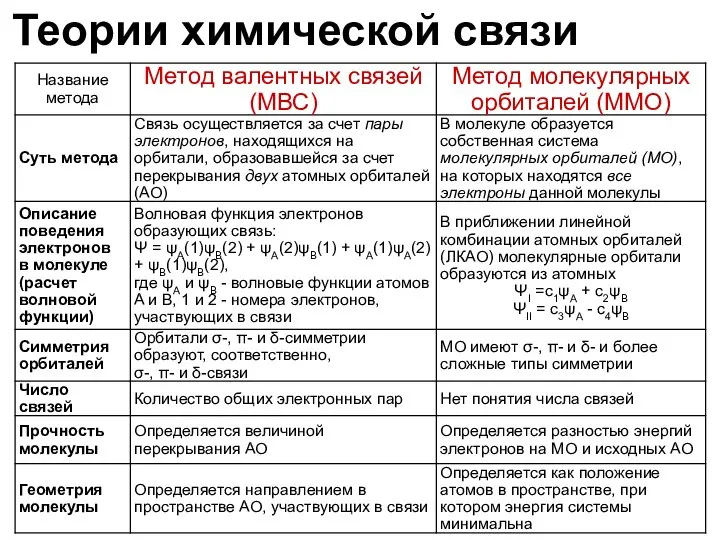
- 8. Теории химической связи Метод валентных связей (ВС) Метод молекулярных орбиталей (ММО) Представления о многоцентровых делокализованных связях
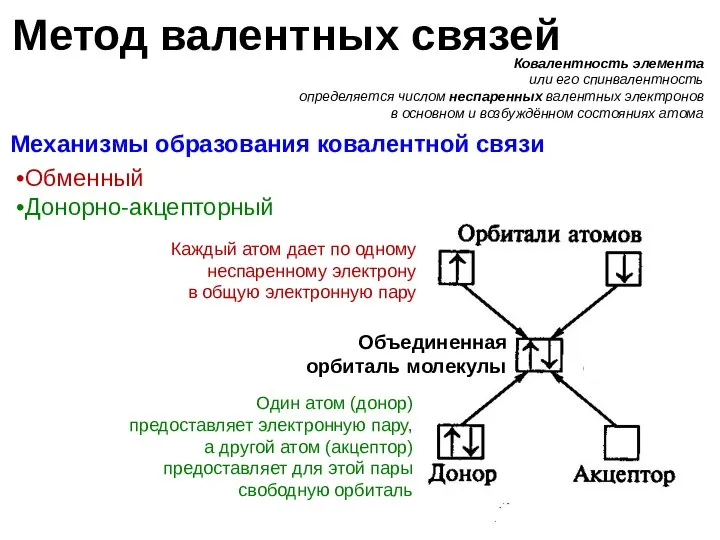
- 9. Метод валентных связей Химическая связь между атомами образуется в результате обобществления валентных электронов, т.е. образования общих
- 10. Метод валентных связей Ковалентность элемента или его спинвалентность определяется числом неспаренных валентных электронов в основном и
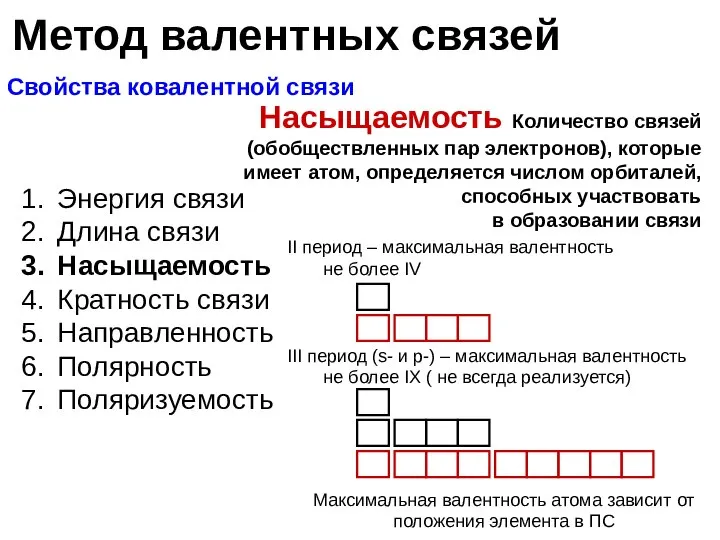
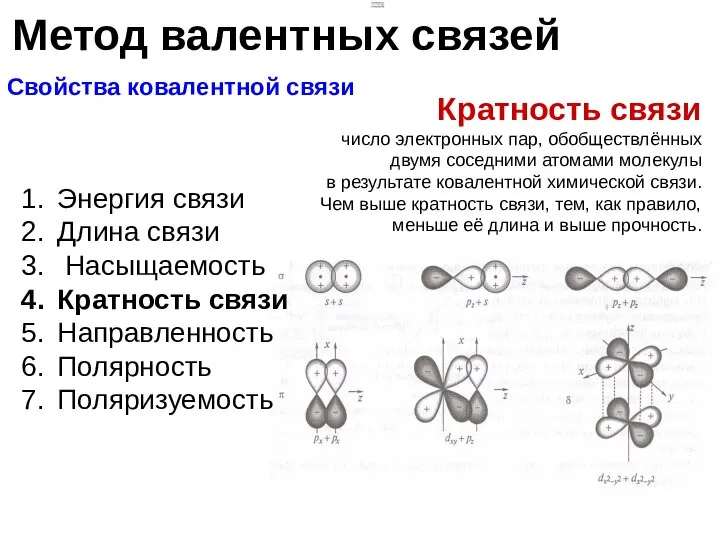
- 11. Метод валентных связей Свойства ковалентной связи Энергия связи Длина связи Насыщаемость Кратность связи Направленность Полярность Поляризуемость
- 12. Метод валентных связей Свойства ковалентной связи Энергия связи Длина связи Насыщаемость Кратность связи Направленность Полярность Поляризуемость
- 13. Метод валентных связей Свойства ковалентной связи Энергия связи Длина связи Кратность связи Насыщаемость Направленность Полярность Поляризуемость
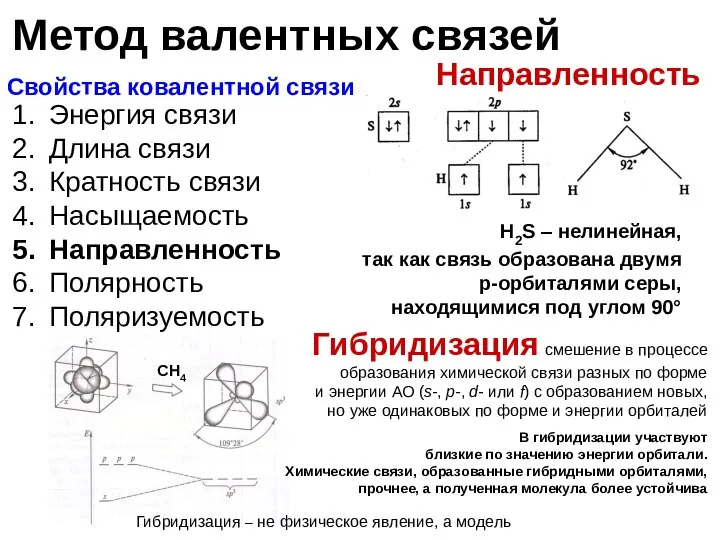
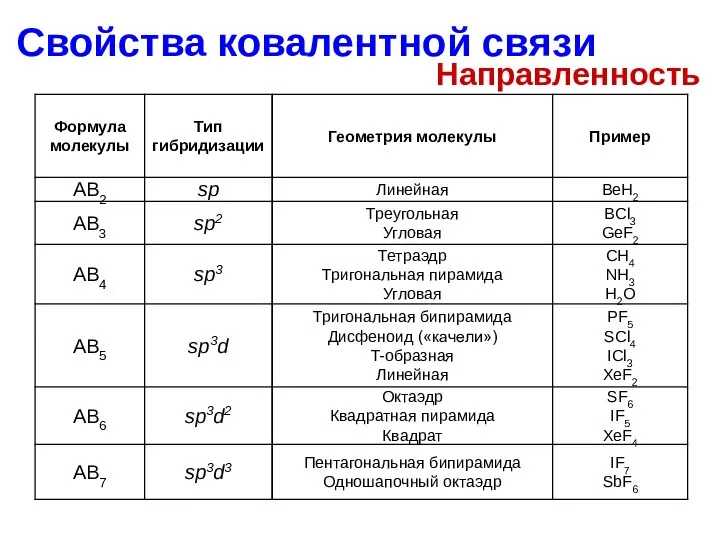
- 14. Свойства ковалентной связи Направленность
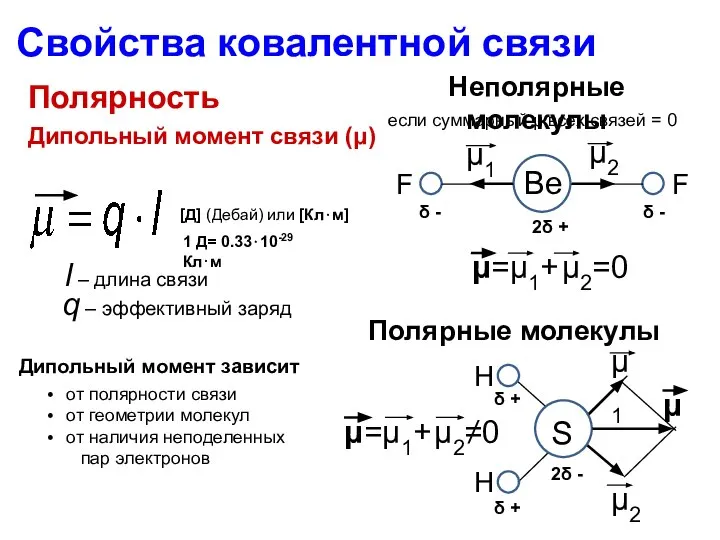
- 15. Энергия связи Длина связи Кратность связи Насыщаемость Направленность Полярность Поляризуемость Полярность определяется степенью перекрывания орбиталей Свойства
- 16. Полярность Свойства ковалентной связи Степень ионности связи + - H Cl Смещение электронной плотности к более
- 17. Полярность Свойства ковалентной связи Дипольный момент связи (μ) l – длина связи q – эффективный заряд
- 18. Поляризуемость или динамическая поляризация Свойства ковалентной связи – это способность электронной оболочки атома или молекулы деформироваться
- 19. Метод молекулярных орбиталей ОСНОВНЫЕ ПОЛОЖЕНИЯ При образовании молекулы по ММО изменяют своё состояние не только валентные
- 20. Метод молекулярных орбиталей ОСНОВНЫЕ ПОЛОЖЕНИЯ Для получения МО используют метод линейной комбинации атомных орбиталей МЛКАО. Из
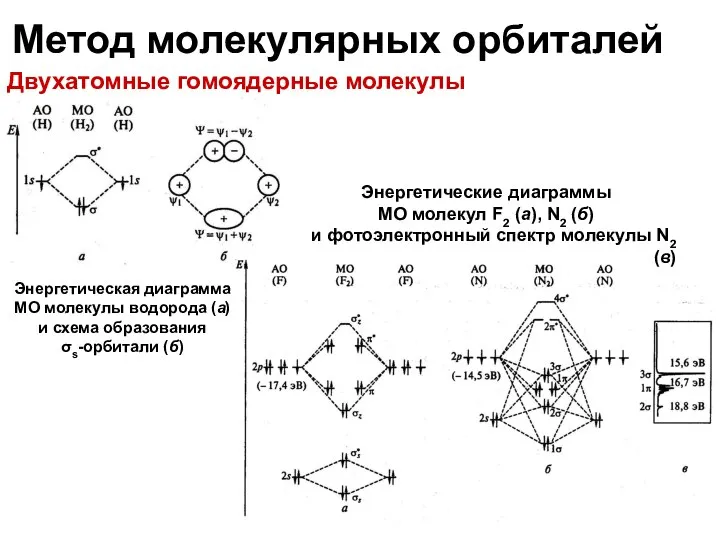
- 21. Метод молекулярных орбиталей Двухатомные гомоядерные молекулы Энергетические диаграммы МО молекул F2 (а), N2 (б) и фотоэлектронный
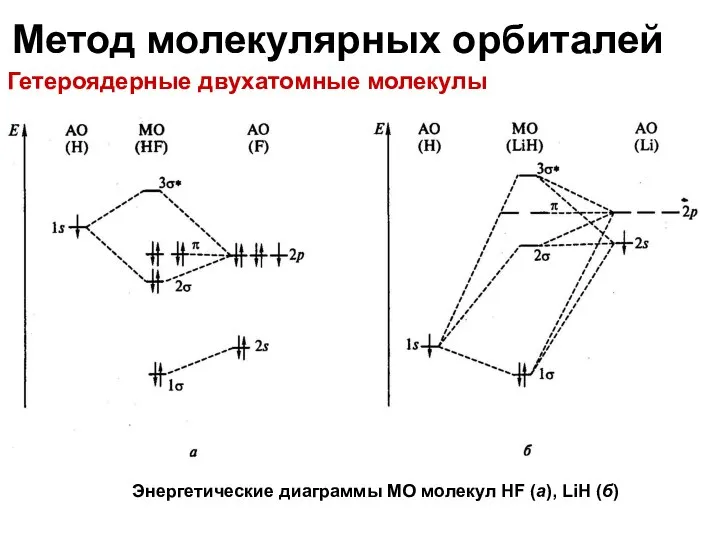
- 22. Метод молекулярных орбиталей Гетероядерные двухатомные молекулы Энергетические диаграммы МО молекул HF (а), LiH (б)
- 23. Метод молекулярных орбиталей Какую информацию можно извлечь из энергетических диаграмм МО? Прочность молекул – определяется выигрышем
- 24. Теории химической связи
- 25. Теории химической связи достоинства: Метод Валентных связей не рассматривает вклад неспаренных электронов в образование связи (природу
- 26. Теории химической связи достоинства: Метод Молекулярных орбиталей общий подход при описании всех химических соединений недостатки: не
- 27. Ионная связь При взаимодействии наиболее электроотрицательных атомов с наиболее электроположительными образуется связь с большой степенью полярности
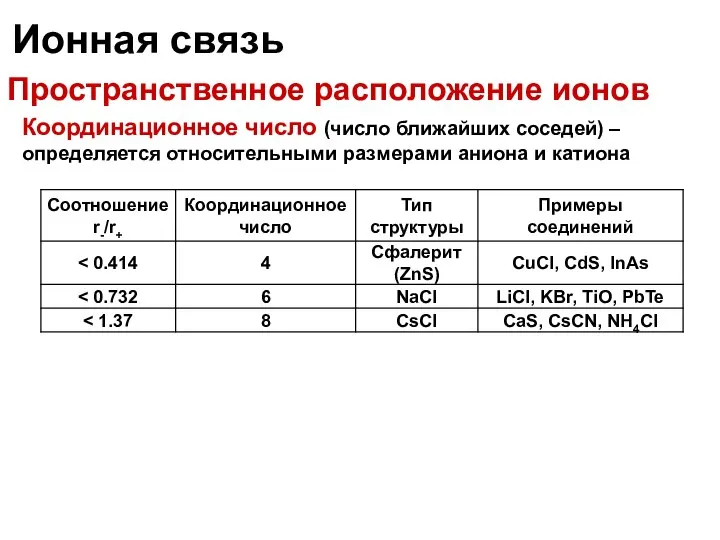
- 28. Ионная связь Пространственное расположение ионов Координационное число (число ближайших соседей) – определяется относительными размерами аниона и
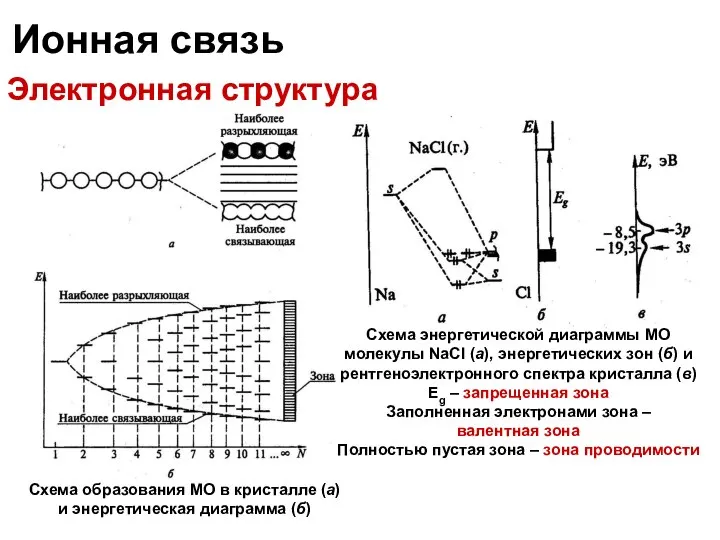
- 29. Ионная связь Электронная структура Схема энергетической диаграммы МО молекулы NaCl (а), энергетических зон (б) и рентгеноэлектронного
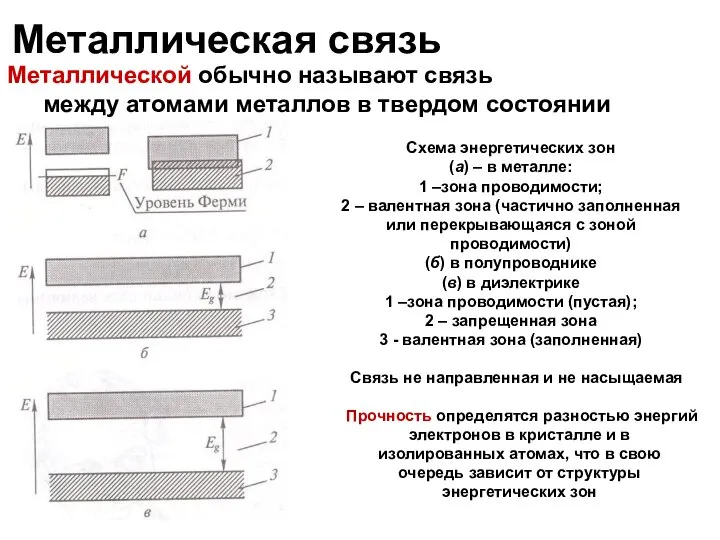
- 30. Металлическая связь Металлической обычно называют связь между атомами металлов в твердом состоянии Схема энергетических зон (а)
- 31. Комплексные соединения химические вещества, в состав которых входят комплексные частицы Комплексная частица — сложная химическая частица,
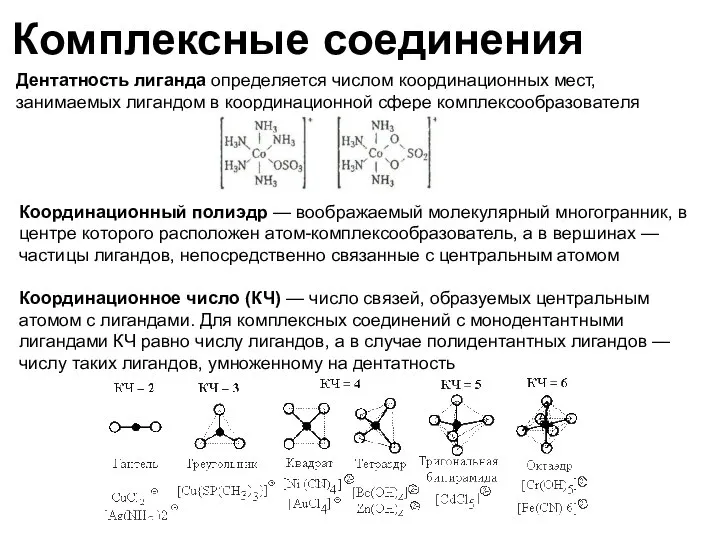
- 32. Комплексные соединения Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя Координационный полиэдр
- 33. Комплексные соединения По заряду комплекса 1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных
- 34. Комплексные соединения По числу мест, занимаемых лигандами в координационной сфере 1) Монодентатные лиганды. Такие лиганды бывают
- 35. Комплексные соединения По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например:
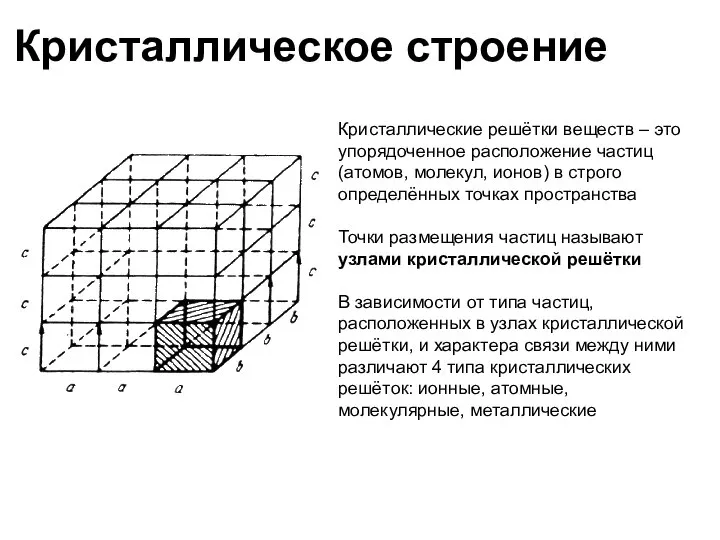
- 36. Кристаллическое строение Кристаллические решётки веществ – это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых
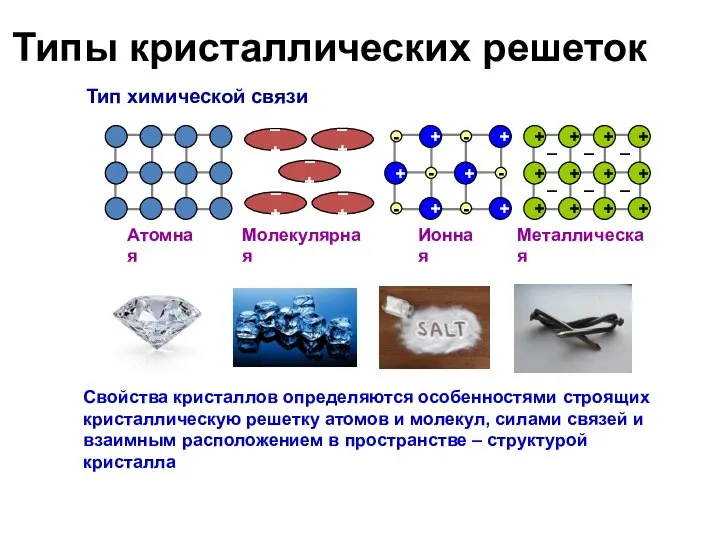
- 37. Типы кристаллических решеток Тип химической связи Атомная Молекулярная Ионная Металлическая Свойства кристаллов определяются особенностями строящих кристаллическую
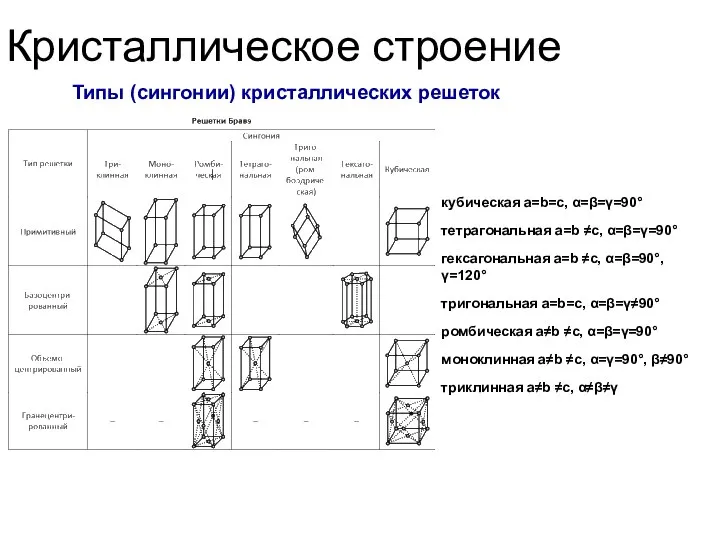
- 38. Кристаллическое строение Типы (сингонии) кристаллических решеток кубическая a=b=c, α=β=γ=90° тетрагональная a=b ≠c, α=β=γ=90° гексагональная a=b ≠c,
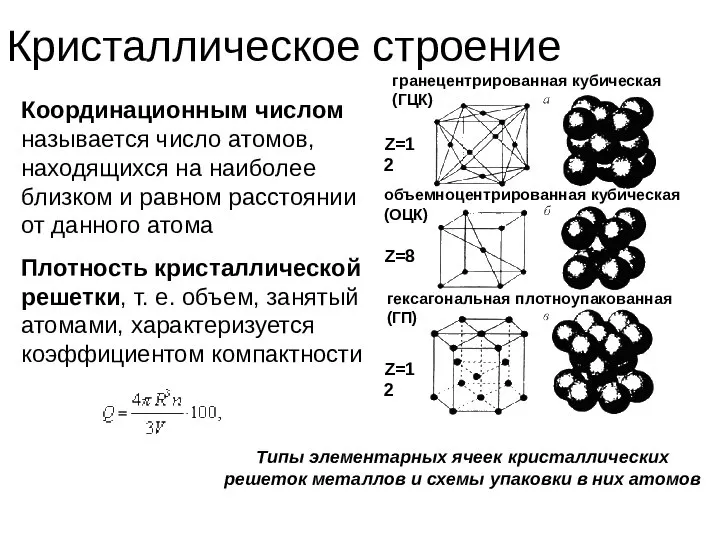
- 39. Кристаллическое строение Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов гранецентрированная кубическая
- 40. Реальные кристаллы дефекты кристаллической решетки или дефектное строение кристалла условия минералоообразования (Т, Р, геометрия полостей, в
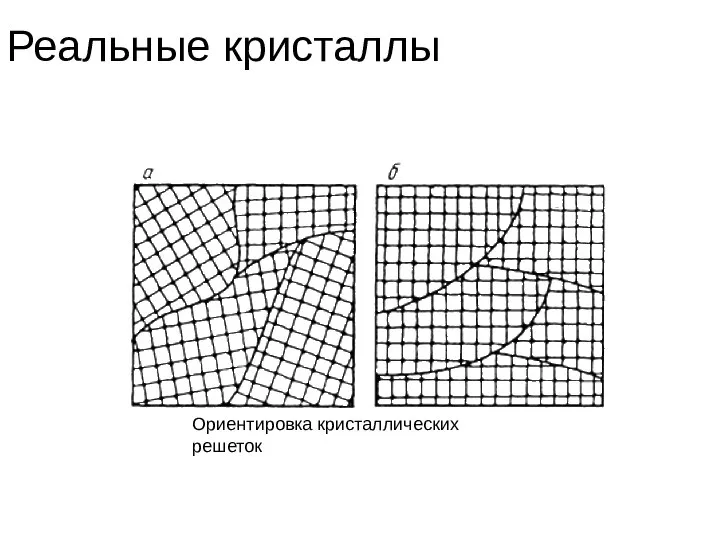
- 41. Реальные кристаллы Ориентировка кристаллических решеток
- 42. Дефекты строения ТОЧЕЧНЫЕ ДЕФЕКТЫ К точечным дефектам относятся: а) свободные места в узлах кристаллической решетки —
- 43. Дефекты строения ЛИНЕЙНЫЕ ДЕФЕКТЫ Линейные дефекты характеризуются малыми размерами в двух измерениях, но имеют значительную протяженность
- 45. Скачать презентацию




















 Химическая кинетика, химическое равновесие и катализ
Химическая кинетика, химическое равновесие и катализ Гидроксид калия KOH
Гидроксид калия KOH Вода: строение, свойства и значение
Вода: строение, свойства и значение Методика прогнозування наслідків виливу (викиду) небезпечних хімічних речовин при аваріях на промислових об`єктах і транспорті
Методика прогнозування наслідків виливу (викиду) небезпечних хімічних речовин при аваріях на промислових об`єктах і транспорті Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Виды изомерии у моносахаридов
Виды изомерии у моносахаридов Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Презентация по Химии "Оксиди" - скачать смотреть бесплатно
Презентация по Химии "Оксиди" - скачать смотреть бесплатно Химические свойства металлов
Химические свойства металлов Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии
Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии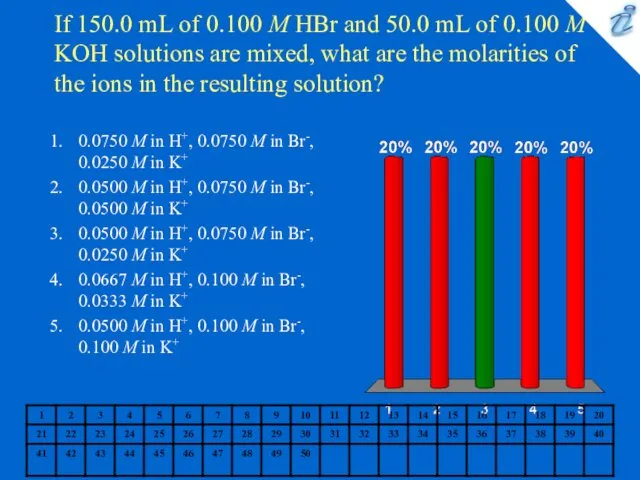 Chemistry quiz
Chemistry quiz “Су. Ерітінділер” тарауын қорытындылау
“Су. Ерітінділер” тарауын қорытындылау Применимость геохимических правил к распространенности лантанидов в земной коре
Применимость геохимических правил к распространенности лантанидов в земной коре Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах
Произведение растворимости. Строение комплексных, координационных соединений. Устойчивость в растворах Карбоновые кислоты
Карбоновые кислоты Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об
Изучение содержания углекислого газа в классном помещении и определение оптимальных условий для проветривания. Муниципальное об Спирти. Класифікація спиртів
Спирти. Класифікація спиртів Свойства простых веществ 8 класс
Свойства простых веществ 8 класс  Виды энергии
Виды энергии Электрохимические методы анализа. (Лекция 7)
Электрохимические методы анализа. (Лекция 7) Кристаллохимия как наука
Кристаллохимия как наука Хлороводород и соляная кислота
Хлороводород и соляная кислота Основные классы неорганических соединений
Основные классы неорганических соединений Как вырастить кристалл
Как вырастить кристалл Современные методы поиска химической информации
Современные методы поиска химической информации Гiдроксикислоти. Номенклатура
Гiдроксикислоти. Номенклатура Исследовательская работа на тему: Удивительные свойства воды
Исследовательская работа на тему: Удивительные свойства воды Закон действующих масс и его применение к различным типам равновесий
Закон действующих масс и его применение к различным типам равновесий