Содержание
- 2. План лекции: Комплексоны Хелатообразование комплексонов с металлами Условные константы устойчивости 4. Кривые комплексонометрического титрования 5. Визуальная
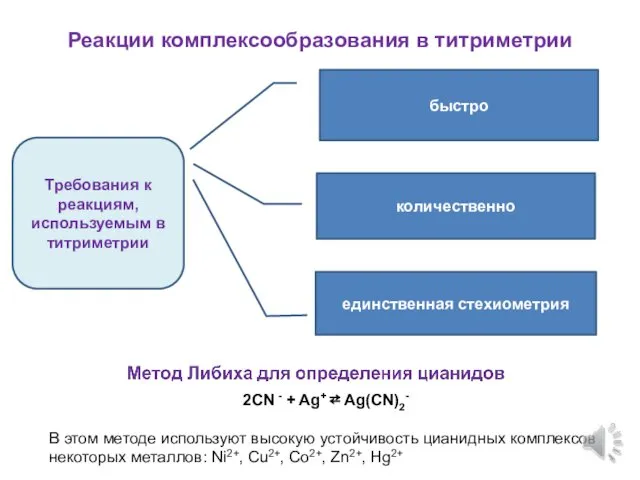
- 3. Реакции комплексообразования в титриметрии быстро количественно единственная стехиометрия Требования к реакциям, используемым в титриметрии 2CN -
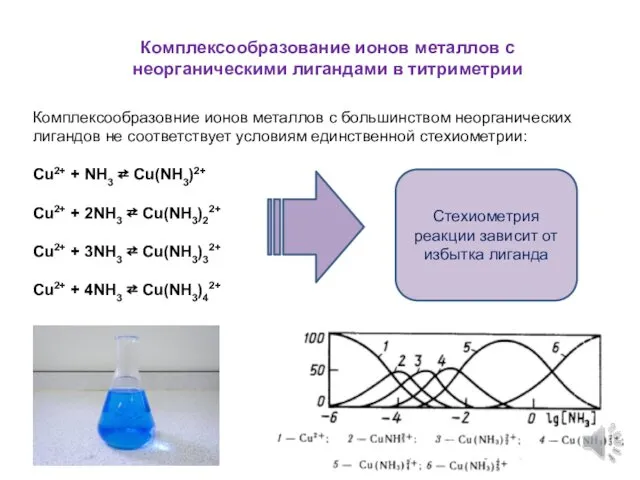
- 4. Комплексообразовние ионов металлов с большинством неорганических лигандов не соответствует условиям единственной стехиометрии: Cu2+ + NH3 ⇄
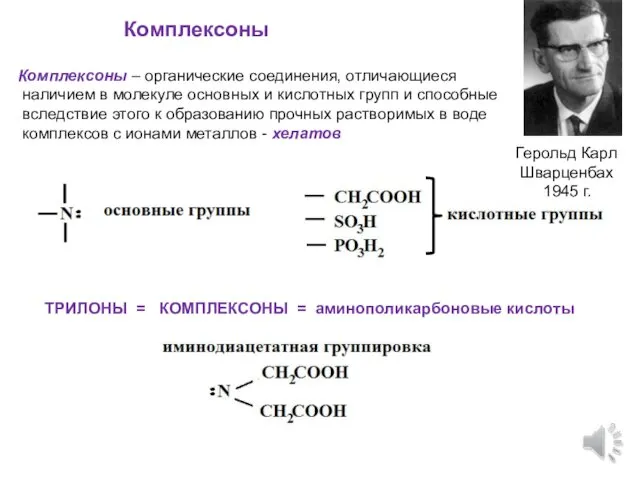
- 5. Комплексоны Комплексоны – органические соединения, отличающиеся наличием в молекуле основных и кислотных групп и способные вследствие
- 6. Дентатность – координационная емкость комплексона ЭДТА – гексадентатный лиганд КОМПЛЕКСОНЫ – полидентатные лиганды
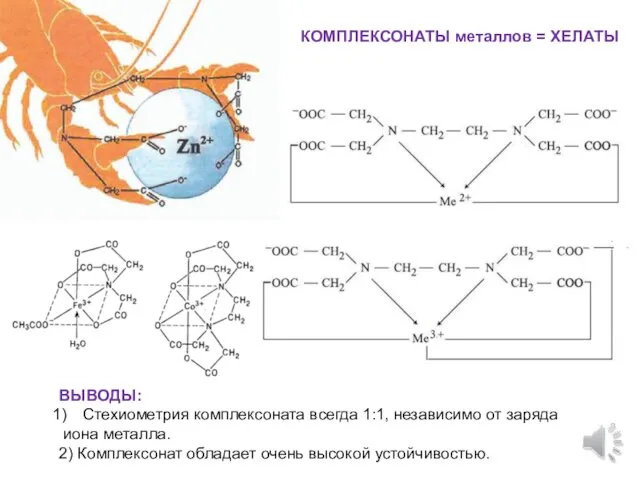
- 7. КОМПЛЕКСОНАТЫ металлов = ХЕЛАТЫ ВЫВОДЫ: Стехиометрия комплексоната всегда 1:1, независимо от заряда иона металла. 2) Комплексонат
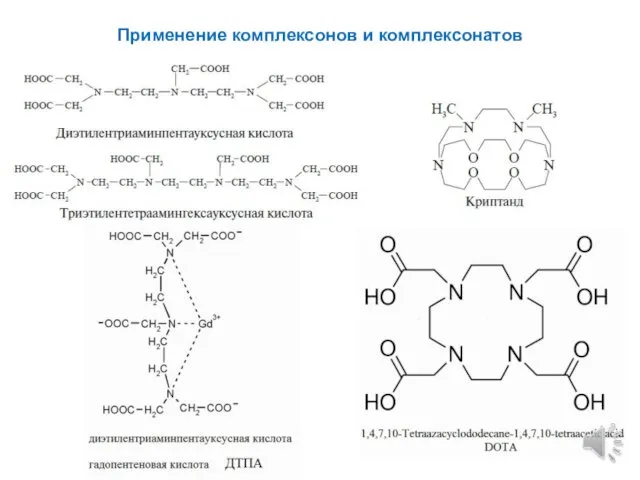
- 8. Применение комплексонов и комплексонатов
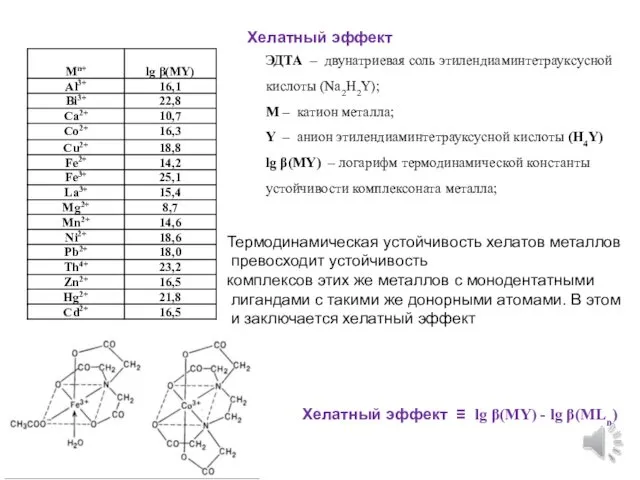
- 9. Хелатный эффект ЭДТА – двунатриевая соль этилендиаминтетрауксусной кислоты (Na2H2Y); M – катион металла; Y – анион
- 10. Протолитические свойства комплексонов Ионные формы ЭДТУ: H4Y, H3Y ̶ , H2Y2 ̶ , HY3 ̶ ,
- 11. Ионные состояния металлов в водных растворах 1 - Zn(H2O)62+, 2 – [Zn(H2O)5OH]+ , 3 - Zn(OH)2,
- 13. Скачать презентацию




 Презентация Сплавы металлов.
Презентация Сплавы металлов. N-(2-амино-3,5-дибромбензил)-N-метилциклогексанамина гидрохлорид
N-(2-амино-3,5-дибромбензил)-N-метилциклогексанамина гидрохлорид Азот
Азот Многоатомные спирты
Многоатомные спирты Фазовые диаграммы с протеканием 3-фазных реакций
Фазовые диаграммы с протеканием 3-фазных реакций Важнейшие химические понятия и законы
Важнейшие химические понятия и законы Макроэлементтер N,Cа,P
Макроэлементтер N,Cа,P Электрический ток в растворах и расплавах электролитов. Электролиз
Электрический ток в растворах и расплавах электролитов. Электролиз Химиялық, принципиалдық және технологиялық сызбанұсқалар. Технологиялқ процестерді ұйымдастыру принциптері
Химиялық, принципиалдық және технологиялық сызбанұсқалар. Технологиялқ процестерді ұйымдастыру принциптері Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Химия в сельском хозяйстве
Химия в сельском хозяйстве Значение химии в повседневной жизни
Значение химии в повседневной жизни Полимеры органические, неорганические
Полимеры органические, неорганические Щелочные и щелочно-земельные металлы Na K Li Cs Ba Rb Fr
Щелочные и щелочно-земельные металлы Na K Li Cs Ba Rb Fr  Углерод
Углерод Презентация по Химии "Дмитрий Иванович Менделеев - ученый с мировым именем" - скачать смотреть
Презентация по Химии "Дмитрий Иванович Менделеев - ученый с мировым именем" - скачать смотреть  Химическая связь
Химическая связь Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов
Эксперимент. Принципы теории планирования эксперимента. Классификация и виды экспериментов Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные Аттестационная работа. Повышение квалификации учителей химии и биологии в организации проектно-исследовательской деятельности
Аттестационная работа. Повышение квалификации учителей химии и биологии в организации проектно-исследовательской деятельности Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники ОГЭ №1, вопрос 1-16
ОГЭ №1, вопрос 1-16 Хімічні добавки. Е-числа
Хімічні добавки. Е-числа  Метаболизм сложных белков. (Тема 2)
Метаболизм сложных белков. (Тема 2) Уреидтер және оның маңызы
Уреидтер және оның маңызы Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть
Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть