Содержание
- 2. Жил один кристалл ионный Для ионов дом огромный. Был красивый он и ровный, Но случилась с
- 5. это вещества, растворы и расплавы которые проводят электрический ток. Электролиты -
- 6. «Честь науке - ей дано уменье, выводить нас из заблужденья». М.Светлов процесс распада молекул электролита на
- 8. «Честь науке- ей дано уменье, выводить нас из заблужденья». 2.Электролитическая диссоциация Шведский ученый, академик. В 1887
- 9. Электролиз расплава NaBr I. В расплаве электролита присутствуют только ионы, образовавшиеся при его диссоциации, они и
- 10. II. Электролиз водного раствора электролита В отличии от расплава в растворе электролита кроме ионов, получившихся при
- 11. Закон Фарадея: -электрохимический эквивалент вещества (1) (2) (3)
- 12. Масса вещества, выделившегося на электроде, прямо пропорциональна заряду, прошедшему через раствор (расплав) электролита: m=kQ
- 13. Масса вещества, выделившегося на электроде, прямо пропорциональна силе тока и времени прохождения тока через раствор (расплав)
- 14. – английский физик, основоположник учения об электрических и магнитных полях. Майкл Фарадей (1711 – 1867)
- 15. Задача: При никелировании детали в течении 50 минут сила тока, проходящего через ванну, была равна 2
- 16. А знаете ли вы, что….. Современную жизнь без электролиза представить себе уже невозможно….
- 17. Применение электролиза Электролизом расплавов природных соединений получают активные металлы (K, Na,Be,Ca,Ba …) Электролизом растворов солей получают-
- 18. При помощи электролиза монету можно покрыть тонким слоем многих металлов . Но первом фото монета покрыта
- 19. Гальваностегия
- 20. Гальванопластика Медные клише для типографии
- 21. Пресс-формы из пластмассы, резины, металла
- 22. Получение металлов из руд
- 23. АНОДИРОВАНИЕ
- 25. Тест: 1. При электролитической диссоциации в растворе электролита присутствуют: А) молекулы, Б) ионы, В) гидратированные ионы.
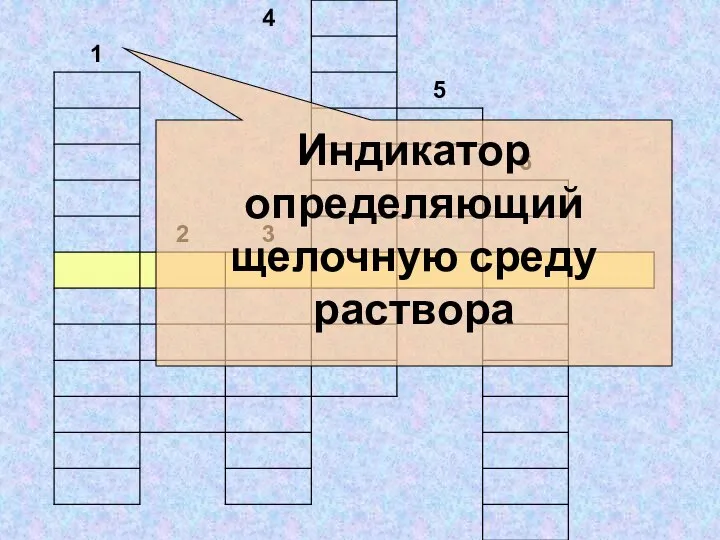
- 26. Индикатор определяющий щелочную среду раствора
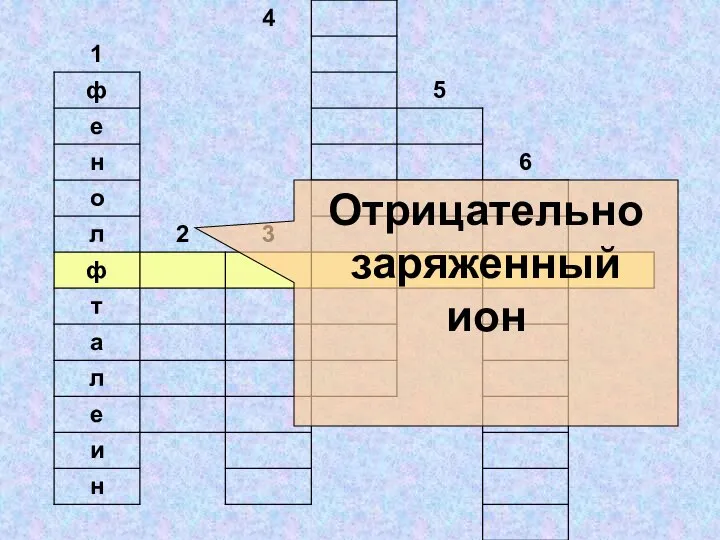
- 27. Отрицательно заряженный ион
- 28. Что образуется при растворении кристаллического вещества в воде?
- 29. процесс распада молекул электролита на ионы под действием электричес-кого тока
- 30. отрицательно заряженный электрод
- 31. отрицательно заряженный электрод
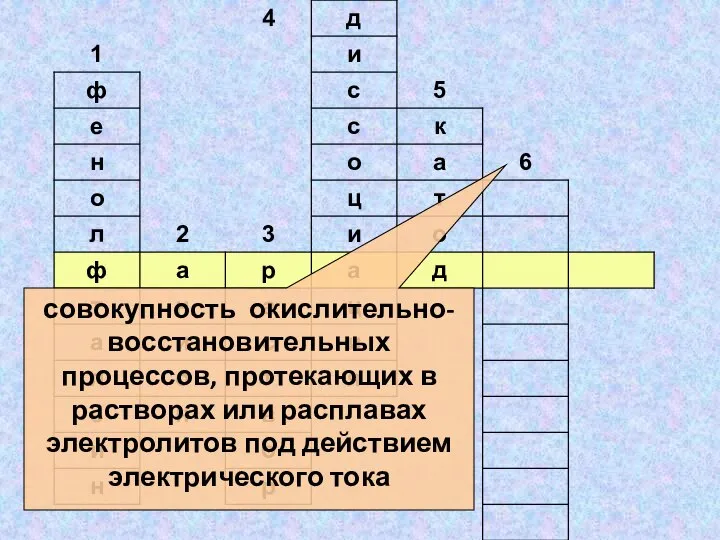
- 32. совокупность окислительно-восстановительных процессов, протекающих в растворах или расплавах электролитов под действием электрического тока
- 34. Будущее – получение цветных металлов, защита от коррозии, источники постоянного тока. Слова Аррениуса: «Электрическая диссоциация будет
- 35. Проверь себя При электролизе водного раствора хлорида лития (LiCL) на аноде в результате электролиза образуется: 1)
- 36. Проверь себя При электролизе водного раствора сульфата меди (II) ( CuSO4) на катоде выделится: А) кислород
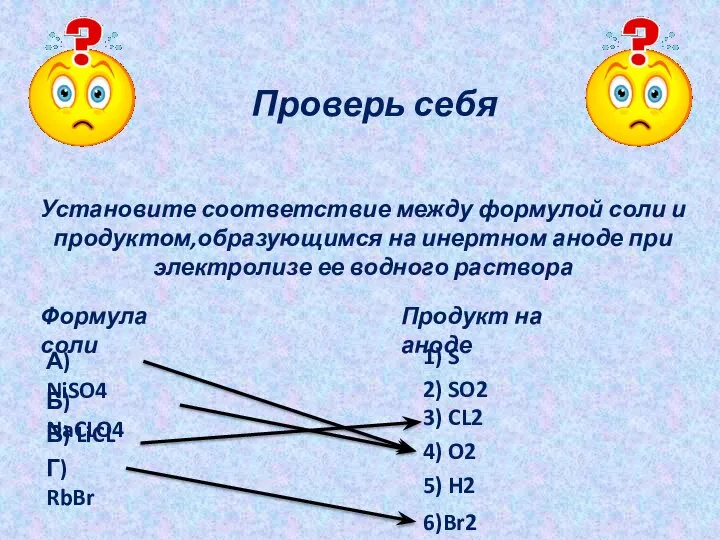
- 37. Проверь себя Установите соответствие между формулой соли и продуктом,образующимся на инертном аноде при электролизе ее водного
- 39. Скачать презентацию
































 Переосаждение. (Глава 4. § 20. Задача 13)
Переосаждение. (Глава 4. § 20. Задача 13) Геометрия молекул
Геометрия молекул Силикатная промышленность
Силикатная промышленность Галогены
Галогены Валентность
Валентность Главная подгруппа IV группы
Главная подгруппа IV группы Основные понятия и законы химии
Основные понятия и законы химии Строение, свойства, биологическая роль липидов. (Лекция 12)
Строение, свойства, биологическая роль липидов. (Лекция 12) Общая формула алкадиенов
Общая формула алкадиенов Aluminium
Aluminium Хром және оның қосылыстары
Хром және оның қосылыстары Общие химические свойства металлов
Общие химические свойства металлов принцип работы, применение в технике и быту
принцип работы, применение в технике и быту Гідроліз солей
Гідроліз солей Влияние вида основы на качество эмульсионной мази с калия йодидом при изготовлении в аптеке
Влияние вида основы на качество эмульсионной мази с калия йодидом при изготовлении в аптеке Исследование минералов в параллельном свете с одним поляризатором
Исследование минералов в параллельном свете с одним поляризатором Основные законы и понятия химии. Тема №10
Основные законы и понятия химии. Тема №10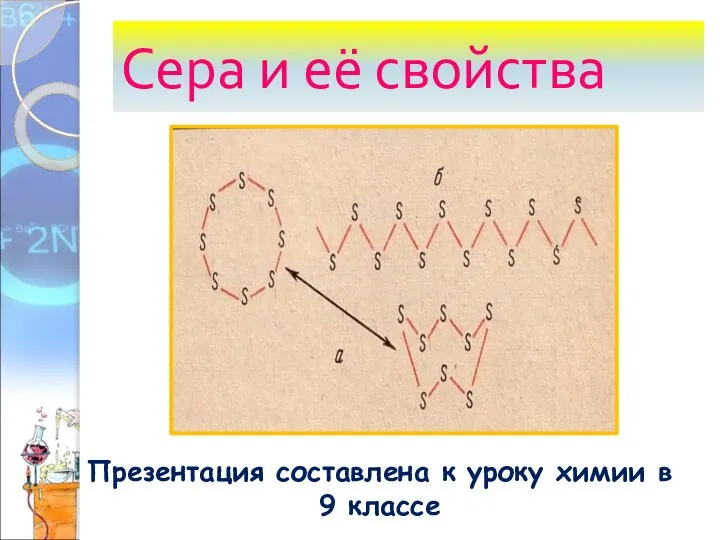 Сера и её свойства
Сера и её свойства  Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома
Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома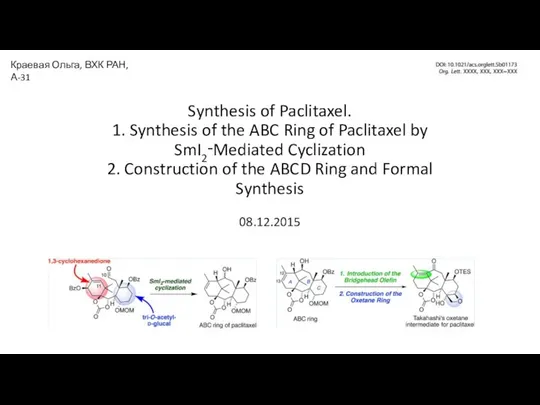 Synthesis of Paclitaxel
Synthesis of Paclitaxel Электролиз воды
Электролиз воды Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии G12 - класс антифризов
G12 - класс антифризов Лучший способ избавиться от искушения – поддаться ему Оскар Уайльд
Лучший способ избавиться от искушения – поддаться ему Оскар Уайльд Кислотно-основні рівноваги в біологічних системах. (Лекція 2)
Кислотно-основні рівноваги в біологічних системах. (Лекція 2) Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Протолитические равновесия в растворах электролитах
Протолитические равновесия в растворах электролитах Характеристика химического элемента
Характеристика химического элемента