Содержание
- 2. Нахождение в природе В природе кремний Si – второй по распространён-ности после кислорода эле-мент ( 28
- 3. Разновидности кварца Диоксид кремния в природе образует минерал кварц и многие его разновидности, такие, как: горный
- 4. Аметист Аметистовая жеода Кристалл аметиста
- 5. Горный хрусталь Перед вами статуэт-ка бульдога из горно-го хрусталя, создан-ная по замыслу юве-лира. Наиболее чистый кварц
- 6. Агат Агат очень интересный и удивительный камень. Его различные разновидности и оттенки (разводы, круги, пейзажи) вдохновляют
- 7. Яшма Яшма волшебная, ни с одним камнем не схожая, таящая в себе и рисунки явные, и
- 8. Топаз Перед вами кристалл топаза, инкрустированный в горной породе.
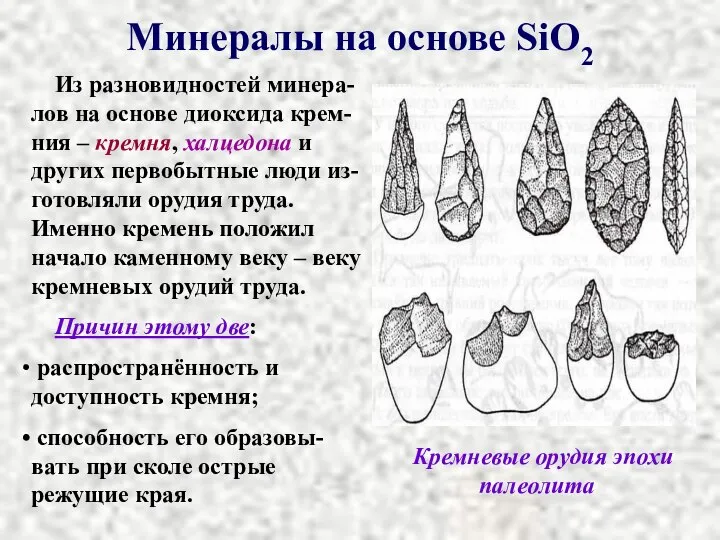
- 9. Минералы на основе SiO2 Из разновидностей минера-лов на основе диоксида крем-ния – кремня, халцедона и других
- 10. Природные силикаты Второй тип природных соедине-ний кремния – это силикаты. Они составляют 75 0/0 от массы
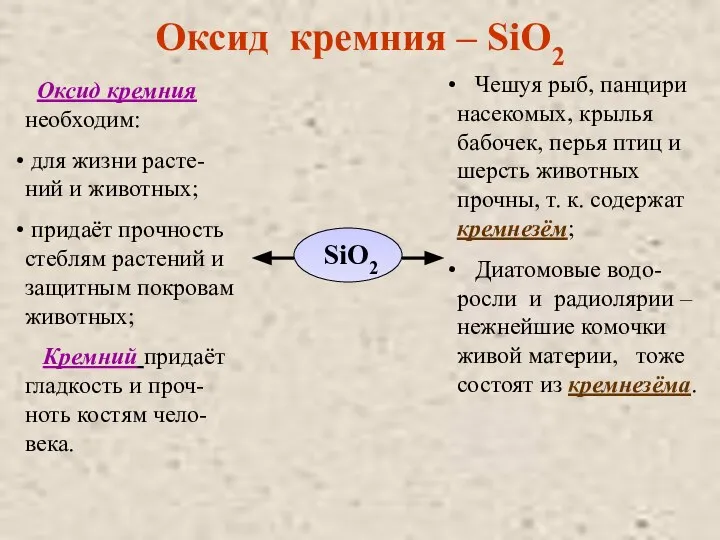
- 11. Оксид кремния – SiO2 SiO2 Оксид кремния необходим: для жизни расте-ний и животных; придаёт прочность стеблям
- 12. Свойства кремния Структура элементар-ного кремния аналогична алмазу. Графитоподобная модификация неизвестна. Кремний – типичный полупроводник ( при
- 13. Кубическая гранецентрированная решётка типа алмаза Тетрагональная кристаллическая система
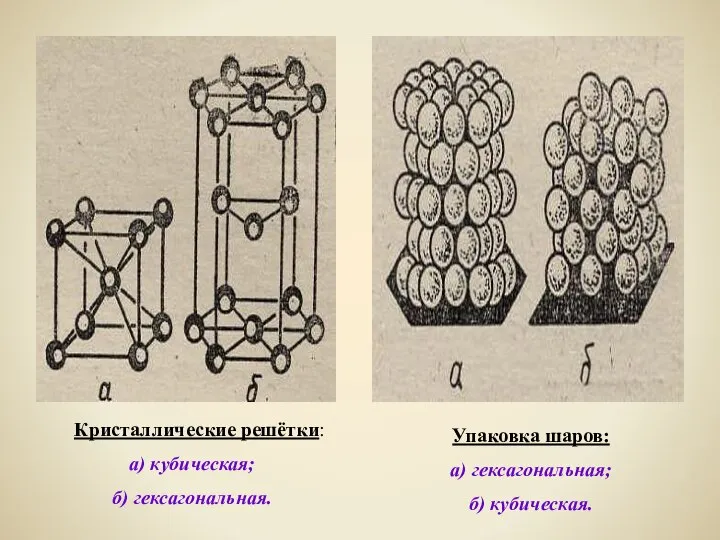
- 14. Кристаллические решётки: а) кубическая; б) гексагональная. Упаковка шаров: а) гексагональная; б) кубическая.
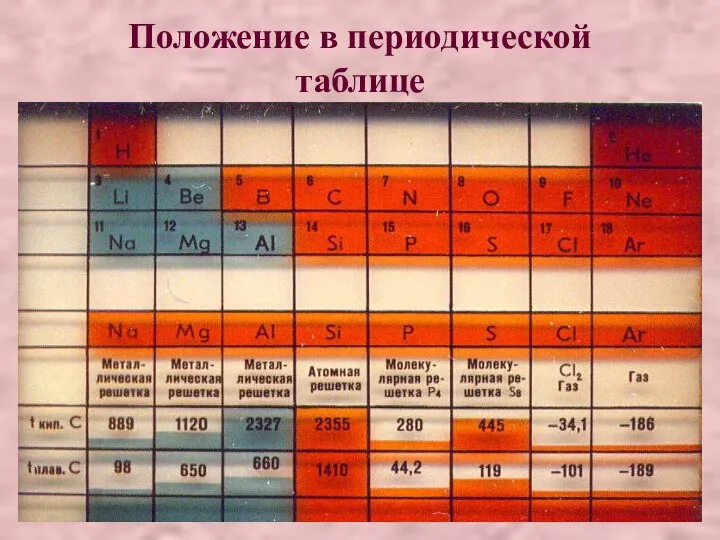
- 15. Положение в периодической таблице
- 16. Проводимость кремния увеличивается при замене некоторых атомов кремния атомами элементов сосед-них групп периодической системы Д. И.
- 17. Углерод и кремний – неметаллы IV группы
- 18. Степень окисления О +4 SiF4 -1 SiS2 -2 SiO -2 Si SiO2 -2 -4 SiH4 +1
- 19. Атомы кремния способны образовывать цепочки, что является признаком кремний-органических соединений. В этом отношении он сходен с
- 20. Химические свойства Si С простыми веществами: а) кремний горит в кислороде, образуя известный вам уже диоксид
- 21. в) кремний непосредственно реагирует с водородом при повышенных температурах с образованием кремнийводородов – силанов: Si +
- 22. Со сложными веществами: Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород: Si +
- 23. В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды:
- 24. Химические свойства SiO2 Оксид кремния (IV) как и оксид углерода (IV) CO2 является кислотным оксидом. Однако
- 25. Получение силикатов Силикаты можно получить сплавлением диоксида кремния с оксидами металлов или с карбонатами: SiO2 +
- 26. Получение кремниевой кислоты Из растворов силикатов действием на них более сильных кислот – соляной HCI, серной
- 27. Открытие кремния Хотя уже в глубокой древности люди широко использовали в своём быту соединения кремния, сам
- 28. Получение кремния Получение кремния в промышленности: В промышленности кремний получают при нагревании смеси песка и угля:
- 29. 2. Получение кремния в лаборатории: В лаборатории кремний получают при взаимодействии смеси чистого песка с порошком
- 31. Скачать презентацию
























 Презентация по Химии "Ярмарок професій" - скачать смотреть
Презентация по Химии "Ярмарок професій" - скачать смотреть  Требования, предъявляемые к дизельным топливам
Требования, предъявляемые к дизельным топливам Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т
Работу выполнила ученица 9 А класса ГОУ СОШ №546 г. Москвы Коломиец Екатерина Руководитель: учитель химии ГОУ СОШ №546 Симонова Т Тесты для самопроверки
Тесты для самопроверки Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Растворы. Первичные понятия
Растворы. Первичные понятия Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64
Как сделать духи для любимой мамочки? Выполнил: Причина Алексей Учащийся 3 класса Б МОУ СОШ № 64 Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice
Acizi, baze, oxizi, săruri. Caracteristica generală, proprietă ți fizice și chimice Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна
Карбоновые кислоты Учитель химии МОУ лицея № 6 Дробот Светлана Сергеевна  Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В.
Тест по теме: «Алканы» Автор: учитель химии МОУСОШ № 6 Ким Н. В. Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Отдельные классы дисперсных систем
Отдельные классы дисперсных систем Воздушные и тепловые свойства почв
Воздушные и тепловые свойства почв Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Своя игра по химии
Своя игра по химии Алкены
Алкены Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Открытие периодического закона Д.И. Менделеева
Открытие периодического закона Д.И. Менделеева Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина
Органическая химия 10 класс А.А.Карцовой и А.Н.Лёвкина Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности
Применение циклической вольтамперометрии для определения истинной Sпов платины и оценки стабильности Коррозия металлов
Коррозия металлов Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн
Агрохимия для восьмиклассников. Учебно-исследовательский проект учащейся 8 «В» класса МОУЛ «ВУВК им. А. П. Киселёва» Желтовой Анн Особенности строения, реакционной способности и методы синтеза аренов
Особенности строения, реакционной способности и методы синтеза аренов Презентация по Химии "Классификация углеводородов" - скачать смотреть
Презентация по Химии "Классификация углеводородов" - скачать смотреть  Силикаты. Пироксены. Амфиболы. Полевые шпаты
Силикаты. Пироксены. Амфиболы. Полевые шпаты Мыс айналымы
Мыс айналымы Хроматографический анализ
Хроматографический анализ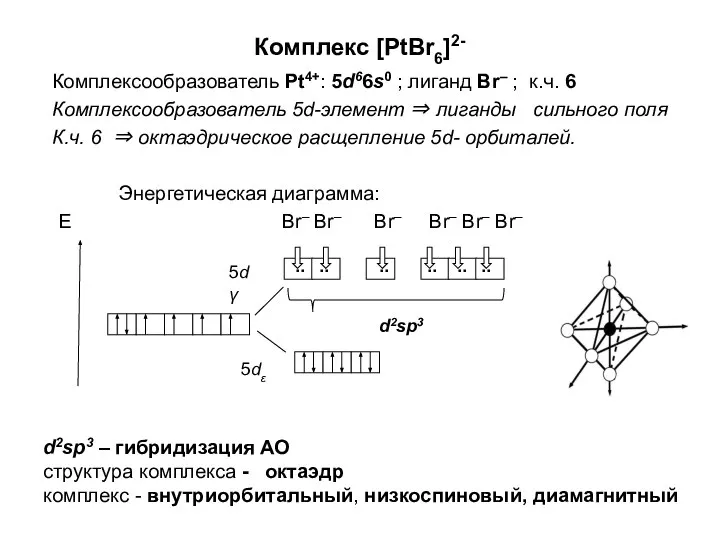 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)