Содержание
- 2. Основные вопросы по 1-й лекции 1. Структурная биохимия. Первичная, вторичная, третичная структура белков. Связи, стабилизирующие эти
- 3. Лекция 2 Химическая кинетика Химическая кинетика - один из важнейших разделов химии, задача которого - объяснение
- 4. Классификация химических реакций
- 5. Молекулярность химических реакций Мономолекулярными называют реакции, в которых элементарный акт представляет собой химическое превращение одной молекулы.
- 6. Порядок реакции Порядок реакции. В кинетике различают реакции первого, второго , третьего или даже дробного порядка.
- 7. Порядок реакции v =k [A]2 [B] [C] 3 , это реакция шестого порядка, но первого по
- 8. Cкорость реакции. Основным понятием в химической кинетике является скорость реакции. Скорость химической реакции определяется количеством вещества,
- 9. Закон действующих масс Гулдберга и Вааге. В основе кинетики лежит закон действующих масс Гулдберга и Вааге.
- 10. Закон действующих масс Гулдберга и Вааге. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций
- 11. Выражения для скорости реакции Для реакции нулевого порядка v =-dA/dt =k, (размерность k М/с) Для мономолекулярной
- 12. Закон действующих масс Гулдберга и Вааге. A=P V=k[A], k –константа скорости mA+nB=pC+qD V=k[A]m[B]n Влияние концентраций реагирующих
- 13. Константа скорости k Константа скорости k характеризует 1) химическую природу реагирующих веществ, 2) их способность вступать
- 14. Способы выражения концентрации 1. Молярная концентрация. Количество молей в 1 л раствора моль/л или М ммоль/л,
- 15. аттомоль/л, аМ (10-18 ) зептомоль/л, зМ (10-21 ) йоктомоль/л (yocto), (10-24 ) 1 йоктомоль составляет 0,6
- 16. Молярная концентрация. Количество молей в 1 л раствора моль/л или М ммоль/л, мМ (10-3) мкмоль/л, мкМ
- 17. 2. Массовая доля (Процентная концентрация). Масса (г) вещества в 100 г раствора. m(в-ва)/m (р-ра) × 100%
- 18. Экспериментальный расчет Расчет количества вещества на биочипе, электроде, подложке микроскопа. Например, на биочип нанесли 2 мкл
- 19. Количество молей = объем * молярность ν = 2 * 10-6 л * 100 10-3 моль/л
- 20. Порядок реакции Порядок реакции. В кинетике различают реакции первого, второго , третьего или даже дробного порядка.
- 21. Порядок реакции v =k [A]2 [B] [C] 3 , это реакция шестого порядка, но первого по
- 22. Зависимость скорости реакции нулевого порядка от концентрации V=k
- 23. Зависимость скорости реакции первого порядка от концентрации v =k [A],
- 24. Зависимость скорости реакции второго порядка от концентрации V=k[A]2 парабола
- 25. Начальная скорость ферментативной реакции Начальная скорость – это скорость в первые моменты инкубации, пока еще сохраняется
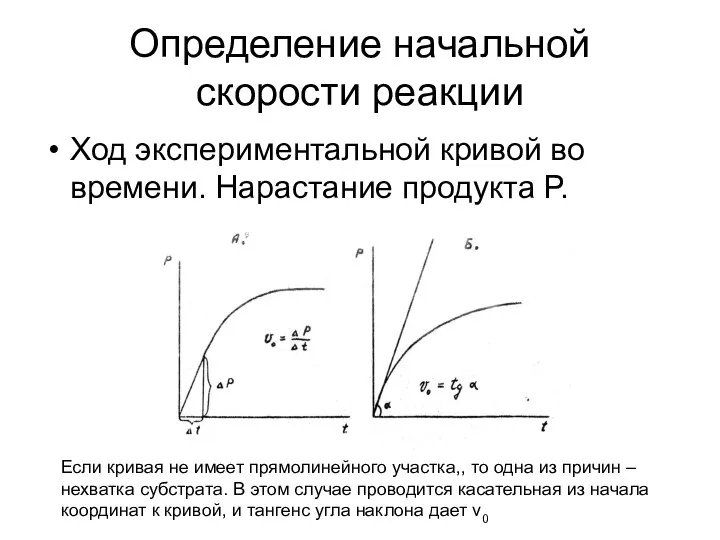
- 26. Определение начальной скорости реакции Ход экспериментальной кривой во времени. Нарастание продукта Р. Если кривая не имеет
- 27. Каталитические реакции Если катализатор находится в одной фазе с реакционной смесью, то процесс называется гомогенным, если
- 28. Ферменты, растворенные в реакционной смеси, считаются гомогенными катализаторами. Однако, часто ферменты ведут себя как гетерогенные катализаторы,
- 29. Истинные растворы -размеры чстич менее 1 нм Коллоидные растворы (растворы белков 1-100 нм (нанорастворы)
- 30. Каталитические реакции Катализатор – это вещество не входящее в стехиометрическое уравнение реакции, может образовывать с исходными
- 31. Активные центры ферментов как биологических катализаторов В основе катализа лежит представление о том, что каталитический цикл
- 32. Активные центры ферментов Активный центр фермента имеет сложную конфигурацию, он включает как полярные (гидрофильные ), так
- 33. Активные центры ферментов Активный центр фермента осуществляет две функции: 1. сорбцию субстрата (комплексообразование субстрата с ферментом)
- 34. Природа ферментативного катализа S→S* P На первой стадии исходная молекула претерпевает определенные конформационные и электронные изменения,
- 35. Энергия активации. В таком возбужденном состоянии S*(его называют переходным) молекула существует очень недолго (10 -14 -10
- 36. Взаимодействие субстрата и фермента описывается моделью «ключ-замок» или моделью индуцированного соответствия, когда активный центр фермента достаточно
- 37. Идентификация групп, входящих в активные центры ферментов 1.Идентификация групп, входящих в активные центры ферментов, проводится с
- 38. Сорбционный и каталитический участки. Сорбционный подцентр, ответственный за связывание, фиксацию и ориентацию субстратов, определяет специфичность действия
- 39. Типы катализа 1. Катализ сближением. (Внутримолекулярные реакции и ферментативные реакции). 2. Ковалентный катализ. 2.1.Нуклеофильный катализ. 2.2.
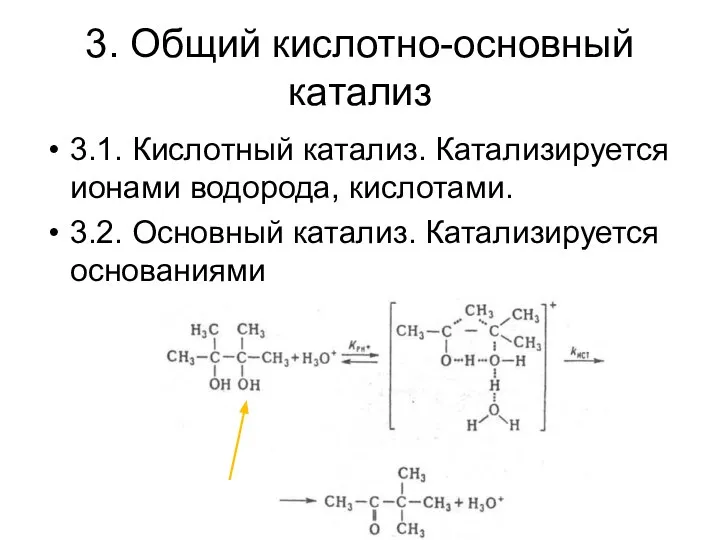
- 40. 3. Общий кислотно-основный катализ 3.1. Кислотный катализ. Катализируется ионами водорода, кислотами. 3.2. Основный катализ. Катализируется основаниями.
- 41. Типы катализа (по механизму реакции). 1. Катализ сближением. Примеры: внутримолекулярные реакции и ферментативные реакции
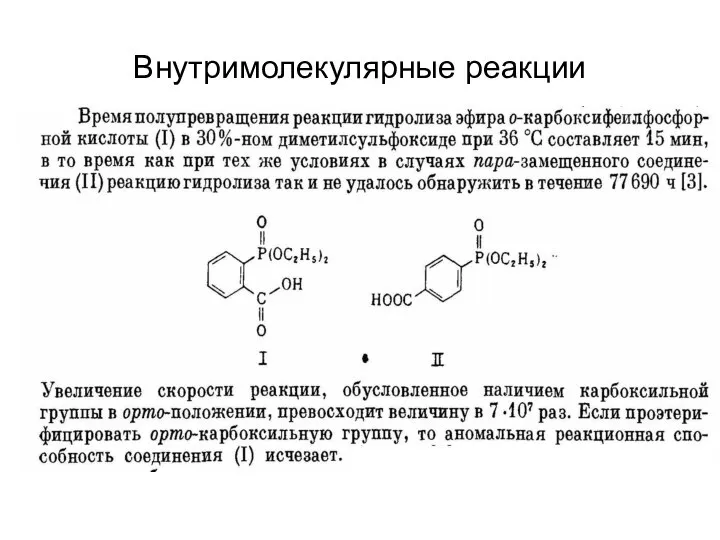
- 42. Внутримолекулярные реакции
- 43. 1. Катализ сближением Для ферментов катализ сближением приводит к локальному увеличению локальной концентрации реагирующих молекул на
- 44. 2. Ковалентный катализ. Некоторые ферменты химически реагируют с субстратами с образованием ковалентных фермент-субстратных промежуточных соединений (ацилфермент
- 45. Ковалентные фермент-субстратные промежуточные соединения
- 46. 2.1. Нуклеофильный катализ 1. К нуклеофильным группам ферментов, которые участвуют в ковалентном катализе относятся: -OH (серин,
- 47. Нуклеофильный катализ
- 48. 2.2. Электрофильный катализ (основная роль – стабилизация образующихся отрицательных зарядов) Примеры электрофильных катализаторов 1. ионы металлов.
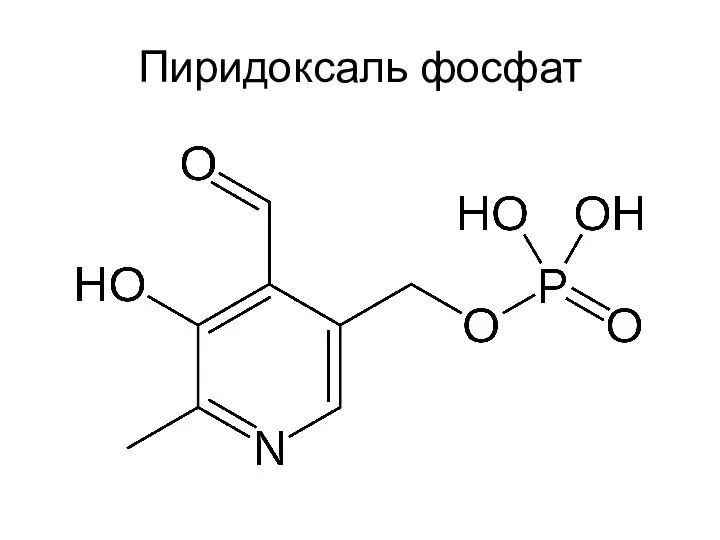
- 49. Пиридоксаль фосфат конденсируется с аминокислотами, образуя основание Шиффа. Пиридиновое кольцо оттягивает на себя электроны, эффективно стабилизируя
- 50. Пиридоксаль фосфат
- 51. 3. Общий кислотно-основный катализ 3.1. Кислотный катализ. Катализируется ионами водорода, кислотами. 3.2. Основный катализ. Катализируется основаниями
- 52. Классификация химических реакций
- 53. Классификация реакций (по стадиям). Последовательные многостадийные цепи реакций (гликолиз). А→Б →В →Г….Р В такой цепи скорость
- 54. Классификация реакций (по стадиям) Разветвленные реакции с образованием различных конечных продуктов. Пример: превращение ацетил –КоА: ацетил
- 55. Классификация реакций Ферментативная реакция E+S ES →E + P Необратимые (односторонние для ферментативных реакций)
- 57. Скачать презентацию





![Порядок реакции v =k [A]2 [B] [C] 3 , это реакция](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651792/slide-6.jpg)




![Закон действующих масс Гулдберга и Вааге. A=P V=k[A], k –константа скорости](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651792/slide-11.jpg)








![Порядок реакции v =k [A]2 [B] [C] 3 , это реакция](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651792/slide-20.jpg)

![Зависимость скорости реакции первого порядка от концентрации v =k [A],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651792/slide-22.jpg)
![Зависимость скорости реакции второго порядка от концентрации V=k[A]2 парабола](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/651792/slide-23.jpg)



























 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Характеристика металу Алюміній
Характеристика металу Алюміній Стискання газів. Рівняння Менделєєва-Клапейрона
Стискання газів. Рівняння Менделєєва-Клапейрона Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Химический брейн-ринг
Химический брейн-ринг Железо и его соединения
Железо и его соединения  Водород как элемент и простое вещество
Водород как элемент и простое вещество Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Многоатомные спирты
Многоатомные спирты Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Химическая лаборатория
Химическая лаборатория Аттестационная работа. Мини-проекты на уроках химии. 8 класс
Аттестационная работа. Мини-проекты на уроках химии. 8 класс Презентация Химия и русский язык
Презентация Химия и русский язык Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Лекарства
Лекарства Получение металлов
Получение металлов Платина. Знаходження в періодичній системі і основні характеристики
Платина. Знаходження в періодичній системі і основні характеристики Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов Эпоксидные смолы
Эпоксидные смолы Органические соединения и их классификация
Органические соединения и их классификация Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Изотермический процесс в реакционном объеме. (Тема 6.2)
Изотермический процесс в реакционном объеме. (Тема 6.2) Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности
Аттестационная работа. Методическая разработка фрагмента урока химии с элементами исследовательской деятельности Оксиди
Оксиди Топливо. Виды топлива
Топливо. Виды топлива Каучук, резина и другие
Каучук, резина и другие Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”