Содержание
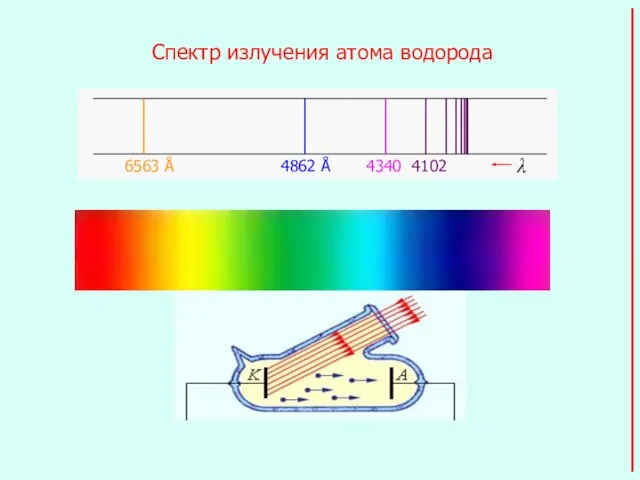
- 2. Спектр излучения атома водорода Фотоэффект
- 3. Для описания явлений микромира ( масштаб Свяжем теорию с практикой …
- 4. §1. Корпускулярные свойства излучения
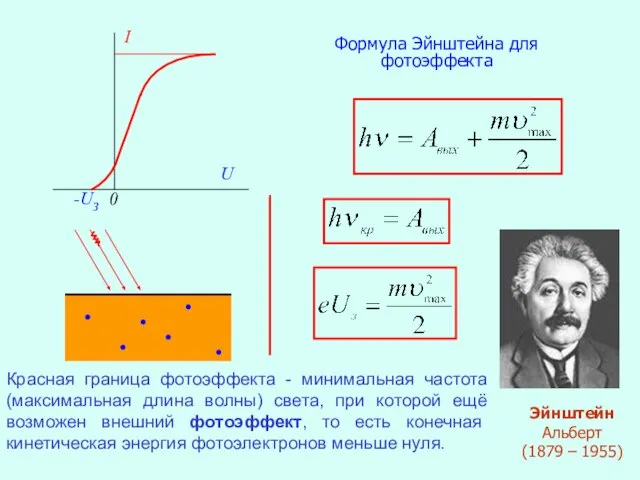
- 5. I Iн I0 0 -UЗ U Зависимость силы фототока от приложенного напряжения. Фотоэффект - испускание электронов
- 6. I 0 -UЗ U Формула Эйнштейна для фотоэффекта Эйнштейн Альберт (1879 – 1955) Красная граница фотоэффекта
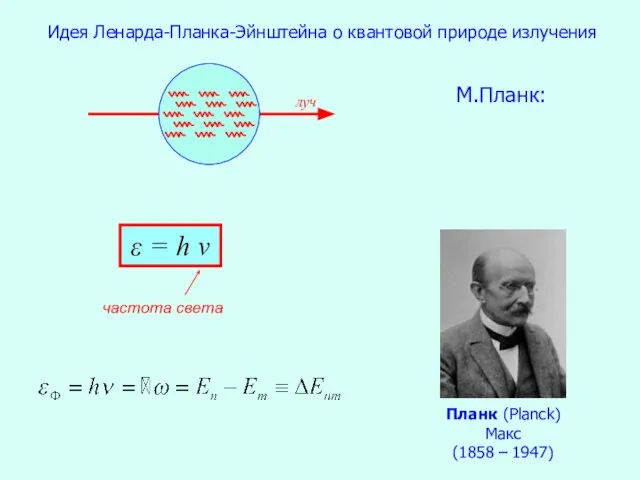
- 7. Идея Ленарда-Планка-Эйнштейна о квантовой природе излучения М.Планк: ε = h ν Планк (Planck) Макс (1858 –
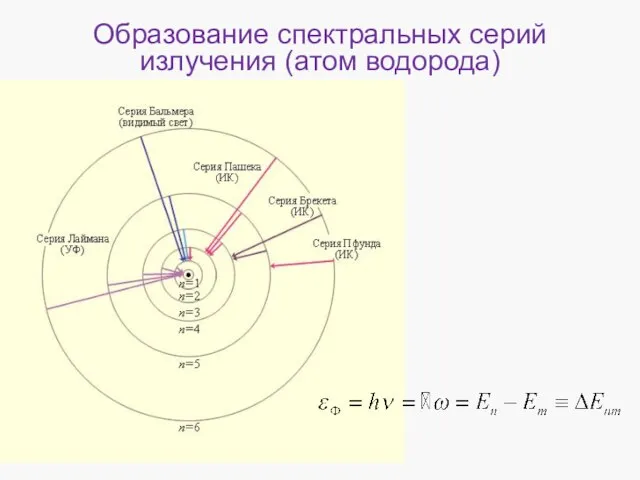
- 8. Образование спектральных серий излучения (атом водорода)
- 9. Характеристики фотона h=6,63 .10 -34 Дж . с постоянная Планка Энергия: Масса: Масса покоя: Импульс: длина
- 10. §2. Гипотеза де Бройля. Волна де Бройля. Проявления волновых свойств частиц 8
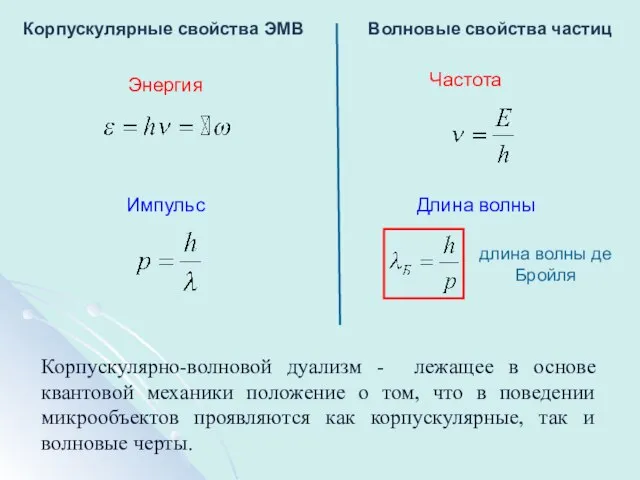
- 11. Корпускулярные свойства ЭМВ Волновые свойства частиц Энергия Частота Импульс Длина волны длина волны де Бройля Корпускулярно-волновой
- 12. Картина дифракции электронов на поликристаллическом образце при длительной экспозиции (a) и при короткой экспозиции (b) Опыты
- 13. § 3. Особенности описания движения микрочастиц. Соотношения неопределенностей
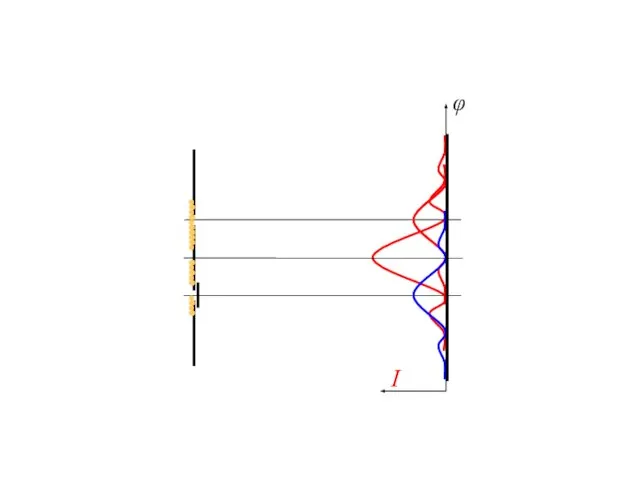
- 14. I φ Дифракция электронов на одной и двух щелях Приписать отдельным электронам определенную траекторию невозможно!
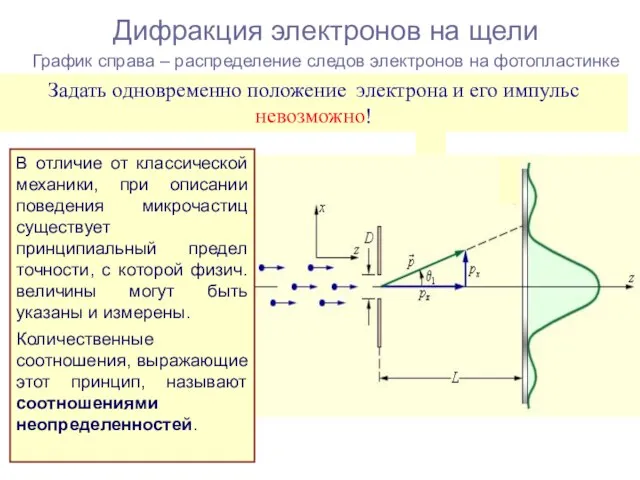
- 15. Дифракция электронов на щели График справа – распределение следов электронов на фотопластинке Задать одновременно положение электрона
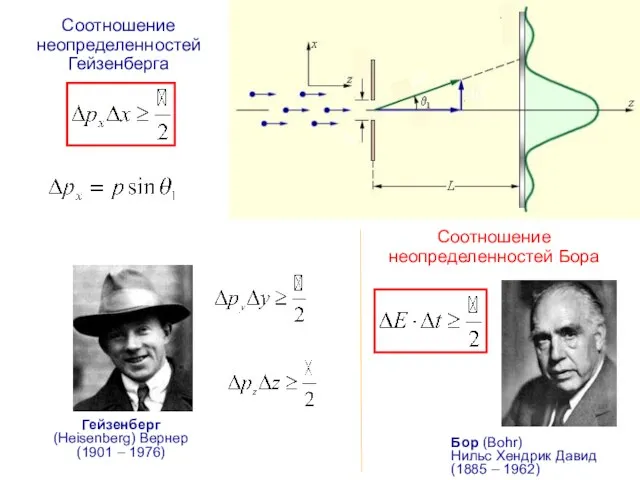
- 16. Соотношение неопределенностей Гейзенберга Гейзенберг (Heisenberg) Вернер (1901 – 1976) Соотношение неопределенностей Бора Бор (Bohr) Нильс Хендрик
- 17. В природе объективно не существует состояний частицы с точно определенными значениями х и рх. Для измерения
- 18. - методологический принцип, сформулированный Нильсом Бором применительно к квантовой физике, согласно которому, для того чтобы наиболее
- 19. §3. Уравнение Шрёдингера Шрёдингер (Schrödinger) Эрвин (1887 – 1961)
- 20. волновая функция – решение ур. Шредингера Движению частицы Шрёдингер сопоставил плоскую волну: - уравнение Шрёдингера для
- 21. Свойства волновой функции 1. Однозначна и непрерывна. 2. Физический смысл ВФ - вероятность обнаружения частицы в
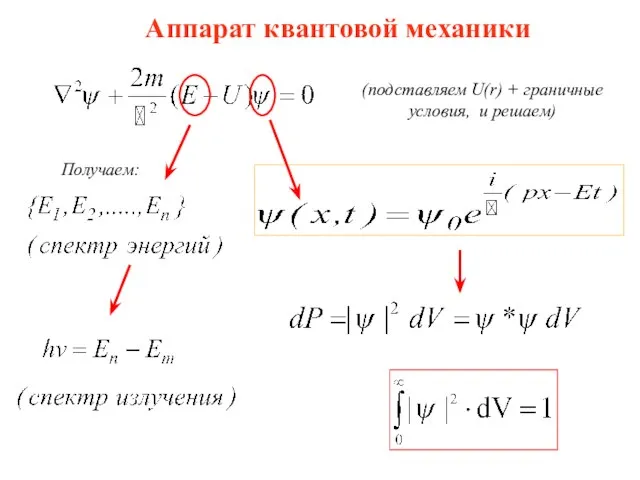
- 22. Аппарат квантовой механики (подставляем U(r) + граничные условия, и решаем) Получаем:
- 23. § 4. Уравнение Шредингера для атома водорода. Квантовые числа 13
- 24. 1. E > 0 - значение энергии изменяется непрерывно. 2. E U r 0 n =
- 25. Решение уравнения Шредингера для электрона в атоме водорода: n = 1,2,3,.. - главное квантовое число l
- 26. Физический смысл (n, l, m) в атоме водорода Главное квантовое число n определяет энергию уровня: Орбитальное
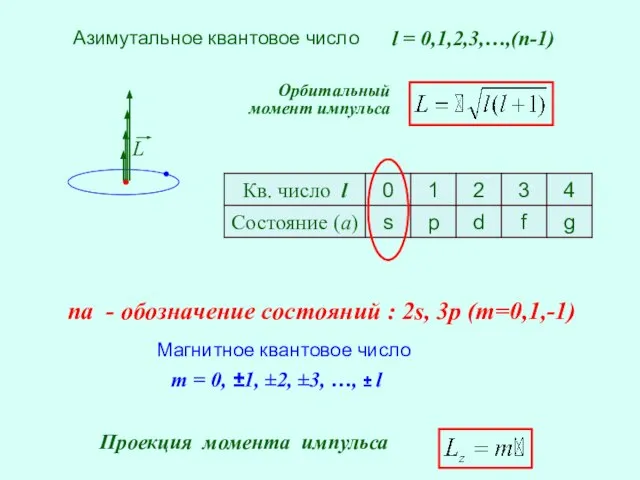
- 27. Азимутальное квантовое число l = 0,1,2,3,…,(n-1) m = 0, ±1, ±2, ±3, …, ± l Магнитное
- 28. § 5. Спин элементарных частиц. Фермионы и бозоны. Принцип Паули Паули Вольфганг Эрнст (1890 – 1958)
- 29. Из опыта: электрон обладает собственным моментом импульса - спином s – спиновое число s = 1/2
- 30. Бозе-частицы (бозоны) – частицы с целочисленным спином или спином, равным нулю: мезоны (s = 0), фотоны
- 31. s = 1/2 Для электрона и других легких частиц (позитрон, мюоны, нейтрино) 1. s = 0
- 33. Скачать презентацию




















 Равноускоренное прямолинейное движение
Равноускоренное прямолинейное движение Энтропия в техносфере
Энтропия в техносфере Презентация по физике "Физический калейдоскоп" - скачать
Презентация по физике "Физический калейдоскоп" - скачать  Уравнения теории упругости. Напряженное состояние в точке. Гипотеза Сен-Венана. (Лекции 1-2)
Уравнения теории упругости. Напряженное состояние в точке. Гипотеза Сен-Венана. (Лекции 1-2) Термодинамические свойства воды и водяного пара
Термодинамические свойства воды и водяного пара Теплолічильник. (Задача 2)
Теплолічильник. (Задача 2) Методы анализа, основанные на испускании излучения. Особенности валидации физико-химических методов
Методы анализа, основанные на испускании излучения. Особенности валидации физико-химических методов Линза. Виды линз
Линза. Виды линз Основні положення молекулярно-кінетичної теорії будови речовини та її дослідне обґрунтування. Маса та розміри атомів і молекул
Основні положення молекулярно-кінетичної теорії будови речовини та її дослідне обґрунтування. Маса та розміри атомів і молекул Физика – (греч . ta physika, от physis - природа), наука о природе. (Лекция 1)
Физика – (греч . ta physika, от physis - природа), наука о природе. (Лекция 1) Электростатическое поле в вакууме. Тема 1
Электростатическое поле в вакууме. Тема 1 Методы зондирования окружающей среды. Радиофизические характеристики атмосферы Земли
Методы зондирования окружающей среды. Радиофизические характеристики атмосферы Земли Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Тонкостенные железобетонные оболочки
Тонкостенные железобетонные оболочки Нагрузки, действующие на элементы наземной космической инфраструктуры
Нагрузки, действующие на элементы наземной космической инфраструктуры Атмосферное давление на разных высотах. Манометры
Атмосферное давление на разных высотах. Манометры Рентгеновское излучение
Рентгеновское излучение Бұлшықет жиырылу биофизикасы
Бұлшықет жиырылу биофизикасы Измерение атмосферного давления. Барометр - анероид (урок 39)
Измерение атмосферного давления. Барометр - анероид (урок 39) Электромагнитные колебания. (Лекция 28)
Электромагнитные колебания. (Лекция 28) Электродвижущие силы при несинусоидальном поле
Электродвижущие силы при несинусоидальном поле Кручение стержней некруглого сечения
Кручение стержней некруглого сечения Магнитные наносистемы и наноматериалы
Магнитные наносистемы и наноматериалы система конструирования отопительных устройств
система конструирования отопительных устройств Презентация по физике "Електричний струм в рідинах" - скачать бесплатно
Презентация по физике "Електричний струм в рідинах" - скачать бесплатно Пути прохождения электрического тока через тело человека
Пути прохождения электрического тока через тело человека Три состояния вещества
Три состояния вещества Презентация по физике "Кинематика материальной точки." - скачать _
Презентация по физике "Кинематика материальной точки." - скачать _