Содержание
- 2. Металлы IIA группы периодической системы химических элементов Д.И. Менделеева Перечислите химические элементы II A группы, дайте
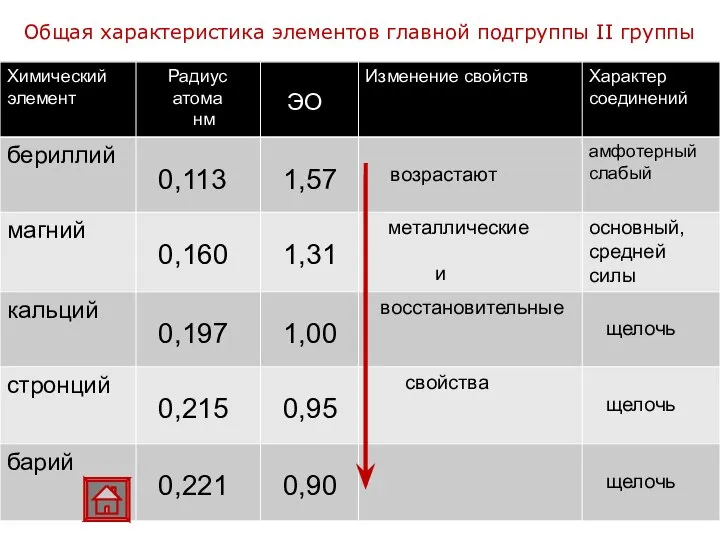
- 3. Общая характеристика элементов главной подгруппы II группы
- 4. Бериллий История открытия бериллия Бериллий – химический элемент 1. Положение в периодической системе химических элементов Д.И.Менделеева.
- 5. Бериллий относится к редким элементам, его содержание в земной коре 2,6·10–4 % по массе. В морской
- 6. Бериллий — относительно твердый, но хрупкий металл серебристо-белого цвета. На воздухе активно покрывается стойкой оксидной плёнкой
- 7. 1) В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
- 8. Металлический бериллий относительно мало реакционноспособен при комнатной температуре. В компактном виде он не реагирует с водой
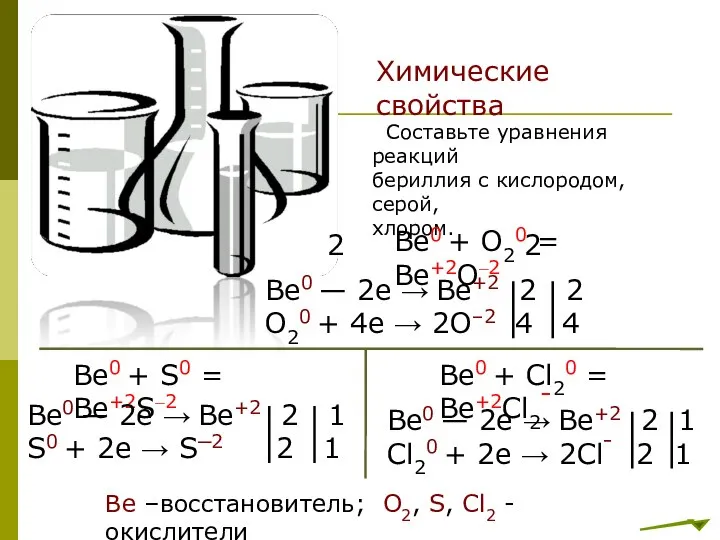
- 9. Химические свойства Составьте уравнения реакций бериллия с кислородом, серой, хлором. Be0 + O20 = Be+2O–2 2
- 10. Составьте уравнения реакции бериллия с раствором соляной кислоты. Рассмотрите с точки зрения теории электролитической диссоциации. Be
- 11. Соединения бериллия Оксид бериллия ВеО характер оксида амфотерный Составьте уравнения реакций, с помощью которых можно доказать
- 12. гидроксид бериллия Ве(ОН)2 характер гидрооксида амфотерный К раствору хлорида бериллия по каплям добавляют раствор гидроксида натрия.
- 13. магний История открытия Магний – химический элемент Положение в периодической системе химических элементов 2) Строение атома
- 14. Магний — металл серебристо-белого цвета. При обычных условиях поверхность магния покрыта прочной защитной плёнкой оксида магния
- 15. Обычный промышленный метод получения металлического магния — это электролиз расплава. В расплаве электрохимическому восстановлению подвергается хлорид
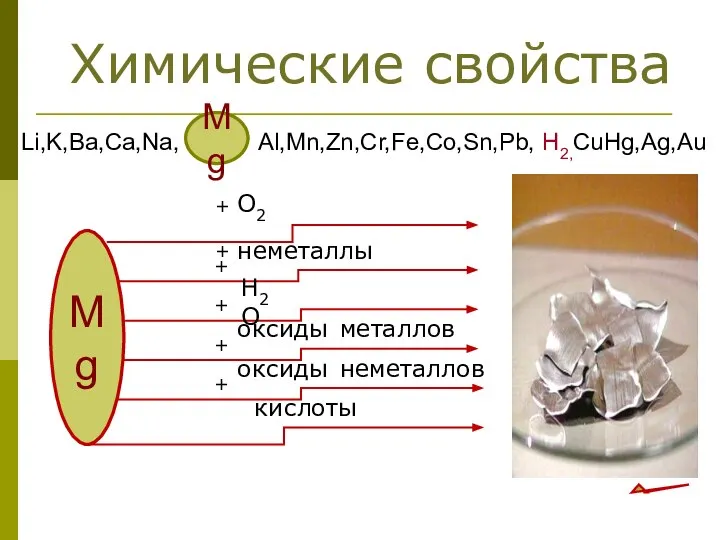
- 16. Химические свойства Li,K,Ba,Ca,Na, Al,Mn,Zn,Cr,Fe,Co,Sn,Pb, H2,CuHg,Ag,Au Mg Mg + O2 + неметаллы + + Н2О + +
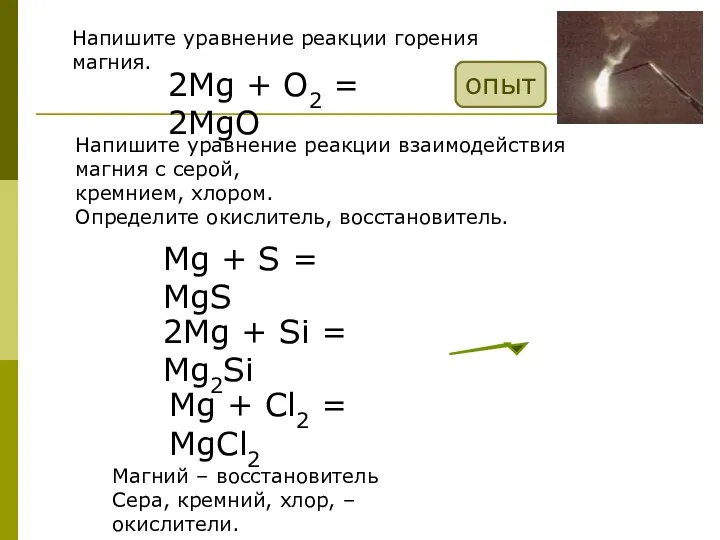
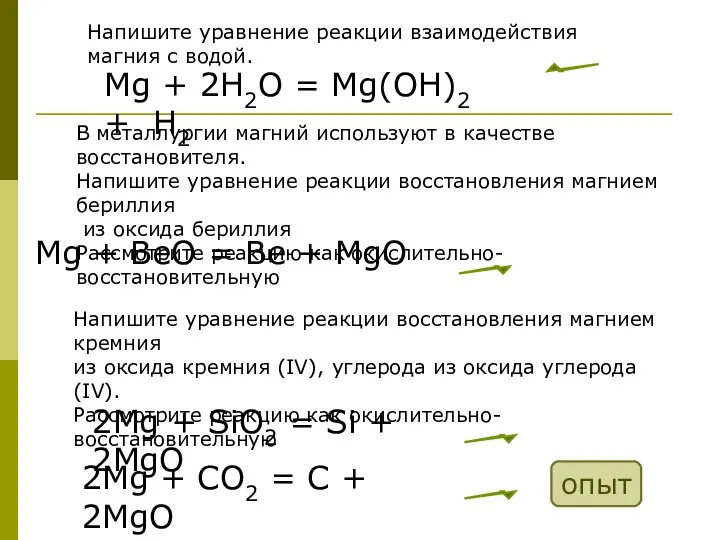
- 17. Напишите уравнение реакции горения магния. 2Mg + O2 = 2MgO Напишите уравнение реакции взаимодействия магния с
- 18. Соединения металлов с кремнием называются силицидами. Силицид магния - порошок черного цвета. При взаимодействии силицида магния
- 19. Напишите уравнение реакции взаимодействия магния с водой. Mg + 2Н2О = Mg(OН)2 + Н2 В металлургии
- 20. Mg0 ― 2e → Mg+2 2 1 Be+2 + 2e → Be0 2 1 Магний –
- 21. Напишите уравнения реакций взаимодействия магния с соляной и разбавленной серной кислотами. Рассмотрите с точки зрения ОВР
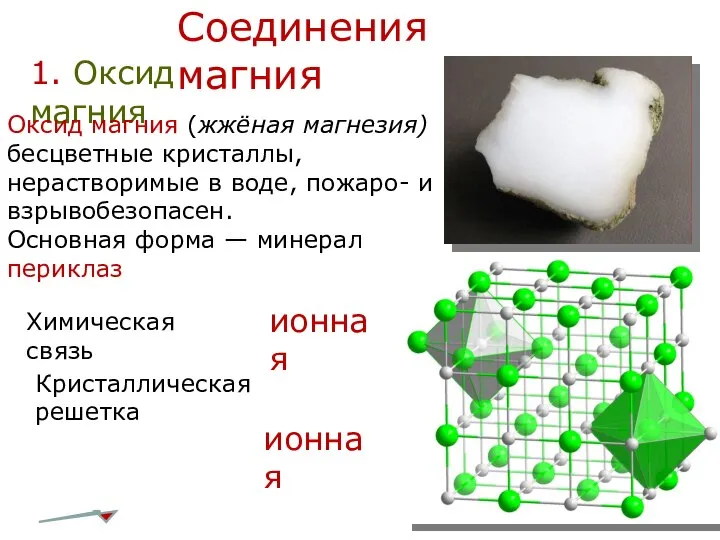
- 22. Соединения магния 1. Оксид магния Оксид магния (жжёная магнезия) бесцветные кристаллы, нерастворимые в воде, пожаро- и
- 23. Физические свойства Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение
- 24. Оксид магния MgО Оксид магния солеобразующий, основный Перечислите свойства характерные для основных оксидов. Составьте уравнения реакций
- 25. Mg(ОН)2 Гидроксид магния При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы. Встречается в природе в
- 26. MgCl2 + 2NaOH = Mg(OH)2 + 2NaCl Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3 Mg2+ +
- 27. Химические свойства При температуре выше 350°C разлагается на оксид магния и воду. Mg(OH)2 = MgO +
- 28. В жестких условиях образует гидроксокомплексы. Взаимодействие с горячими концентрированными растворами щелочей с образованием гидроксомагнезатов: Mg(OH)2 +
- 29. на основе магния являются важным конструкционным материалом в авиационной и автомобильной промышленности благодаря их лёгкости и
- 30. Биологическая роль: магний — биогенный элемент, постоянно присутствующий в тканях всех организмов. Он входит в состав
- 31. В промышленности применяется для производства огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве резины. В медицине
- 32. Гидроксид магния используется в качестве пищевой добавки, для связывания диоксида серы, как флокулянт для очистки сточных
- 33. кальций История открытия Кальций – химический элемент 1) Положение в периодической системе химических элементов 2) Строение
- 34. Нахождение в природе Кальций — один из наиболее распространенных на Земле элементов. На его долю приходится
- 35. Температура плавления кальция 839 °C, температура кипения 1484 °C, плотность 1,55 г/см3. Химическая активность кальция высока,
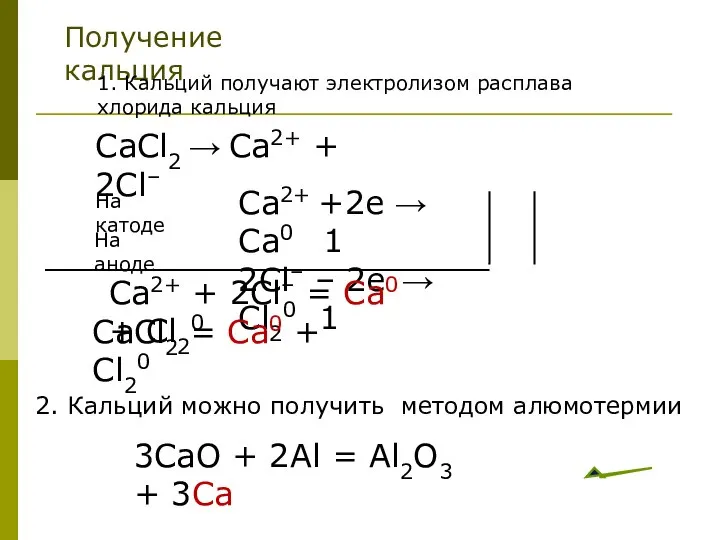
- 36. Получение кальция 1. Кальций получают электролизом расплава хлорида кальция CaCl2 → Сa2+ + 2Cl– Ca2+ +2e
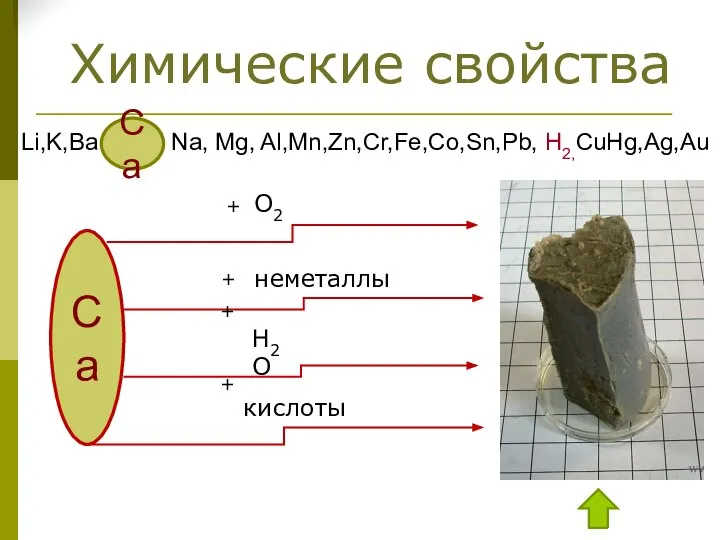
- 37. Химические свойства Li,K,Ba Na, Mg, Al,Mn,Zn,Cr,Fe,Co,Sn,Pb, H2,CuHg,Ag,Au Ca Ca + O2 + неметаллы + Н2О +
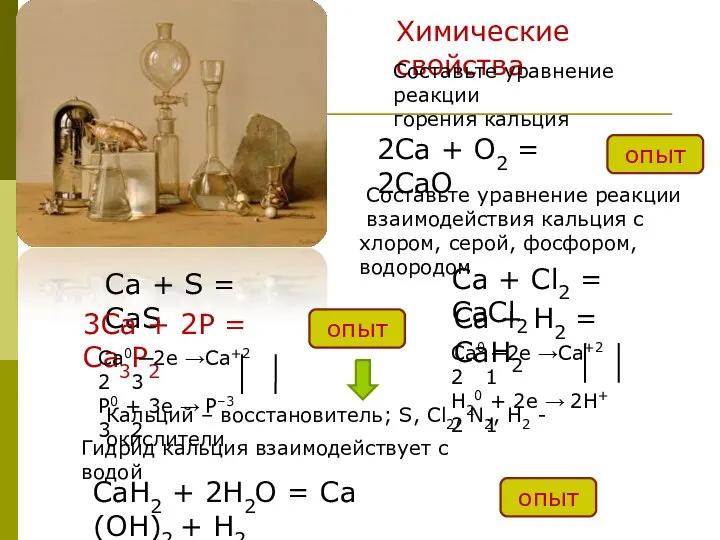
- 38. Химические свойства 2Ca + О2 = 2СаО Составьте уравнение реакции горения кальция Составьте уравнение реакции взаимодействия
- 39. Фосфид кальция взаимодействует с водой. Выделяется газ фосфин с примесями дифосфина (Р2Н4). Происходит самовозгорание дифосфина. Фосфин
- 40. Оксид кальция CaO - белое тугоплавкое вещество, называется негашеной или жженой известью. Соединения кальция 1. Оксид
- 41. Гидроксид кальция Са(ОН)2 Перечислите свойства характерные для растворимых оснований. Составьте уравнения реакций гидроксида кальция с оксидом
- 42. Главное применение кальция - это использование его как восстановителя при получении металлов, особенно никеля, меди и
- 43. Оксид кальция - наиболее важный промышленный продукт, служащий исходным сырьем для производства других полезных соединений кальция.
- 44. Сульфат кальция CaSO4 существует в природе в виде минерала ангидрита. Дигидрат CaSO4·2H2O является важным промышленным минералом,
- 45. Галогениды. Хлорид кальция CaCl2 получают из природных насыщенных соляных вод (рапы). Его можно получить также по
- 46. Хлорная (белильная) известь. Состав этого вещества в основном соответствует формуле CaOCl2 (сложная смесь хлорида и гипохлорита
- 48. Скачать презентацию




































 Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила поведения зимой на воде
Правила поведения зимой на воде  Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ
Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Камень, скользящий на льду
Камень, скользящий на льду Химия
Химия Олигомеризация олефинов
Олигомеризация олефинов Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть
Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть  История возникновения химии
История возникновения химии Пластмассы. Классификация
Пластмассы. Классификация Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6)
Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6) Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде
Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде Углеводы
Углеводы  Каталитический риформинг
Каталитический риформинг Природний газ
Природний газ Химиялық қару
Химиялық қару Ферменты. Часть I
Ферменты. Часть I Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Технология пластических масс на основе поликонденсационных смол
Технология пластических масс на основе поликонденсационных смол Синтез и исследование метилольных и хлорметильных производных аллантоина
Синтез и исследование метилольных и хлорметильных производных аллантоина Нанохимия, как наука
Нанохимия, как наука Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Производство серной кислоты
Производство серной кислоты Основания. Простые и сложные ионы
Основания. Простые и сложные ионы