Содержание
- 2. Разбалловка вопросов Вопросы ЕГЭ - 2019
- 3. Методические материалы для председателей и членов предметных комиссий субъектов Российской Федерации по проверке выполнения заданий с
- 4. Задание 34 Это расчетные задачи. Примерное время выполнения 10-15 минут!!! Выполнение этого задания требует знания химических
- 5. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: если допущена ошибка хотя бы в одном
- 6. Рекомендации по оцениванию отдельных элементов ответа и решению возможных проблемных ситуаций В случае наличия в ответе
- 7. Пример задачи типа №34 Медный купорос массой 100 г растворили в воде и получили раствор с
- 8. Пример задачи типа №34 В 684 г 10%-ного раствора сульфата алюминия добавили 560 г 10%-ного раствора
- 9. Способы разрушения гидроксокомплексов 1. При действии избытка сильной кислоты получаются две средние соли и вода: Na[Al(OH)4]
- 10. Способы разрушения гидроксокомплексов 2. При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный
- 11. Способы разрушения гидроксокомплексов 3. При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и
- 12. Способы разрушения гидроксокомплексов 4. При действии СО2 и SО2 получаются кислая соль активного металла и амфотерный
- 13. Способы разрушения гидроксокомплексов 5. При действии солей, образованных сильными кислотами и катионами Fe3+,А13+, Cr3+, происходит усиление
- 15. Скачать презентацию












 VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии
VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии Неорганические вещества. Оксиды, кислоты, соли, основания
Неорганические вещества. Оксиды, кислоты, соли, основания Промышленный биокатализ
Промышленный биокатализ Презентация по Химии "Вещества и их превращения. Роль химии в нашей жизни" - скачать смотреть
Презентация по Химии "Вещества и их превращения. Роль химии в нашей жизни" - скачать смотреть  Классификации, номенклатура, строение и свойства органических соединений
Классификации, номенклатура, строение и свойства органических соединений Тест по теме Алкины
Тест по теме Алкины Методы выращивания GaAs. Сравнение
Методы выращивания GaAs. Сравнение Соли аммония
Соли аммония Рубин и сапфир. Изумруд и аквамарин. Кварц
Рубин и сапфир. Изумруд и аквамарин. Кварц Общая характеристика элементов IIIA-группы. Бор. Алюминий
Общая характеристика элементов IIIA-группы. Бор. Алюминий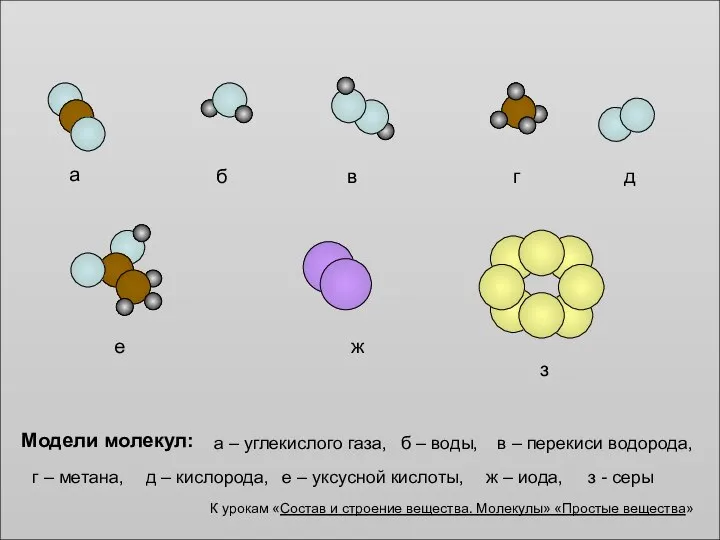 Состав и строение вещества. Молекулы
Состав и строение вещества. Молекулы Магний. Биологическая роль
Магний. Биологическая роль Неорганическая химия 8 класс г. Азов школа №9 учитель: Карасёв Евгений Владимирович
Неорганическая химия 8 класс г. Азов школа №9 учитель: Карасёв Евгений Владимирович  Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение
Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение  Электрохимические методы в радиохимии
Электрохимические методы в радиохимии Лекция 2. Физико-химические основы строения пластов
Лекция 2. Физико-химические основы строения пластов Искусственные или технические битумы
Искусственные или технические битумы Периодическая система Д.И. Менделеева (Занятие 3)
Периодическая система Д.И. Менделеева (Занятие 3) Спектроскопия лазерных кристаллов
Спектроскопия лазерных кристаллов Алкины
Алкины Ферменты гидролиза и биосинтеза нуклеиновых кислот
Ферменты гидролиза и биосинтеза нуклеиновых кислот Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум
Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум Решение задач на долю вещества в растворе с участием кристаллогидратов
Решение задач на долю вещества в растворе с участием кристаллогидратов Яблоки и здоровье человека
Яблоки и здоровье человека Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Многоатомные спирты
Многоатомные спирты Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Тотығу стрестің өсімдіктерге әсері
Тотығу стрестің өсімдіктерге әсері