Содержание
- 2. ПЛАН ЛЕКЦИИ Классификация (электронная версия) Номенклатура (электронная версия) Теория химического строения Типы гибридизации, конформации Виды связей
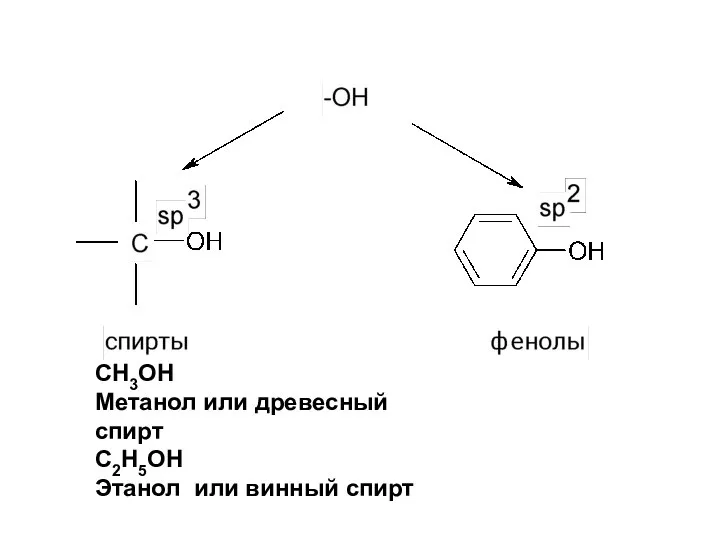
- 4. СН3ОН Метанол или древесный спирт С2Н5ОН Этанол или винный спирт
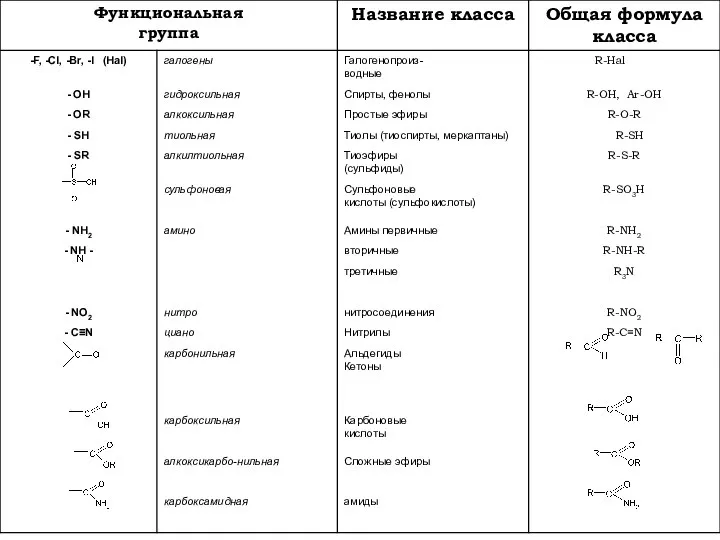
- 6. Тривиальные и номенклатурные названия альдегидов Тривиальные номенклатурные формальдегид метаналь уксусный альдегид этаналь пропионовый альдегид пропаналь масляный
- 7. Тривиальные и номенклатурные названия монокарбоновых кислот и их солей НСООН муравьиная /метановая формиаты СН3СООН уксусная/этановая ацетаты
- 8. Тривиальные и номенклатурные названия дикарбоновых кислот и их солей НООС-СООН щавелевая/этандиовая оксалаты НООС-СН2-СООН малоновая/пропандиовая малоаты НООС-СН2-СН2-
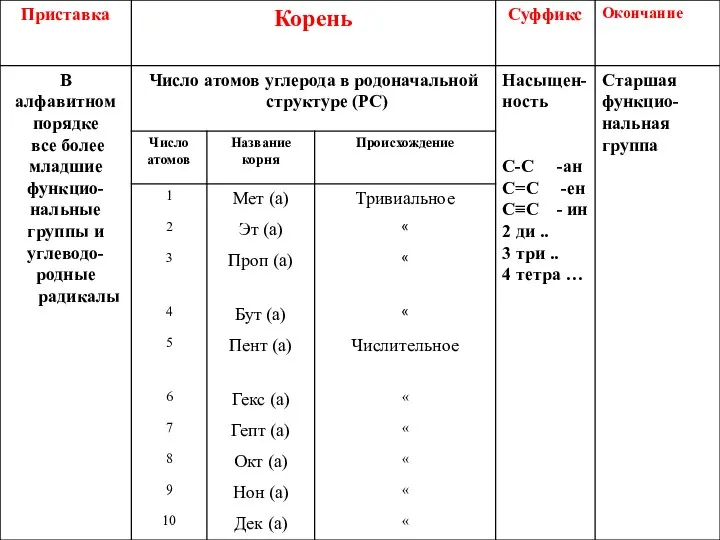
- 9. Заместительная систематическая номенклатура органических соединений (IUPAC)
- 12. 3.Химическое строение органических соединений 1.Типы гибридизации атомов. Конформации молекул
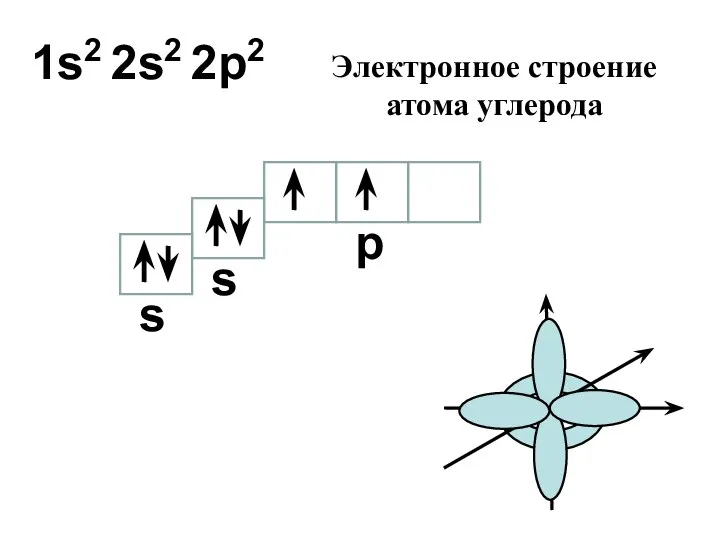
- 13. 1s2 2s2 2p2 s s p Электронное строение атома углерода
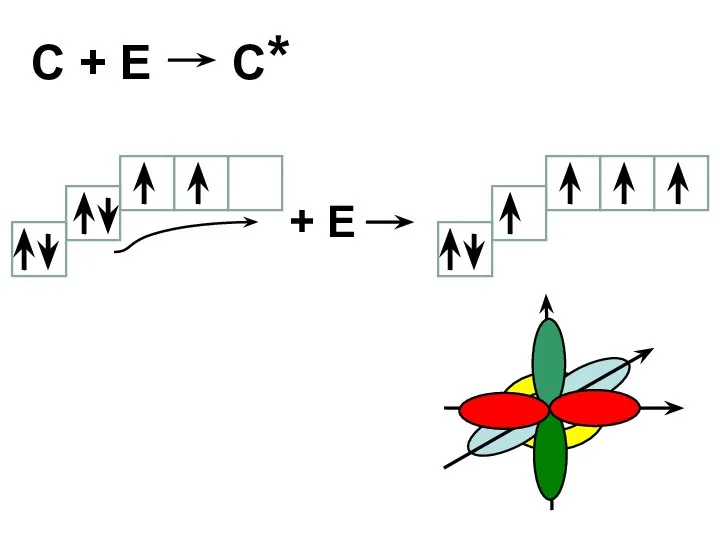
- 14. C + E C* + E
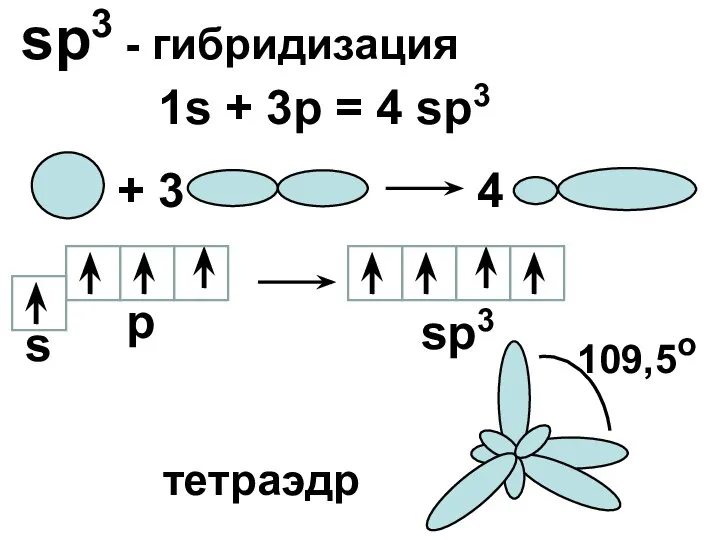
- 15. sp3 - гибридизация 1s + 3p = 4 sp3 + 3 4 s p sp3 109,5o
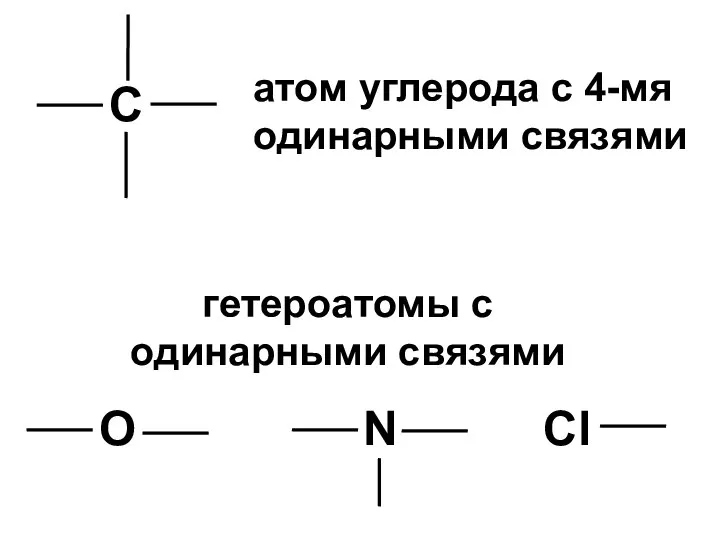
- 16. С атом углерода с 4-мя одинарными связями гетероатомы с одинарными связями О N Cl
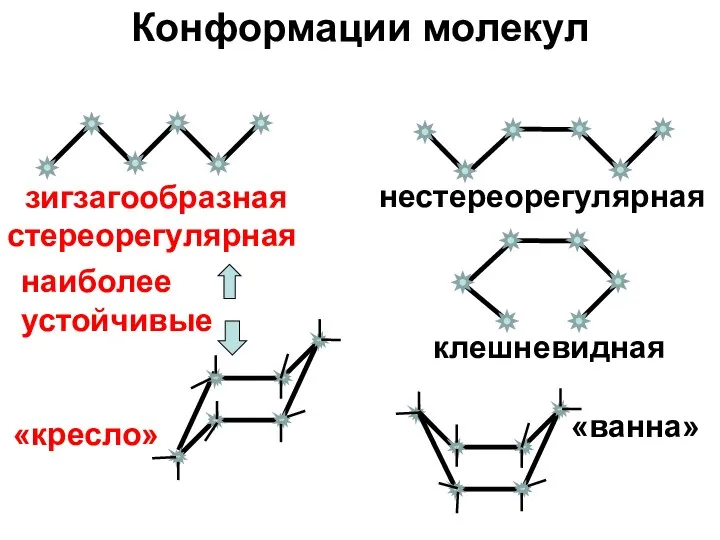
- 17. Конформации молекул зигзагообразная стереорегулярная клешневидная нестереорегулярная «кресло» «ванна» наиболее устойчивые
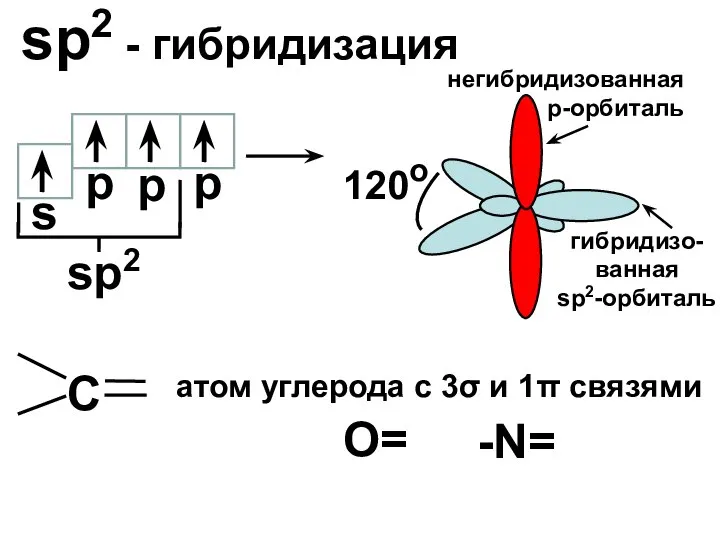
- 18. sp2 - гибридизация s p sp2 120o p p негибридизованная р-орбиталь гибридизо-ванная sp2-орбиталь С атом углерода
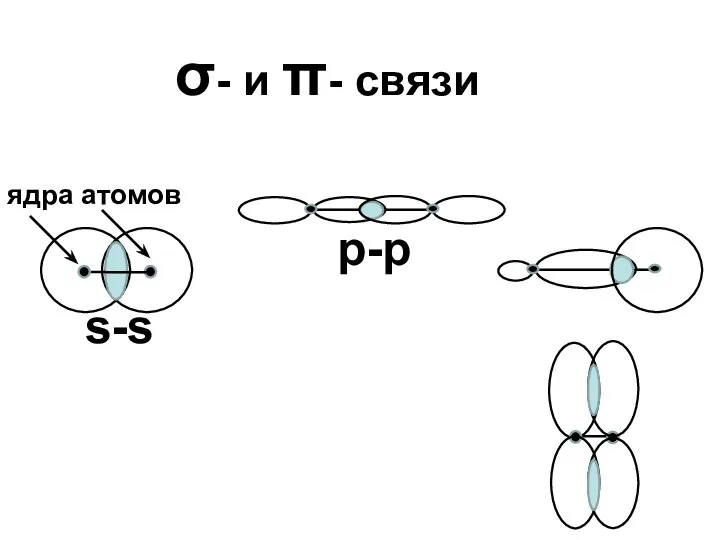
- 19. σ- и π- связи s-s ядра атомов р-р
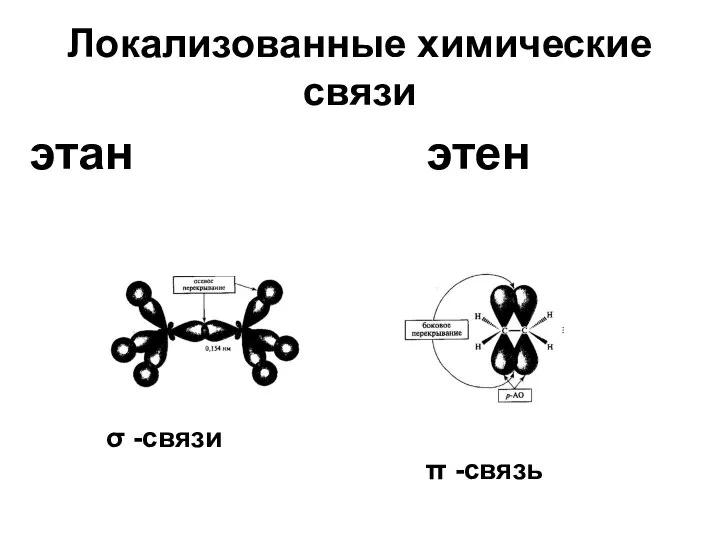
- 20. Локализованные химические связи этан этен σ -связи π -связь
- 21. Явление сопряжения
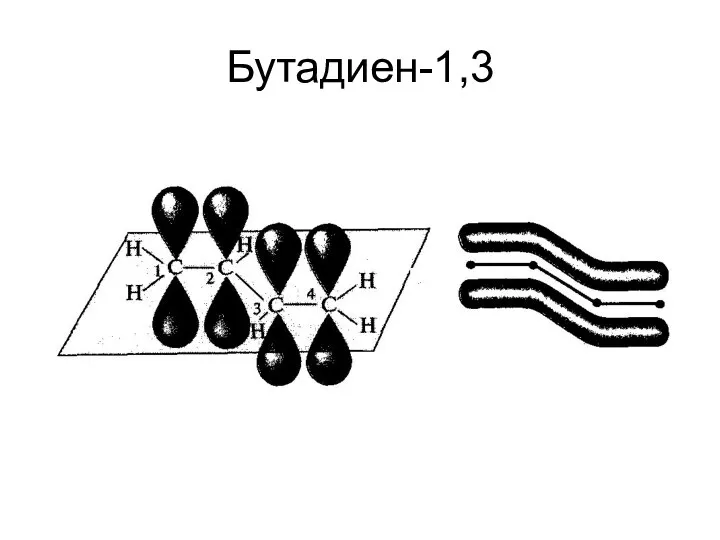
- 22. Бутадиен-1,3
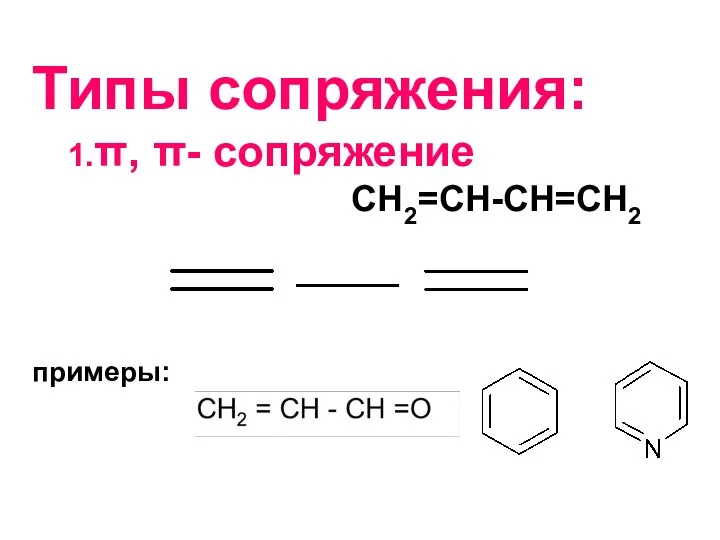
- 23. Типы сопряжения: 1.π, π- сопряжение СН2=СН-СН=СН2 примеры:
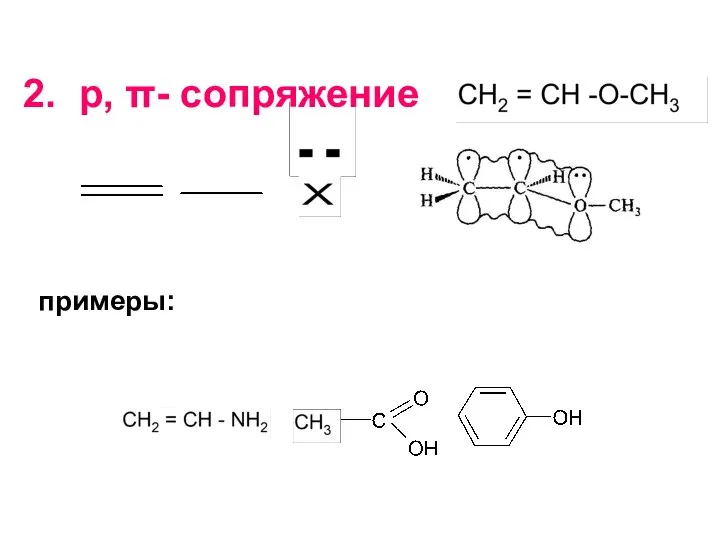
- 24. примеры: 2. р, π- сопряжение
- 25. Число электронов в сопряжении: π-связь предоставляет 2 электрона, гетероатом в р,π-сопряжении также предоставляет 2 электрона
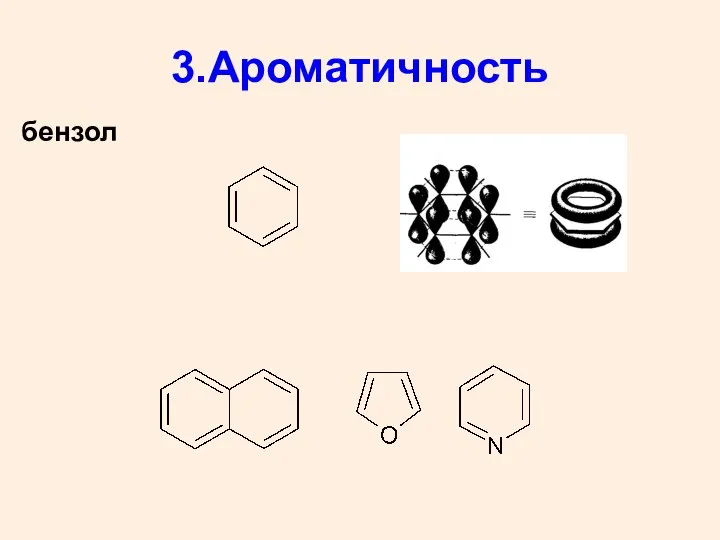
- 26. 3.Ароматичность бензол
- 27. Структурные признаки ароматичности плоскостное строение цикла (все атомы в sp2 – гибридном состоянии); замкнутая π-сопряженная система
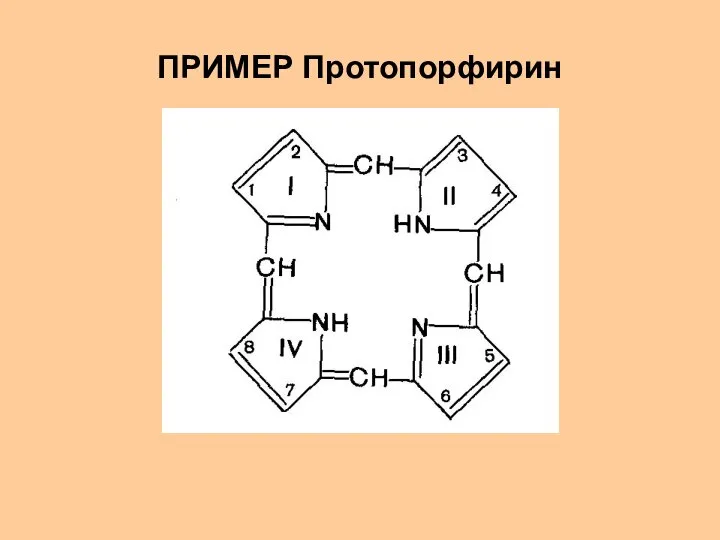
- 28. ПРИМЕР Протопорфирин
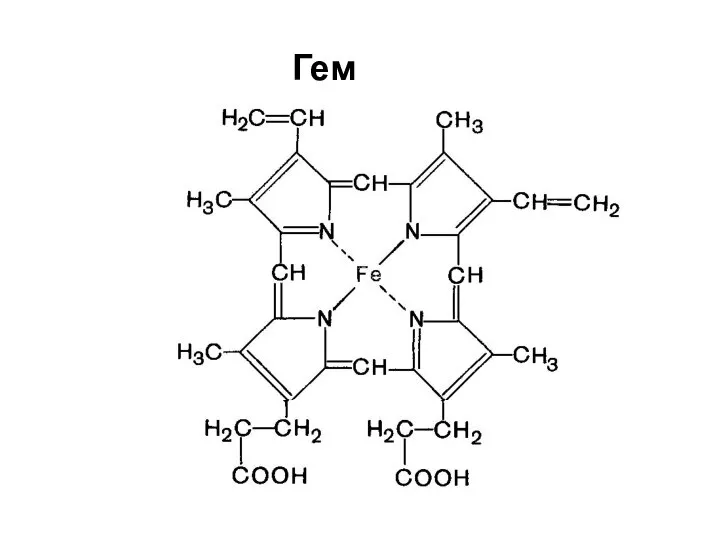
- 29. Гем
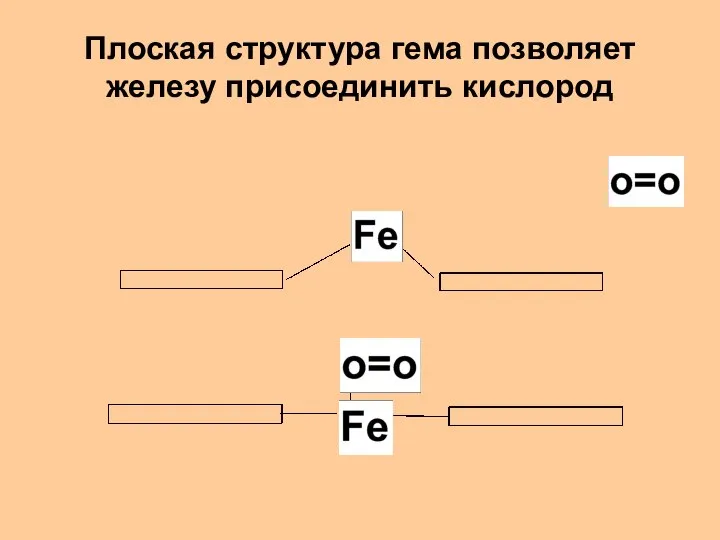
- 30. Плоская структура гема позволяет железу присоединить кислород
- 31. Взаимное влияние атомов в органических молекулах
- 32. Индуктивный электронный эффект (±I) Сравнительная электроотрицательность F> O > N > Csp > Csp2 > Csp3
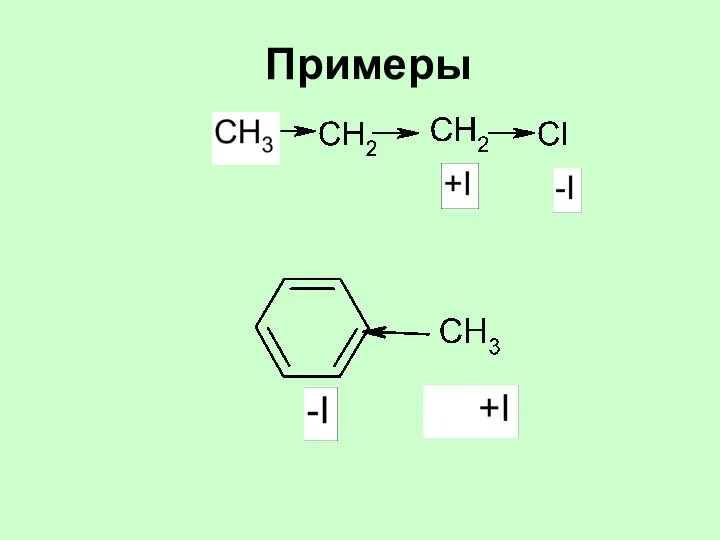
- 33. Примеры
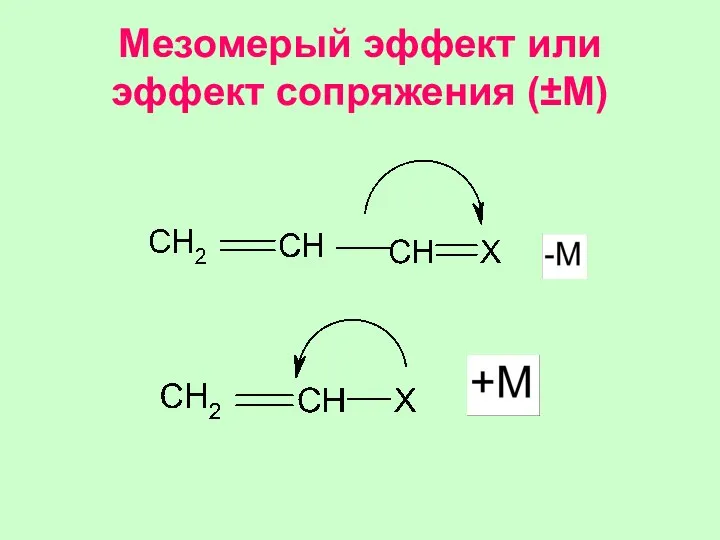
- 34. Мезомерый эффект или эффект сопряжения (±M)
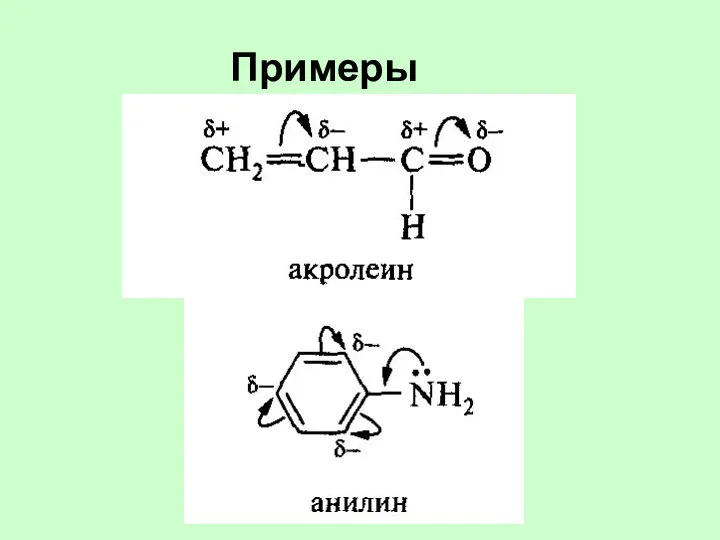
- 35. Примеры
- 36. Электронный эффекты заместителей
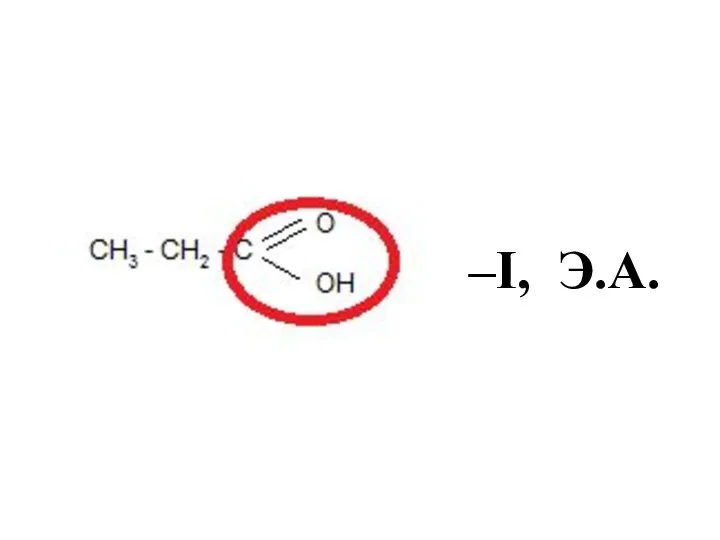
- 37. Функциональные группы как электронодоноры или электроноакцепторы -I , Э.А.
- 38. –I, Э.А.
- 39. -I,
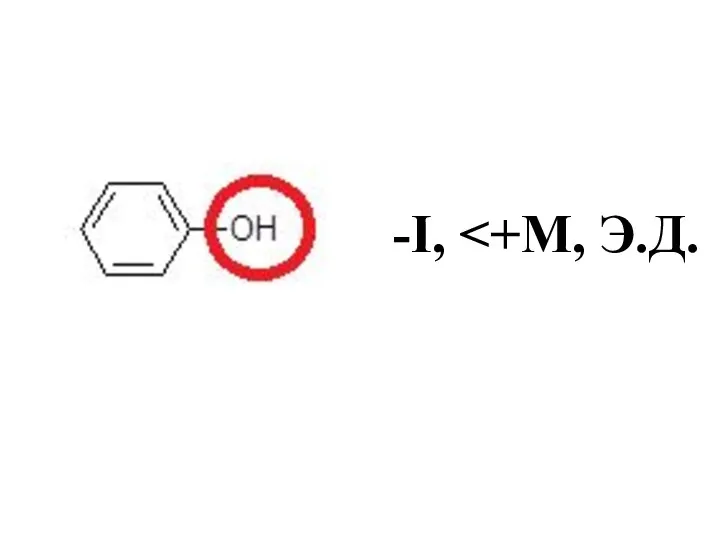
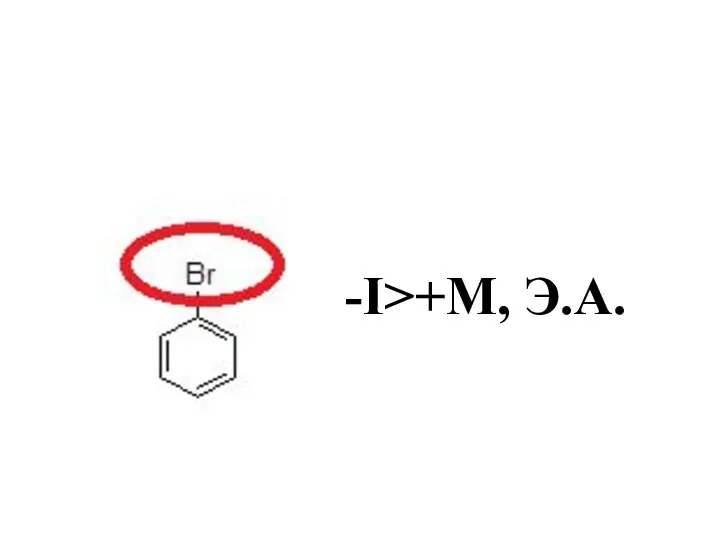
- 40. -I>+М, Э.А.
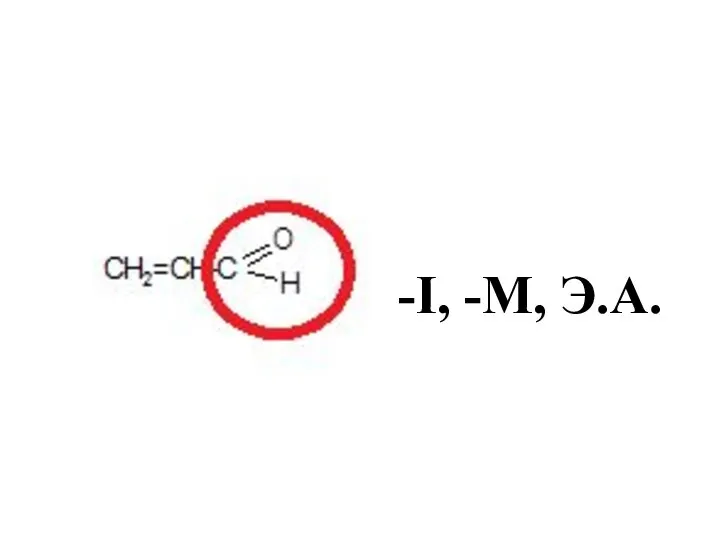
- 41. -I, -М, Э.А.
- 43. -I, -I,
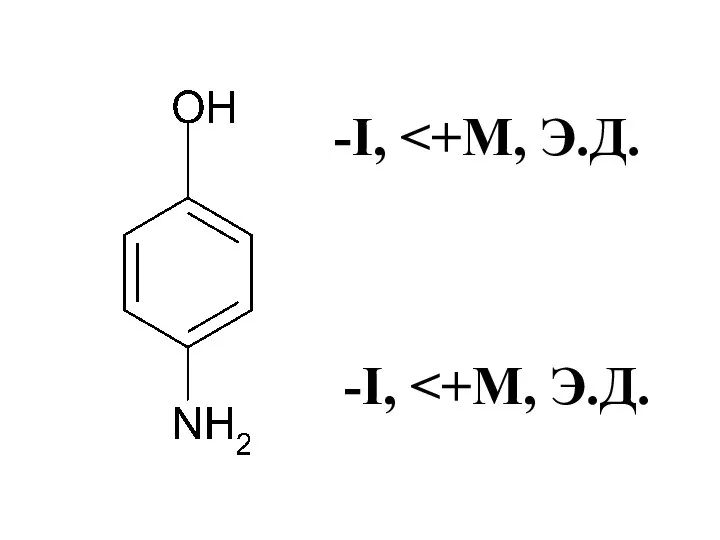
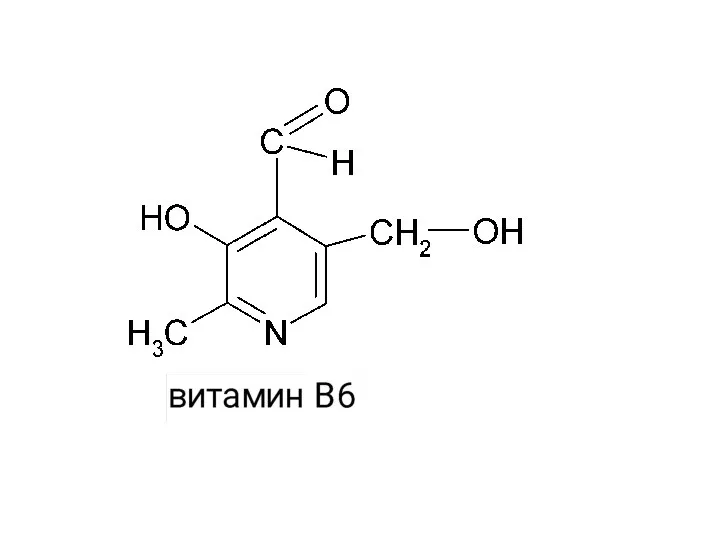
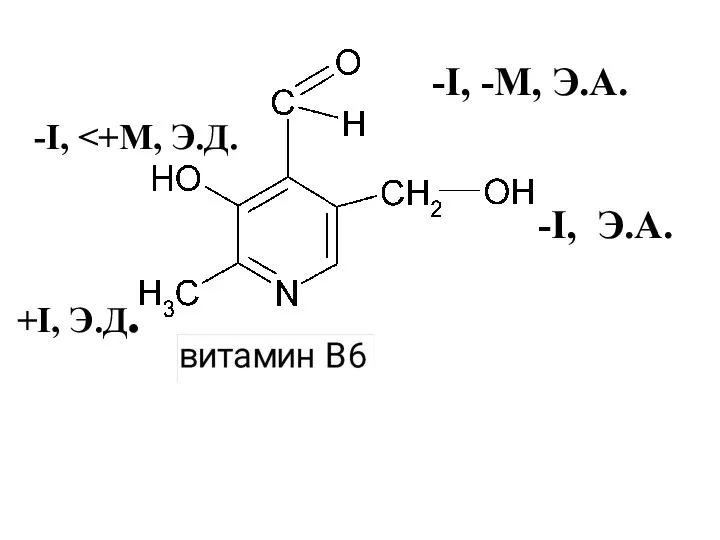
- 45. -I, -I, -М, Э.А. +I, Э.Д. -I, Э.А.
- 47. Реакционная способность органических соединений
- 48. Виды химических реакций I.Кислотно-основные II. Характерные реакции органических соединений Окислительно-восстановительные реакции III. IV. Качественные реакции
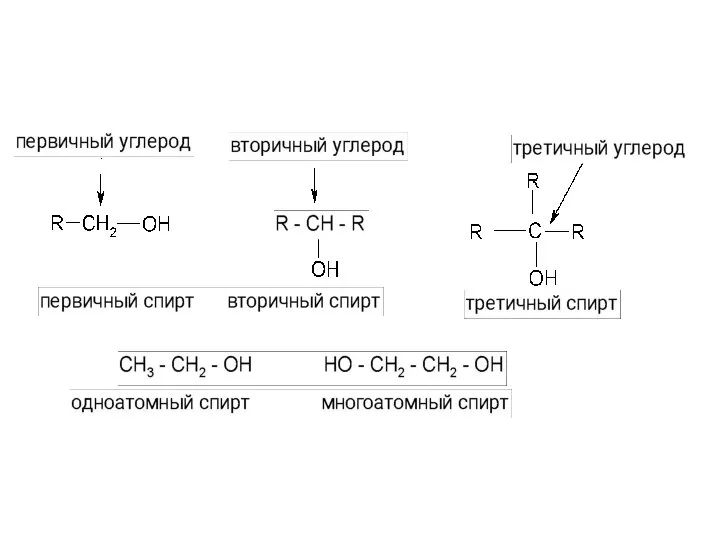
- 49. I. Кислотно-основные свойства органических соединений Кислота R-XH Кислотный центр -ХН -SH, -OH, -NH, -CH Основание H-X
- 50. R – XH = R-X- + H+ кислота сопряженное основание (анион) Усиливают кислотность: сопряжение с кислотным
- 51. карбоновые кислоты> фенолы > тиолы > многоатомные спирты> одноатомные спирты > амины
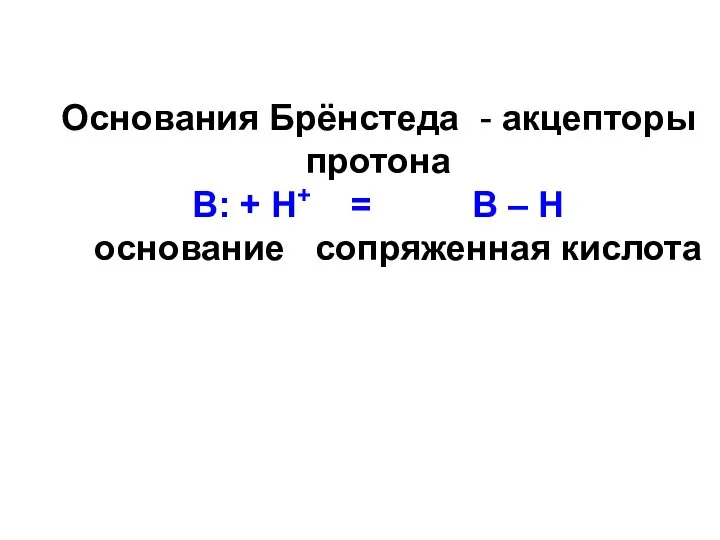
- 52. Основания Брёнстеда - акцепторы протона В: + Н+ = В – Н основание сопряженная кислота
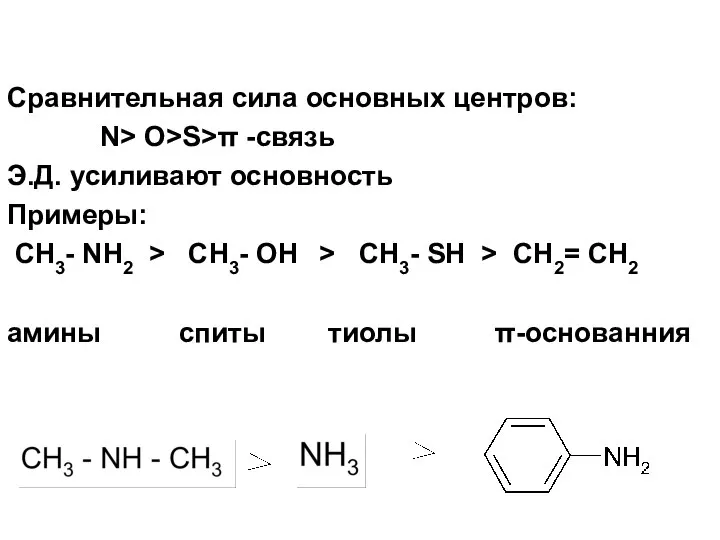
- 53. Сравнительная сила основных центров: N> O>S>π -связь Э.Д. усиливают основность Примеры: CH3- NH2 > CH3- OH
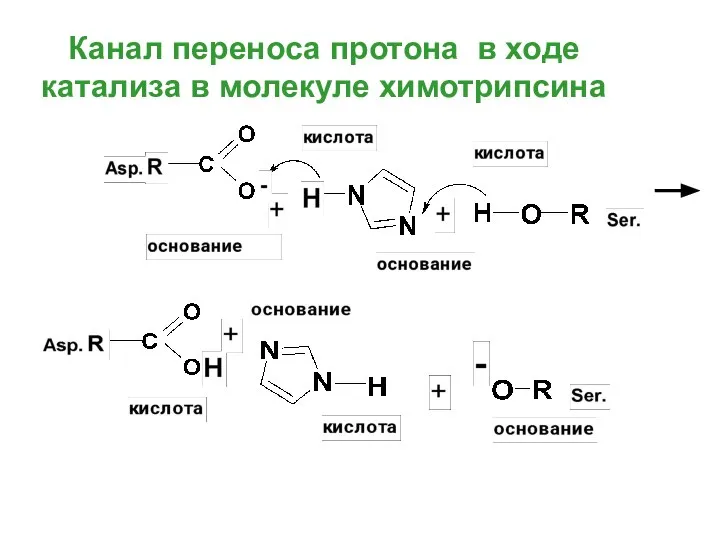
- 54. Канал переноса протона в ходе катализа в молекуле химотрипсина
- 55. Характерные реакции органических соединений
- 56. Основные понятия Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции
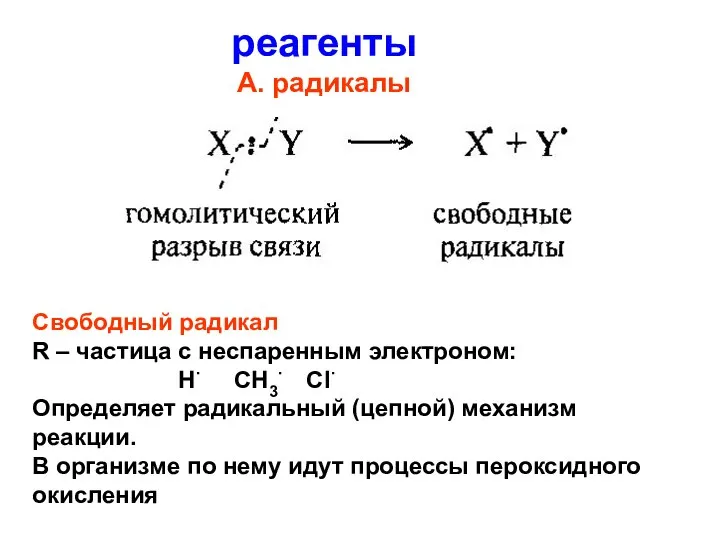
- 57. реагенты А. радикалы Свободный радикал R – частица с неспаренным электроном: Н∙ СН3∙ Сl∙ Определяет радикальный
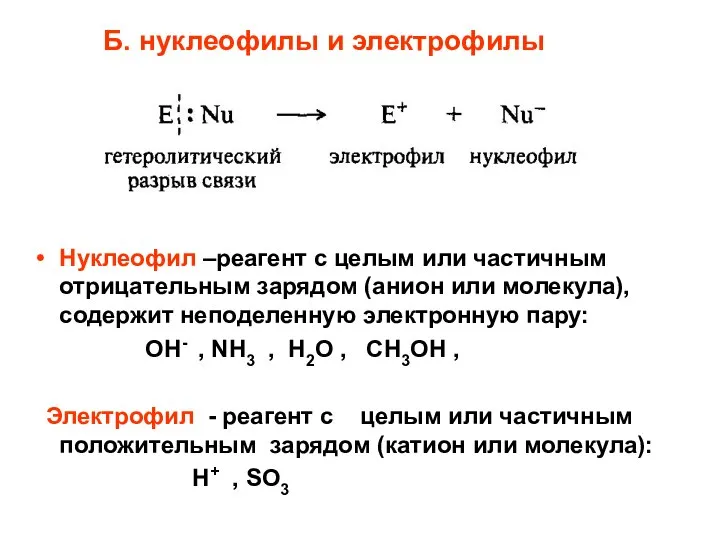
- 58. Б. нуклеофилы и электрофилы Нуклеофил –реагент с целым или частичным отрицательным зарядом (анион или молекула), содержит
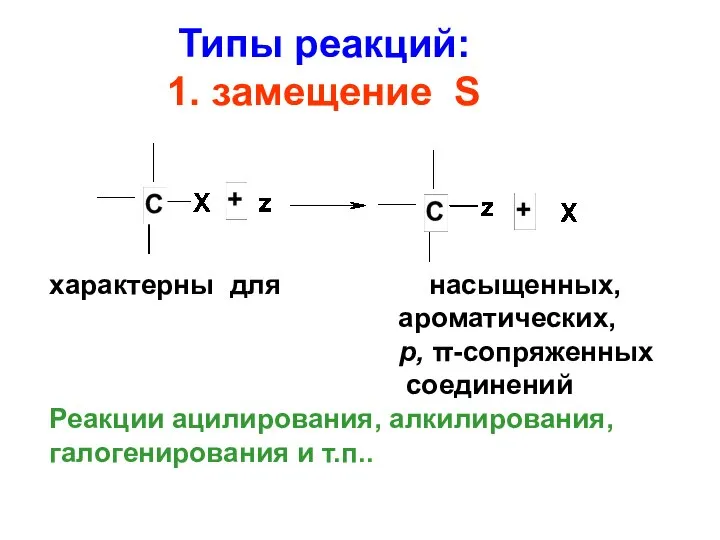
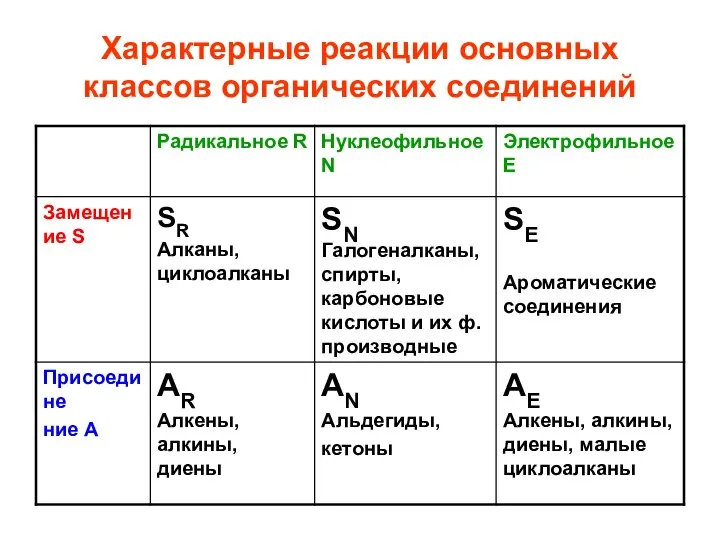
- 59. Типы реакций: 1. замещение S характерны для насыщенных, ароматических, р, π-сопряженных соединений Реакции ацилирования, алкилирования, галогенирования
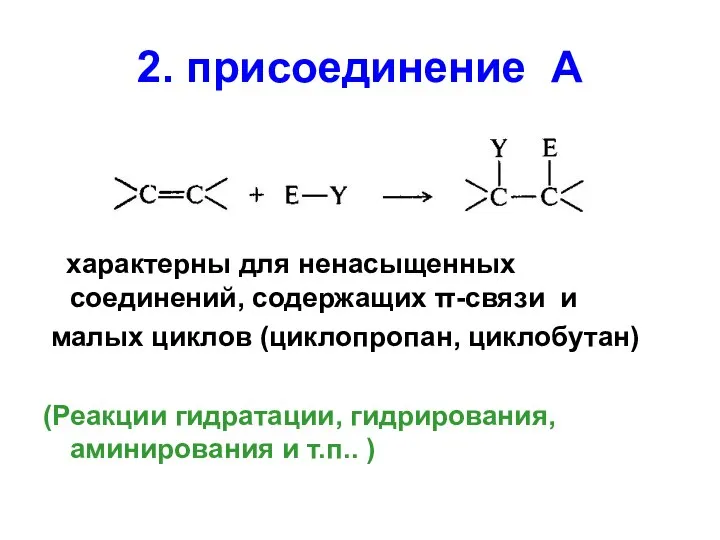
- 60. 2. присоединение А характерны для ненасыщенных соединений, содержащих π-связи и малых циклов (циклопропан, циклобутан) (Реакции гидратации,
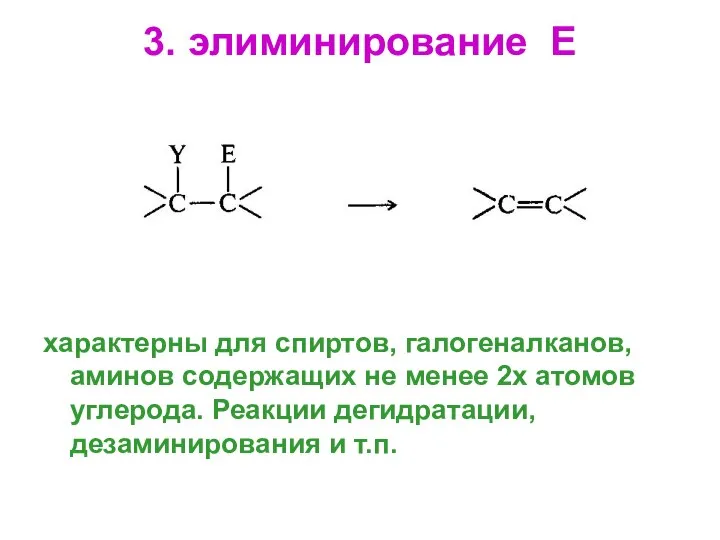
- 61. 3. элиминирование Е характерны для спиртов, галогеналканов, аминов содержащих не менее 2х атомов углерода. Реакции дегидратации,
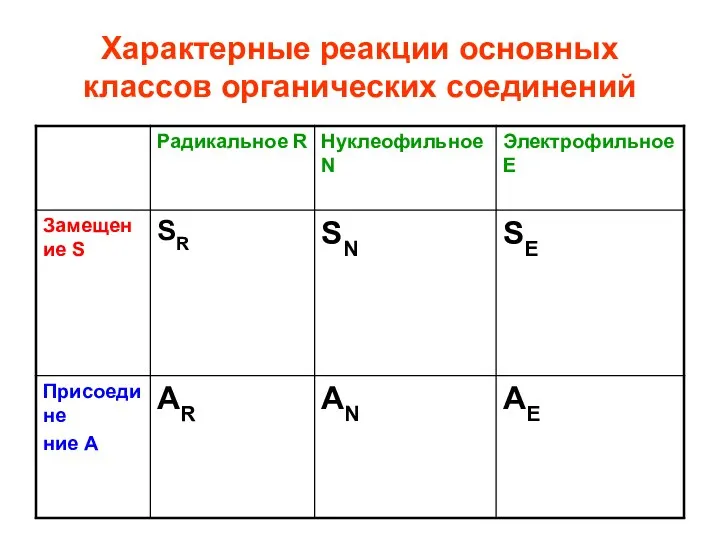
- 62. Характерные реакции основных классов органических соединений
- 63. Характерные реакции основных классов органических соединений
- 64. Электронодоноры активизируют субстрат в реакциях электрофильного замещения SE или присоединения AE Электроноакцепторы активизируют субстрат в реакциях
- 66. Скачать презентацию






















 Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Проект: «Мои любимые опыты с содой и уксусом»
Проект: «Мои любимые опыты с содой и уксусом» Каучук. Строение и применение
Каучук. Строение и применение Гетероароматичность. Пятичленные гетероциклы с одним гетероатомом. (Лекция 2)
Гетероароматичность. Пятичленные гетероциклы с одним гетероатомом. (Лекция 2) Глауконит
Глауконит Использование разнообразных форм и средств контроля за качеством образования на уроках химии
Использование разнообразных форм и средств контроля за качеством образования на уроках химии Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды
Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды Органические молекулы- углеводы
Органические молекулы- углеводы Крахмал и целлюлоза
Крахмал и целлюлоза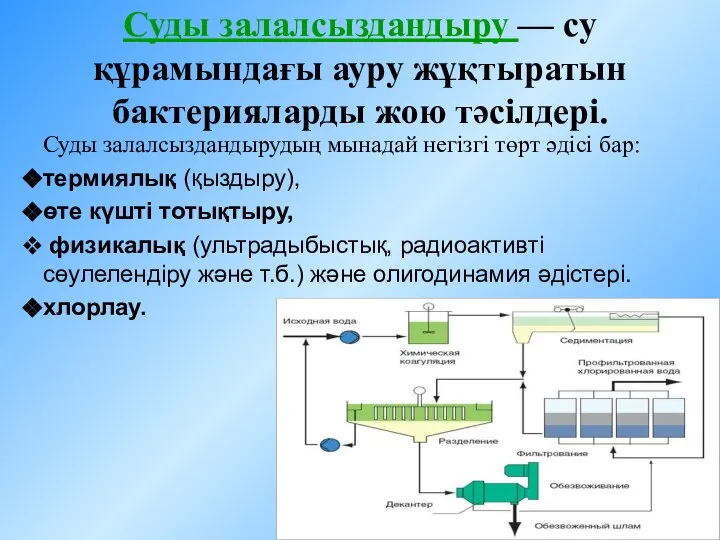 Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері
Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері Роль хімічних знань у пізнанні природи
Роль хімічних знань у пізнанні природи Амины. Номенклатура аминов
Амины. Номенклатура аминов Альдегидтер және кетондар
Альдегидтер және кетондар Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции
Липиды. Элементарный химический состав, содержание, строение, разнообразие, функции Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Биохимическая трансформация веществ (3)
Биохимическая трансформация веществ (3) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Химический элемент медь. (11 класс)
Химический элемент медь. (11 класс) Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Хімія в побуті
Хімія в побуті Презентация по химии Такой разный песок
Презентация по химии Такой разный песок  Одинокие атомы
Одинокие атомы Элементоорганические мономеры (соединения)
Элементоорганические мономеры (соединения) Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Сплавы
Сплавы