Содержание
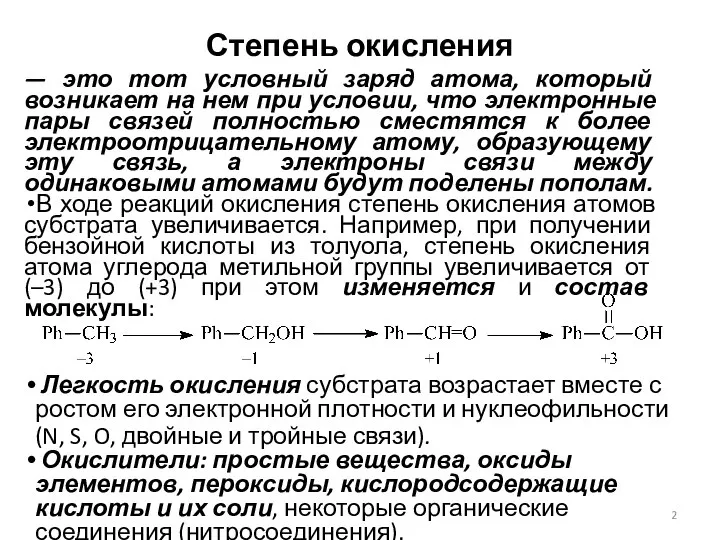
- 2. Степень окисления — это тот условный заряд атома, который возникает на нем при условии, что электронные
- 3. МЕТОДЫ ВОССТАНОВЛЕНИЯ И ОКИСЛЕНИЯ Выбор восстановителя или окислителя определяется целевым продуктом, видом сырья, экономическими факторами, технологичностью
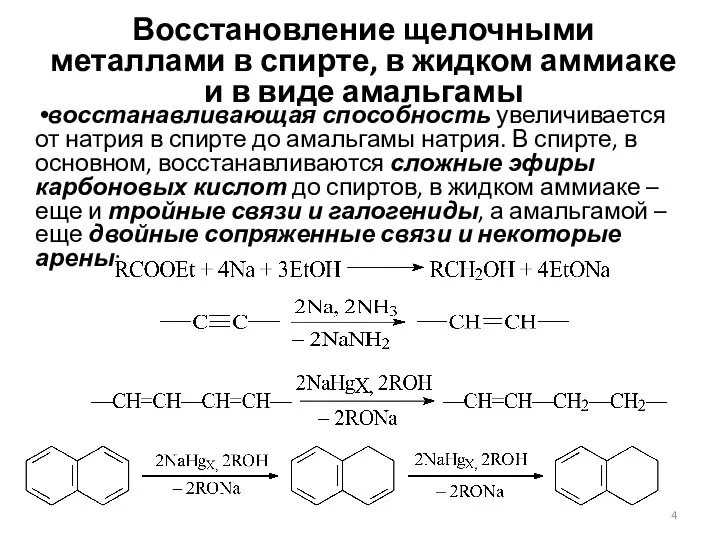
- 4. Восстановление щелочными металлами в спирте, в жидком аммиаке и в виде амальгамы восстанавливающая способность увеличивается от
- 5. Механизм восстановления натрием во всех случаях одинаков: атомы натрия отдают электроны, источником протонов является спирт, аммиак
- 6. Технология восстановления щелочными металлами в спирте, в жидком аммиаке и в виде амальгамы Методики восстановления простые,
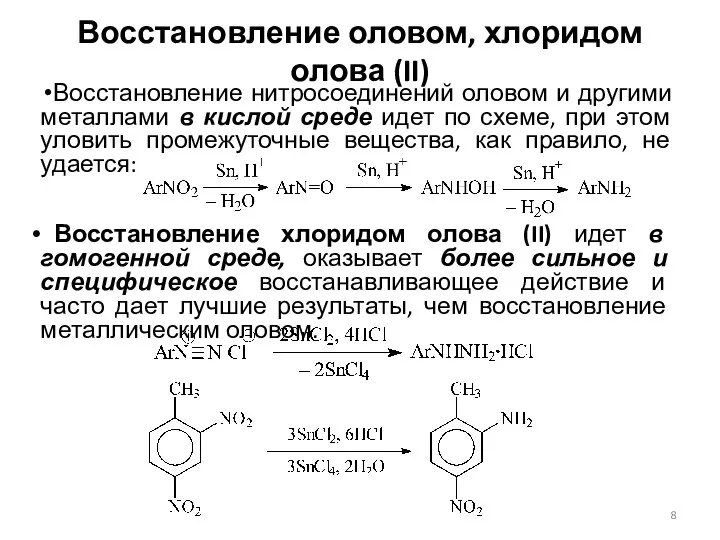
- 7. Восстановление оловом, хлоридом олова (II) и железом в кислой среде, цинком в кислой и щелочной средах
- 8. Восстановление оловом, хлоридом олова (II) Восстановление нитросоединений оловом и другими металлами в кислой среде идет по
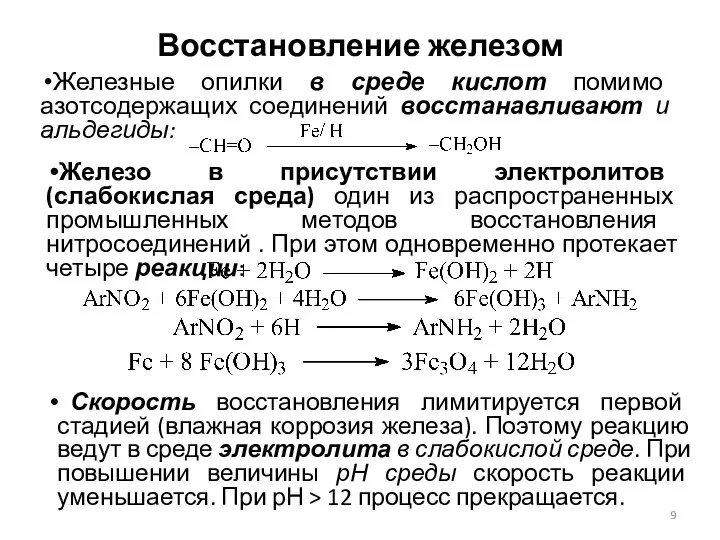
- 9. Восстановление железом Железные опилки в среде кислот помимо азотсодержащих соединений восстанавливают и альдегиды: Железо в присутствии
- 10. Технология восстановления железом в электролитах Электролиты (хлорид аммония, железа (II), и др.) можно получать в самом
- 11. Технология восстановления железом в электролитах В производстве восстановление проводят в стальных или чугунных аппаратах (редукторах), футерованных
- 12. Восстановление цинком более сильное восстанавливающее действие, чем у Fe в кислой среде цинком помимо азотсодержащих групп
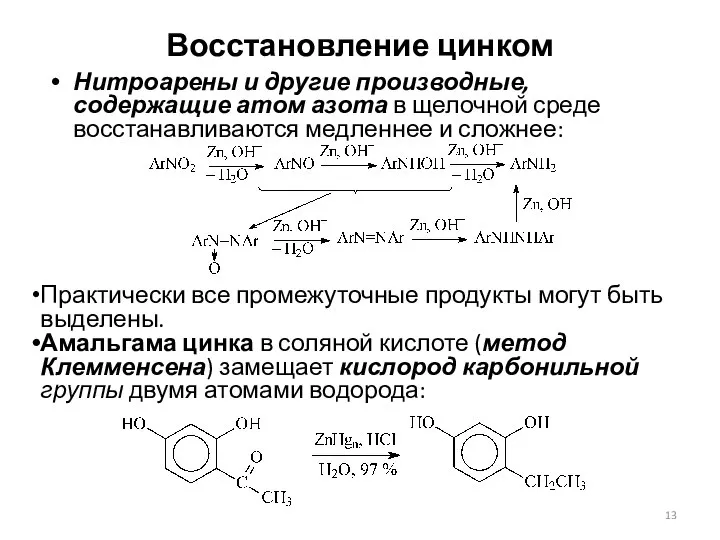
- 13. Восстановление цинком Нитроарены и другие производные, содержащие атом азота в щелочной среде восстанавливаются медленнее и сложнее:
- 14. Восстановление алкоголятами алюминия Методом Меервейна-Понндорфа-Верлея) восстанавливают карбонильные соединения в спирты, не затрагивая другие функциональные группы. Алюминий
- 15. Восстановление гидридами металлов сильные восстановители (LiAlH4 и NaBH4), используются для восстановления полярных двойных связей углерод–гетероатом, в
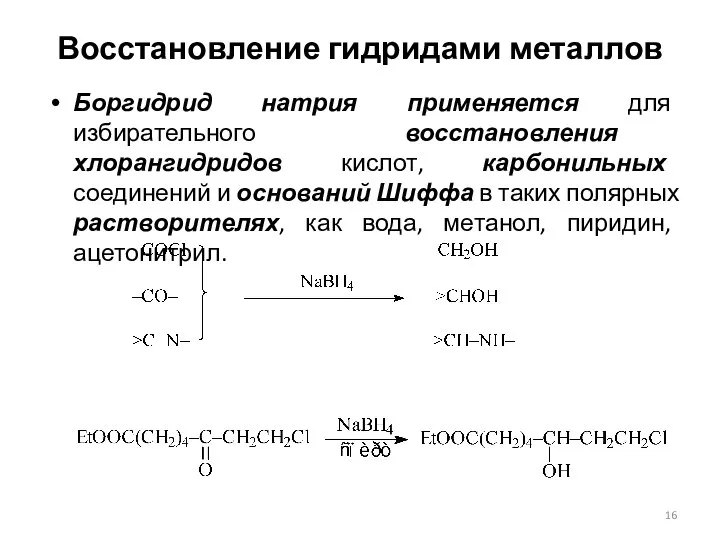
- 16. Восстановление гидридами металлов Боргидрид натрия применяется для избирательного восстановления хлорангидридов кислот, карбонильных соединений и оснований Шиффа
- 17. Каталитическое восстановление водородом Достоинства: универсальность, высокая скорость процесса, чистота получаемых продуктов и простота их выделения. Недостатки:
- 18. Катализаторы В химико-фармацевтической промышленности широко применяют скелетный катализатор никель Ренея при нагревании в автоклавах, реже платиновые
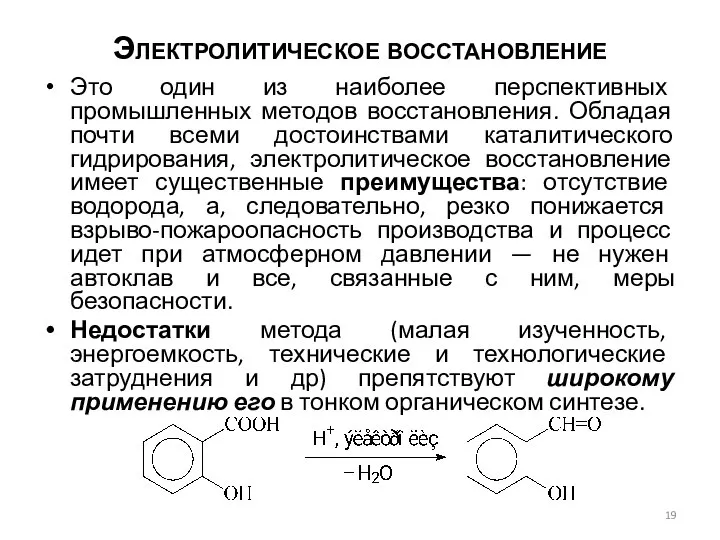
- 19. Электролитическое восстановление Это один из наиболее перспективных промышленных методов восстановления. Обладая почти всеми достоинствами каталитического гидрирования,
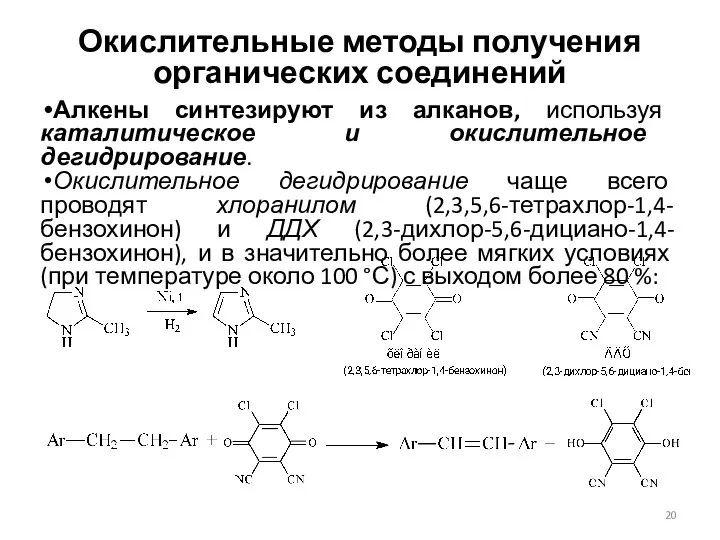
- 20. Окислительные методы получения органических соединений Алкены синтезируют из алканов, используя каталитическое и окислительное дегидрирование. Окислительное дегидрирование
- 21. Получение карбонильных соединений Альдегиды, как правило, окисляются легче, чем субстрат, полимеризуются и конденсируются, поэтому их лучше
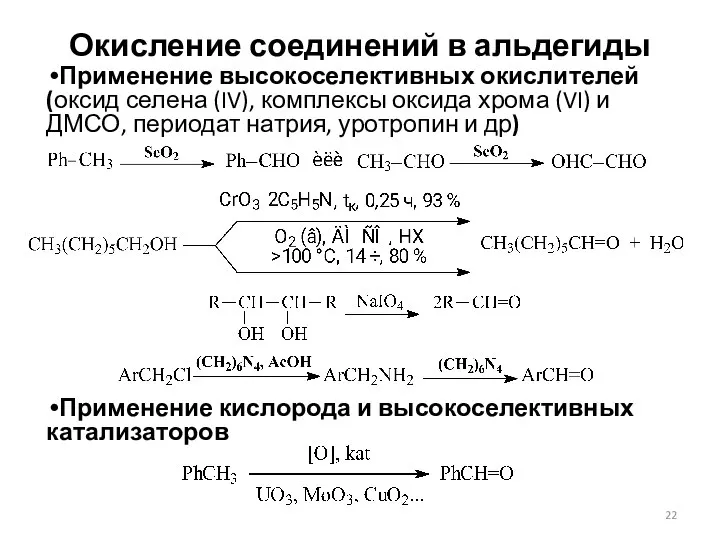
- 22. Окисление соединений в альдегиды Применение высокоселективных окислителей (оксид селена (IV), комплексы оксида хрома (VI) и ДМСО,
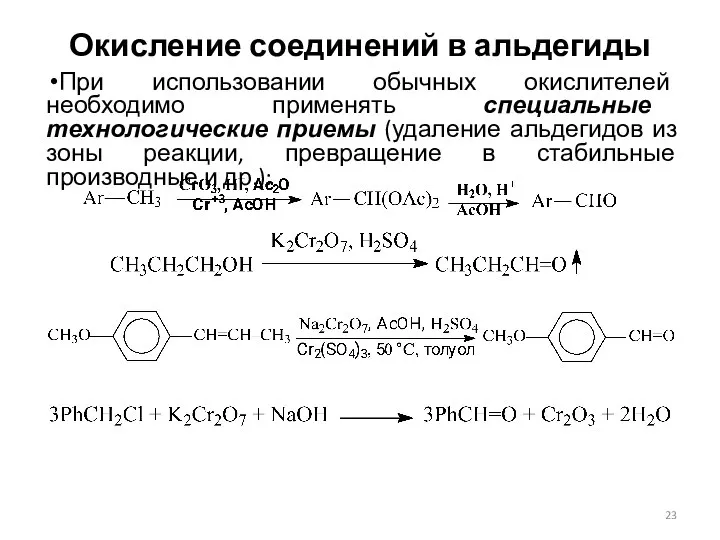
- 23. Окисление соединений в альдегиды При использовании обычных окислителей необходимо применять специальные технологические приемы (удаление альдегидов из
- 24. Окисление алканов и активированные группы в карбоновые кислоты Алканы окисляют кислородом на катализаторе. Активированные алкильные группы
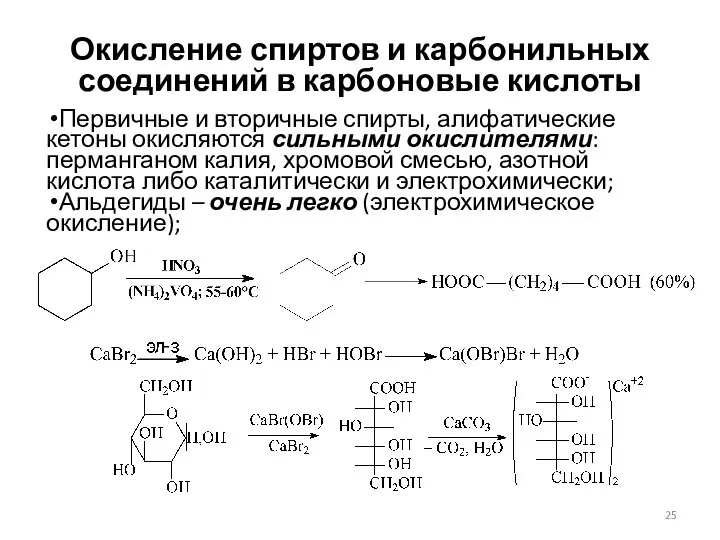
- 25. Окисление спиртов и карбонильных соединений в карбоновые кислоты Первичные и вторичные спирты, алифатические кетоны окисляются сильными
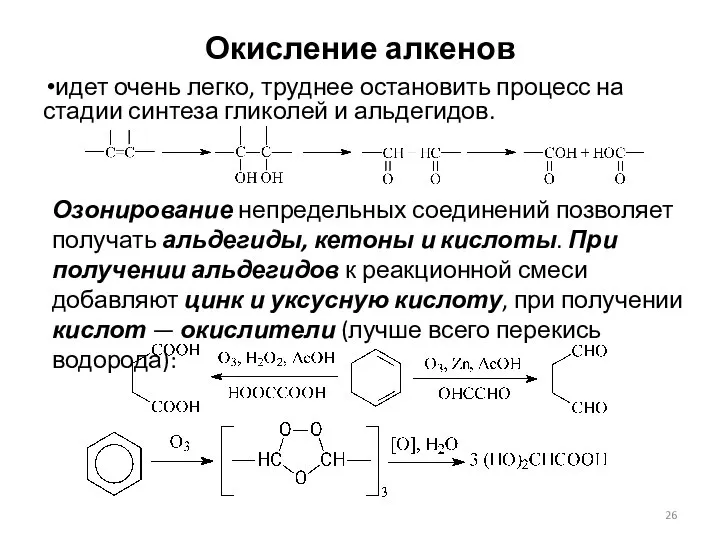
- 26. Окисление алкенов идет очень легко, труднее остановить процесс на стадии синтеза гликолей и альдегидов. Озонирование непредельных
- 28. Скачать презентацию













 Ароматические углеводороды
Ароматические углеводороды Предмет химии. Вещества
Предмет химии. Вещества С П И Р Т Ы
С П И Р Т Ы Элементы V А группы. Азот и его соединения
Элементы V А группы. Азот и его соединения Семинар Фотосинтез
Семинар Фотосинтез Количественный анализ пищевых продуктов: молочные и мясные продукты; продукты переработки плодов и овощей
Количественный анализ пищевых продуктов: молочные и мясные продукты; продукты переработки плодов и овощей Презентация по Химии "женщины и химия" - скачать смотреть бесплатно
Презентация по Химии "женщины и химия" - скачать смотреть бесплатно Обобщение сведений об основных классах неорганических веществ
Обобщение сведений об основных классах неорганических веществ Арены. Природные источники углеводородов
Арены. Природные источники углеводородов Функциональные наноматериалы. (Лекция 1)
Функциональные наноматериалы. (Лекция 1) История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Нефть и способы её переработки.
Нефть и способы её переработки. Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Получение металлов. Металлы в природе
Получение металлов. Металлы в природе Щелочные металлы
Щелочные металлы Химические свойства металлов
Химические свойства металлов  Исследовательская работа по химии Количественное содержание витамина С в ягодах клюквы и проблема сохранности в зимний период вр
Исследовательская работа по химии Количественное содержание витамина С в ягодах клюквы и проблема сохранности в зимний период вр Судың құрамы және физикалық қасиеттері
Судың құрамы және физикалық қасиеттері Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Клонирование генов, создание геномных и кДНК-библиотек, искусственный синтез генов
Клонирование генов, создание геномных и кДНК-библиотек, искусственный синтез генов Свойства НЦ
Свойства НЦ Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Биологическая коррозия и защита строительных материалов и конструкций от биоповреждений
Биологическая коррозия и защита строительных материалов и конструкций от биоповреждений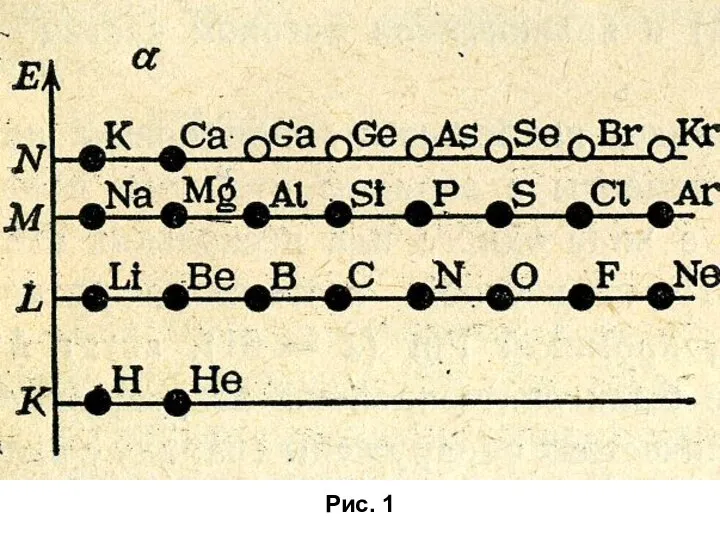 Строение атома и его электронной оболочки
Строение атома и его электронной оболочки Презентация по Химии "Мило,та миючі засоби." - скачать смотреть бесплатно
Презентация по Химии "Мило,та миючі засоби." - скачать смотреть бесплатно Растворы
Растворы