Содержание
- 2. Растворение - это физико-химический процесс, а раствор – это гомогенная (однородная) система, состоящая из частиц растворенного
- 3. Доказательством химического взаимодействия служат такие признаки химических реакций, как выделение или поглощение тепла при растворении.
- 4. Признаки раствора: 1) Раствор содержит два или более компонентов. 2) Раствор – однородная система, в которой
- 5. Растворы Жидкость + Твердое вещество Жидкость + Жидкость Газ + Жидкость Твердое вещество + Твердое вещество
- 6. Растворимость вещества Растворимость твердых веществ при повышении температуры увеличивается. Растворимость газов с повышением температуры уменьшается. С
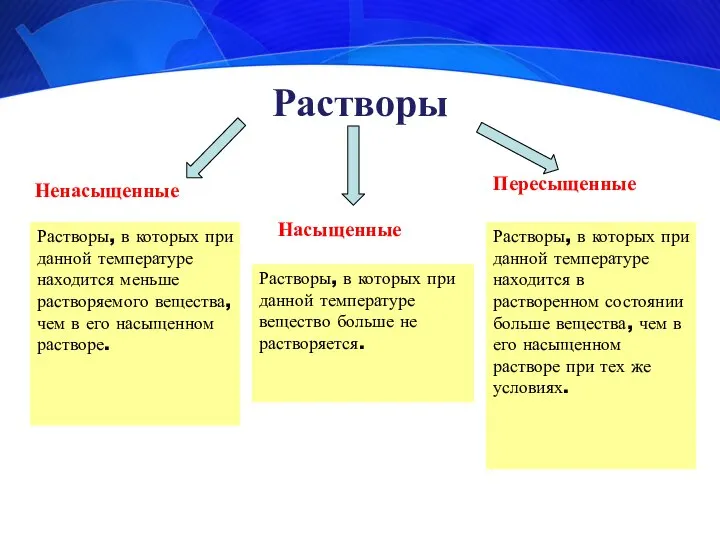
- 7. Растворы Ненасыщенные Насыщенные Пересыщенные Растворы, в которых при данной температуре вещество больше не растворяется. Растворы, в
- 8. Концентрация растворов
- 9. Массовая доля вещества в растворе (процентная концентрация)
- 10. m(р-ра) – масса раствора m(в) – масса растворенного вещества m(р-ля) – масса растворителя m(р-ра)= m(в) +
- 11. Массовая доля вещества в растворе: - массовая доля вещества в растворе
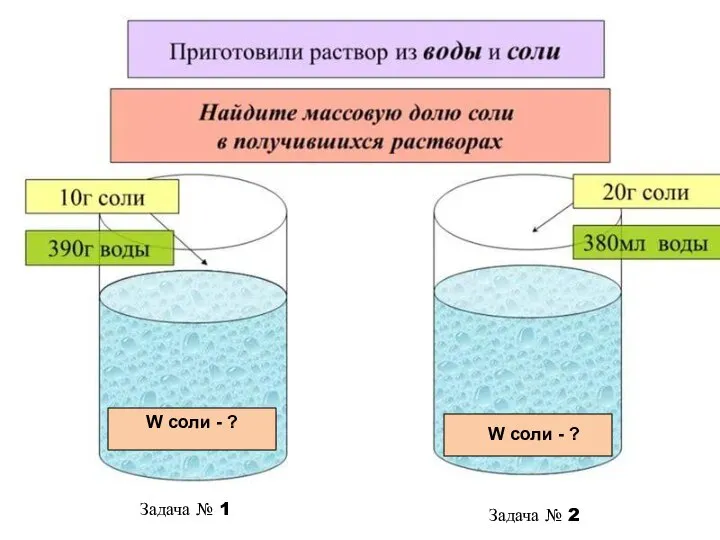
- 12. W соли - ? W соли - ? Задача № 1 Задача № 2
- 13. Дано: mв = 10г mр-ля = 390г ω - ? Решение: Ответ: ω = 2,5% Задача
- 14. Задача № 2 Дано: mв = 20г Vр-ля = 380мл ω - ? Решение: 1) mр-ля
- 15. Задачи на разбавление. К 120 г раствора с массовой долей соли 7% прилили 30 г воды.
- 17. Скачать презентацию












 Каталитический крекинг
Каталитический крекинг Свойства фосфора
Свойства фосфора Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов Взаимосвязь между классами неорганических веществ
Взаимосвязь между классами неорганических веществ Атомная энергетика
Атомная энергетика Основні класи неорганічних сполук
Основні класи неорганічних сполук Степень окисления
Степень окисления  Общая характеристика оксидов Учитель химии МОУ Неклюдовская СОШ Отряскина Т.А.
Общая характеристика оксидов Учитель химии МОУ Неклюдовская СОШ Отряскина Т.А.  Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна
Фотометрический анализ III курс, д/о Преподаватель Ельчищева Юлия Борисовна  Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть
Презентация по Химии "Уравнения окислительно- восстановительных реакций" - скачать смотреть  Простые вещества, неметаллы. Аллотропия
Простые вещества, неметаллы. Аллотропия Хімічні мутагени
Хімічні мутагени  Відходи хімічного синтезу: утворення та попередження
Відходи хімічного синтезу: утворення та попередження Acizii nucleici
Acizii nucleici Немного о лецитине
Немного о лецитине Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Медь. Содержание в природе
Медь. Содержание в природе Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры
Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры Факторы влияющие на скорость химической реакции
Факторы влияющие на скорость химической реакции Амінооцтова кислота. Її будова і властивості
Амінооцтова кислота. Її будова і властивості Нуклеопротеины
Нуклеопротеины Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Неметаллические материалы
Неметаллические материалы Аттестационная работа. Методическая разработка спецкурса по химии для 8 класса Мир открытий. Вещества, окружающие нас в быту
Аттестационная работа. Методическая разработка спецкурса по химии для 8 класса Мир открытий. Вещества, окружающие нас в быту Органические вещества
Органические вещества Способы выражения состава раствора
Способы выражения состава раствора Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства)