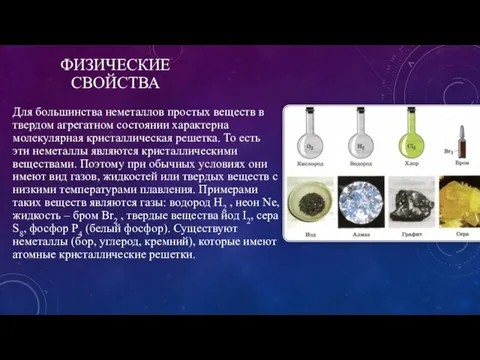
ХИМИЧЕСКИЕ СВОЙСТВА И СОЕДИНЕНИЯ
Водородные соединения неметаллов в основном являются летучими соединениями,
в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
S+H2 =H2 S (до 350 градусов равновесие смещено вправо)
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.




 The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Бинарные соединения 8 класс
Бинарные соединения 8 класс Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47
ТОМИЛОВА НАТАЛЬЯ ВЛАДИМИРОВНА УЧИТЕЛЬ ХИМИИ И ЕСТЕСТВОЗНАНИЯ МОУ СОШ № 47 Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Неорганические вещества
Неорганические вещества Непредельные углеводороды алкены
Непредельные углеводороды алкены Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза ОКСИДЫ АЗОТА.
ОКСИДЫ АЗОТА.  Силикатная промышленность
Силикатная промышленность Органическая химия. История развития
Органическая химия. История развития Галогены. История открытия галогенов
Галогены. История открытия галогенов Серная кислота H2SO4
Серная кислота H2SO4 Применимость геохимических правил к распространенности лантанидов в земной коре
Применимость геохимических правил к распространенности лантанидов в земной коре Растворы электролитов
Растворы электролитов Прогнозування хімічної обстановки під час застосування хімічної зброї
Прогнозування хімічної обстановки під час застосування хімічної зброї Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.
Жири. Жири в природі. Біологічна роль жирів. Жири. Жири в природі. Біологічна роль жирів.  Металлы первой и второй групп
Металлы первой и второй групп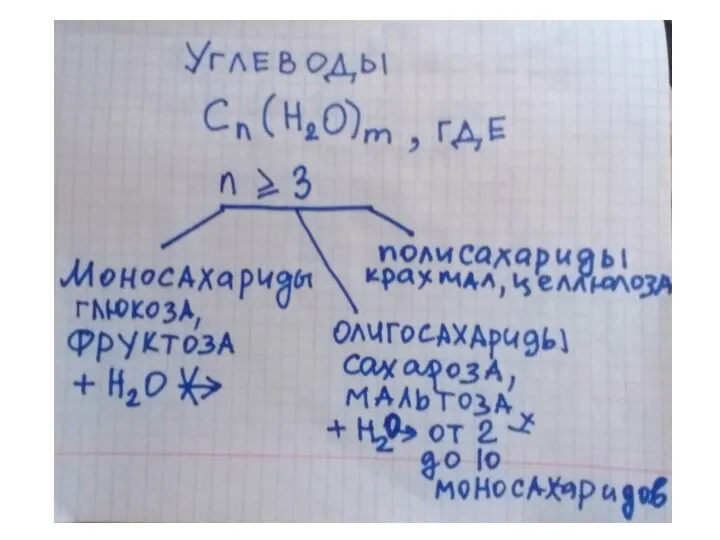 Крахмал и целлюлоза
Крахмал и целлюлоза Modelul atomic al actiniului
Modelul atomic al actiniului Липиды. Классификация липидов
Липиды. Классификация липидов Углеводы (10 класс) - Презентация по Химии_
Углеводы (10 класс) - Презентация по Химии_ Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2) Презентация по химии Классы неорганических веществ
Презентация по химии Классы неорганических веществ Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно Строение твердого вещества
Строение твердого вещества