Содержание
- 2. Водород Электронная формула – 1s1. Изотопы: протий 1Н, дейтерий 2Н (D), тритий 3Н (Т) - радиоактивный
- 3. Химические свойства Восстановительные свойства в р-циях с неметаллами: H2(г)+Сl2(г)=2HCl(г)+184 кДж, 2H2(г)+О2(г)=2H2О (г)+484 кДж; с оксидами и
- 4. Окислительные свойства - в р-циях c активными Ме: 2Na+H2=2NaH (гидрид натрия), Ca+H2=CaH2 (гидрид кальция).
- 5. Получение водорода В промышленности: Электролиз воды. Газификация твердого топлива: C+H2O=t CO+H2 (t=1100oC) Конверсия природного газа: CH4+H2O=t
- 6. Применение водорода Синтез аммиака. Получение хлороводорода и соляной кислоты. Гидрогенизация растительных жиров. Восстановление металлов (Mo, W,
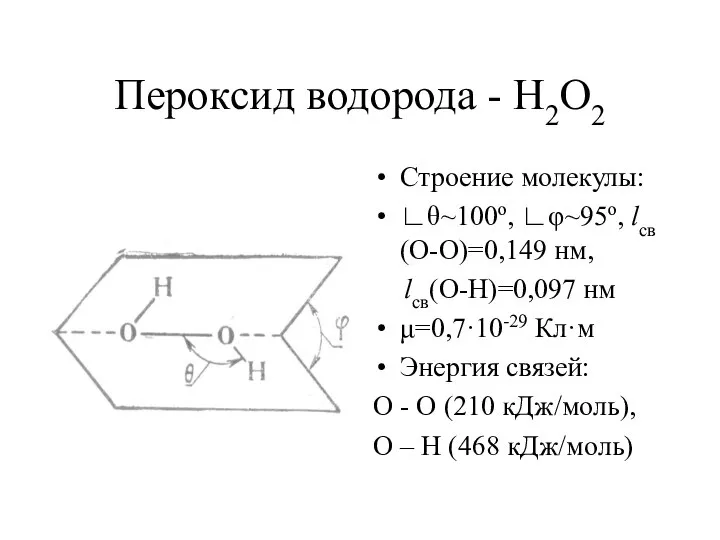
- 7. Пероксид водорода - Н2О2 Строение молекулы: ∟θ~100о, ∟φ~95о, lсв(О-О)=0,149 нм, lсв(О-Н)=0,097 нм μ=0,7·10-29 Кл·м Энергия связей:
- 8. Свойства Н2О2 Физические - : бесцветная, вязкая прозрачная жидкость (tкип=150,2оС), смешивается с водой в любых соотношениях.
- 9. Применение Н2О2 Отбеливание тканей, мехов, кожи, бумаги. Дезинфицирующее средство в медицине. Наружное бактерицидное средство. Протравливание семян
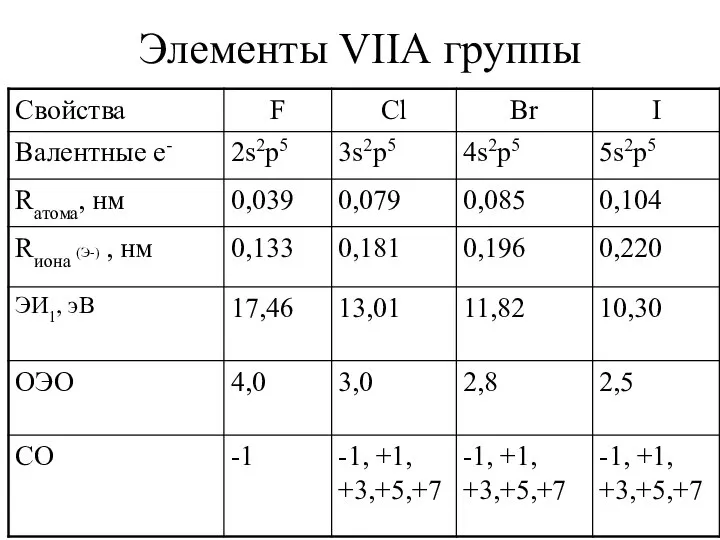
- 10. Элементы VIIА группы
- 11. Хлор
- 12. Бром
- 13. ЙОД
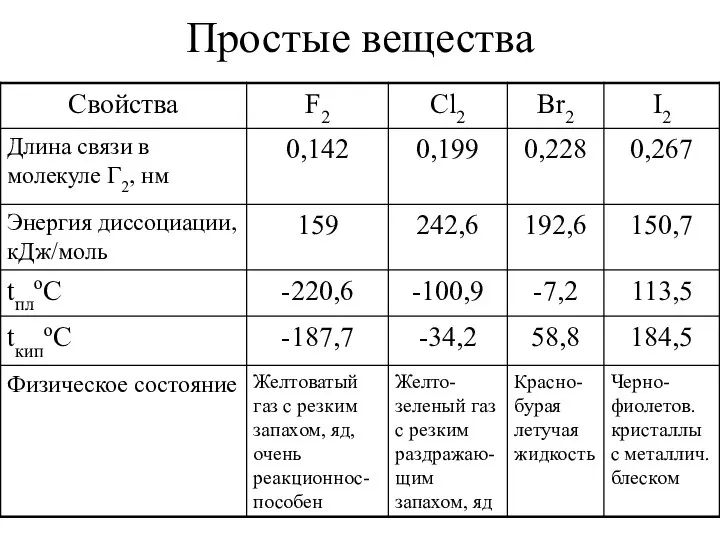
- 14. Простые вещества
- 15. Получение галогенов Фтор – электролиз расплава KHF2 (KF·HF). Хлор – в промышленности электролизом раствора NaCl. В
- 16. Химические свойства галогенов Сильные окислители, вступают во взаимодействие почти со всеми простыми веществами: F2+H2=2HF (на холоду
- 17. Сравнение химической активности галогенов F2 окисляет Ме, в т.ч. при нагревании Au, Pt, а также Kr,
- 18. Галогеноводороды Бесцветные газы с резким запахом, хорошо растворимы в воде (в 1 V H2O – 500
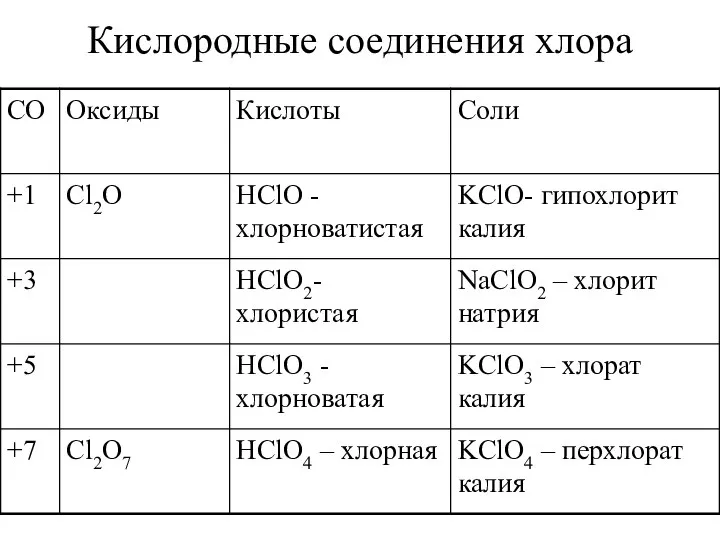
- 19. Кислородные соединения хлора
- 20. Кислородные соединения хлора получаются косвенно. Оксиды хлора: Cl2O, ClO2, ClO3, Cl2O7. Cl2O+H2O=2HClO 2ClO2+H2O=HClO2+HClO3, 2ClO3+H2O=HClO3+HClO4 Cl2O7+H2O=2HClO4 HClO
- 21. HClO2-неустойчивая, быстро разлагается. Соли – сильные окислители получают: 2ClO2+2KOH=KClO2+KClO3+H2O, KClO3+H2O2=KClO2+H2O+O2. HClO3 – только в водном растворе,
- 22. HClO4 – самая сильная кислота, существует в свободном виде. Бесцветная дымящая жидкость. Сильный окислитель. Разлагается при
- 23. Кислородные соединения брома и йода
- 24. Применение галогенов и их соединений Cl2 – производство хлорсодержащих продуктов: растворителей, полимеров, красителей, ядохимикатов. ClO2 и
- 25. Общие закономерности 1.Все элементы существуют в виде 2х-атомных молекул. Изменение tпл. и t кип. указывает на
- 27. Скачать презентацию




















 Основные классы неорганических веществ
Основные классы неорганических веществ Нафта, вугілля, природний газ як вуглеводнева сировина Підготувала учениця 11 класу Дерев’янко Ірина
Нафта, вугілля, природний газ як вуглеводнева сировина Підготувала учениця 11 класу Дерев’янко Ірина  Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Метод Кнехта
Метод Кнехта Век медный, бронзовый, железный
Век медный, бронзовый, железный Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции в растворах Скло, його різновиди та застосування Робота Учениці 10-А класу Баранюк Надії
Скло, його різновиди та застосування Робота Учениці 10-А класу Баранюк Надії  Производство мыла
Производство мыла Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Буферные системы
Буферные системы Презентация по Химии "Галогены в организме человека" - скачать смотреть
Презентация по Химии "Галогены в организме человека" - скачать смотреть  Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Презентация «Силикатная промышленность» МОУ «Средняя общеобразовательная
Презентация «Силикатная промышленность» МОУ «Средняя общеобразовательная  Незвичайна вода
Незвичайна вода Неметаллы и их свойства
Неметаллы и их свойства Презентация по Химии "Применение солей в быту" - скачать смотреть
Презентация по Химии "Применение солей в быту" - скачать смотреть  Спирты в жизни человека
Спирты в жизни человека Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Физические явления в химии
Физические явления в химии Открытие кремния
Открытие кремния Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско
Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско Структурная механика композитов. Слоистый композит
Структурная механика композитов. Слоистый композит ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна
ФИЗИОЛОГИЯ ПИТАНИЯ. Урок по кулинарии. 7 класс. Разработал: учитель технологии Дятлова Елена Владимировна  Кислоты и соли
Кислоты и соли Исследование Е. Е. Вагнера в области терпенов и камфоры
Исследование Е. Е. Вагнера в области терпенов и камфоры Химия в продуктах питания
Химия в продуктах питания Метрологические основы аналитической химии
Метрологические основы аналитической химии