Список вопросов
Понятие о растворах, способы выражения концентраций.
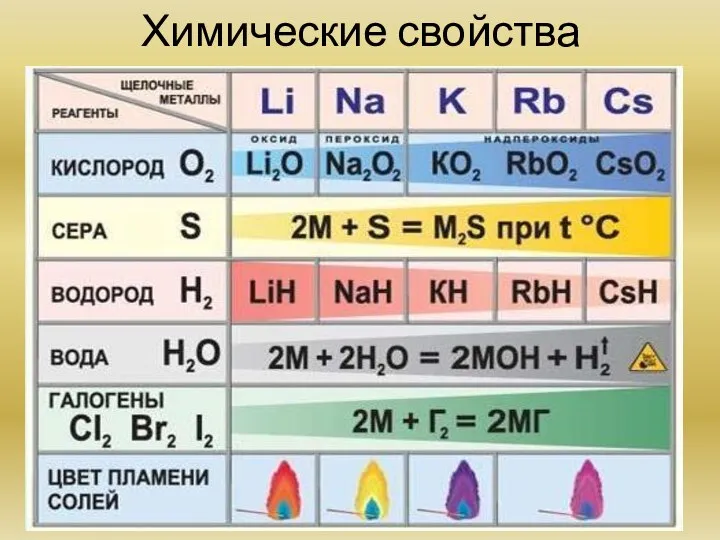
Химия элементов IA группы (на
примере лития, натрия, калия) Общая характеристика элементов. Основные химические реакции. Основные соединения.
Основные понятия химии. Химические превращения. Закон сохранения массы и энергии. Стехиометрия.
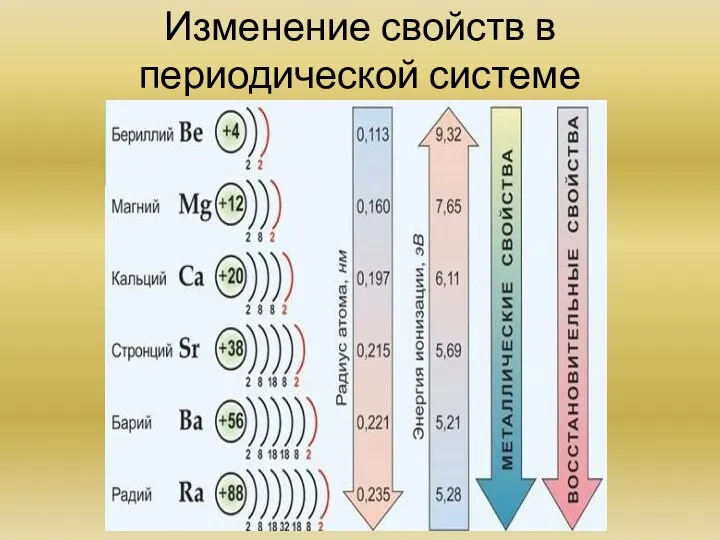
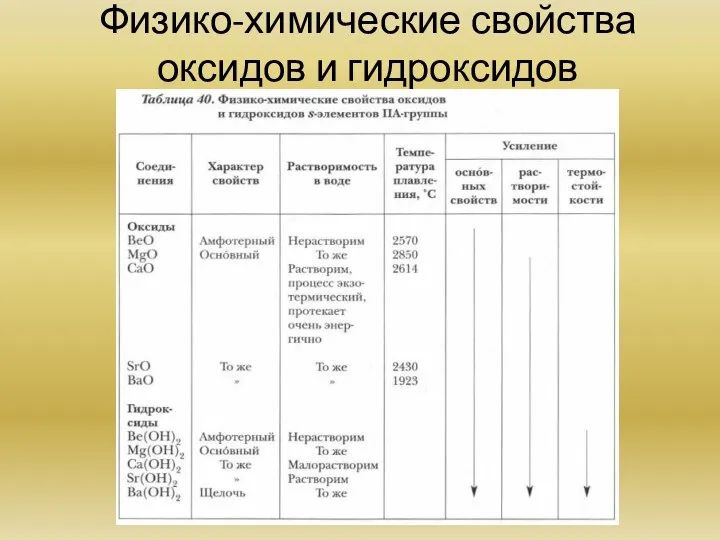
Химия элементов IIA группы. ( на примере бария, магния, кальция) Общая характеристика элементов. Основные химические реакции. Основные соединения.
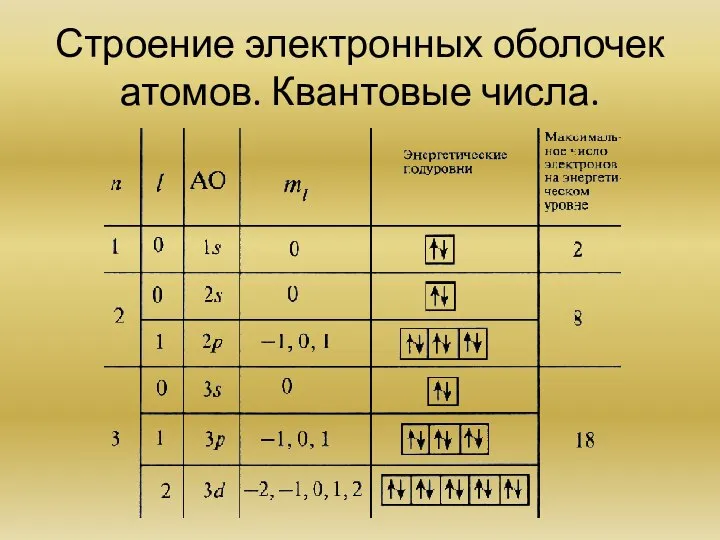
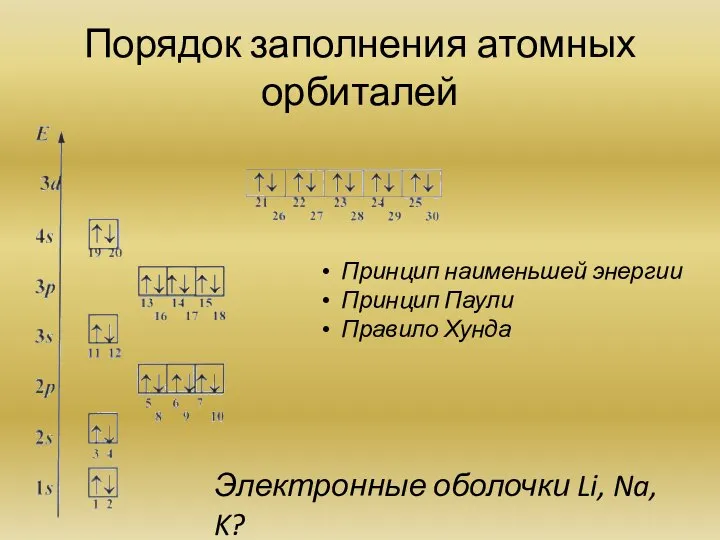
Строение электронных оболочек атомов (на примере атомов водорода, лития и натрия). Квантовые числа.
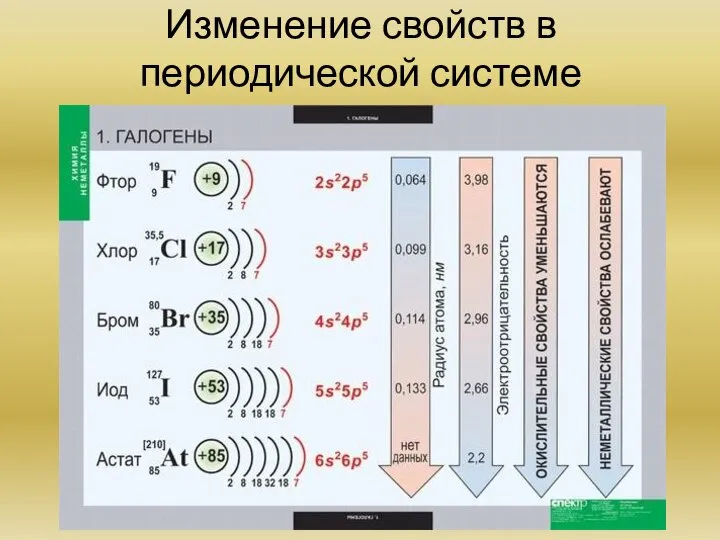
Химия элементов VIIA группы (на примере фтора, хлора, брома) Общая характеристика элементов. Основные химические реакции. Основные соединения.
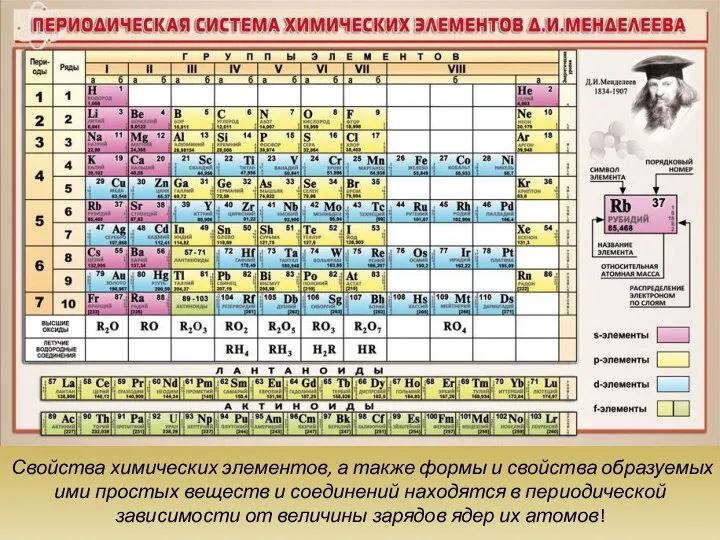
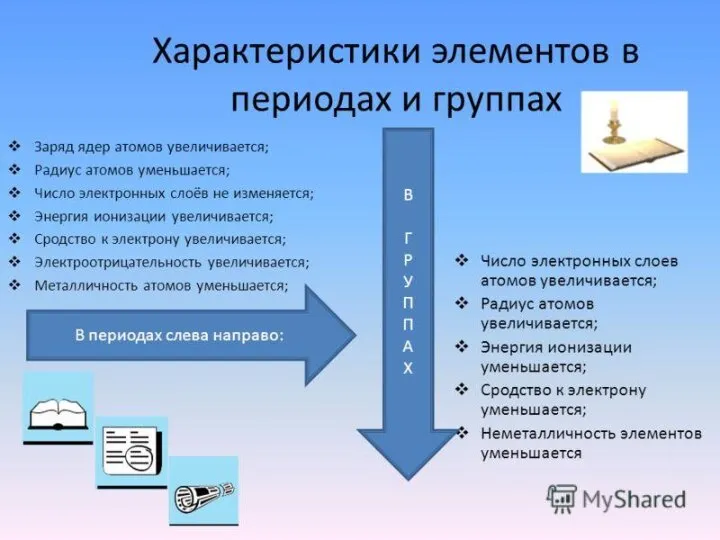
Периодический закон Д.И. Менделеева и его обоснование с точки зрения электронного строения атомов. Периодическая система элементов.
Способы получения оксидов бария и кальция.
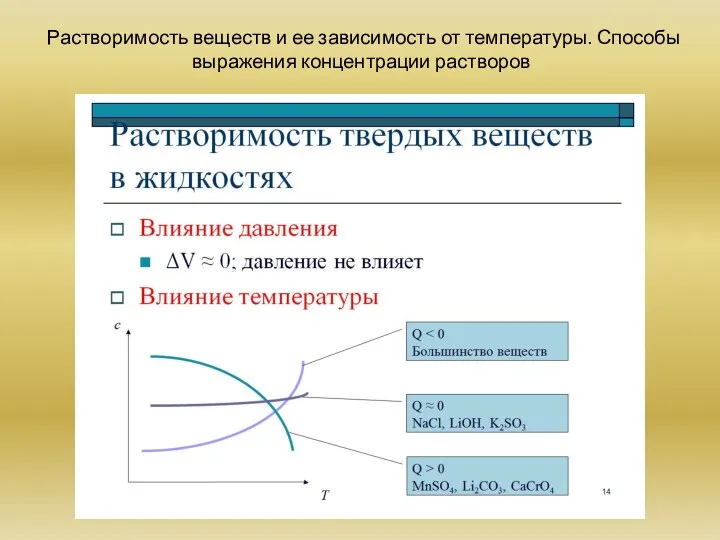
Растворимость веществ и ее зависимость от температуры. Способы выражения концентрации растворов: массовая доля, мольная доля, объемная доля, молярная концентрация.
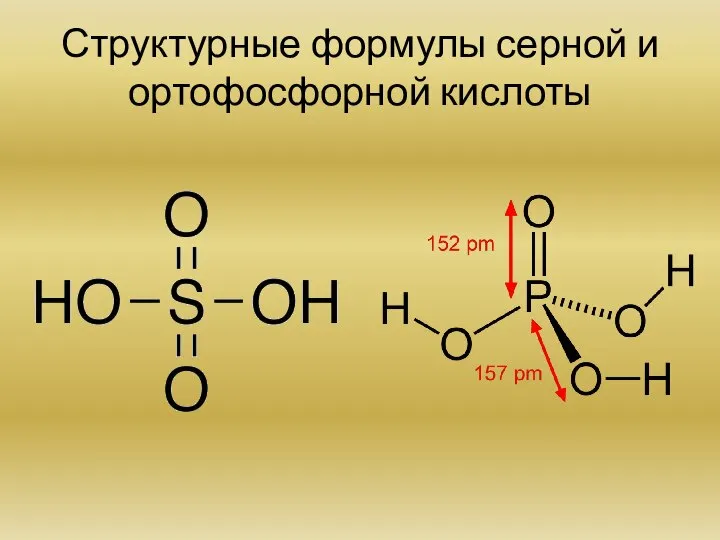
Напишите структурные формулы серной и ортофосфорной кислоты. Кислые соли.
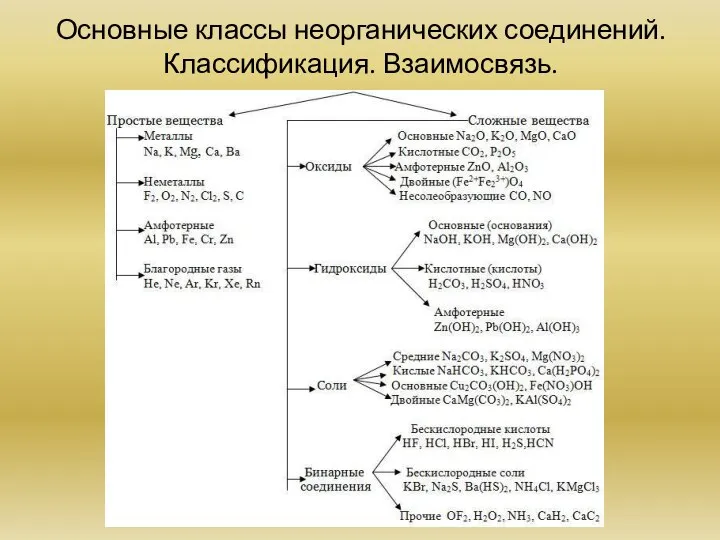
Сложные вещества. Основные классы неорганических веществ: оксиды, основания, кислоты, соли. Классификация. Взаимосвязь.
Оксиды, гидроксиды и галогениды элементов IA группы. Свойства, получение.













 Викторина по химии
Викторина по химии IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат « Признаки реакций»
« Признаки реакций»  Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна
Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна  Тема: “Загальна характеристика основ”.
Тема: “Загальна характеристика основ”.  Магний. Роль магния в организме
Магний. Роль магния в организме Синтетические моющие средства
Синтетические моющие средства Природні сполуки алюмінію і методи одержання
Природні сполуки алюмінію і методи одержання Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М
Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район М Топливо и его свойства
Топливо и его свойства Горные породы
Горные породы Хлороводород. Соляная кислота.
Хлороводород. Соляная кислота.  Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів.
Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів.  Классификация химических реакций
Классификация химических реакций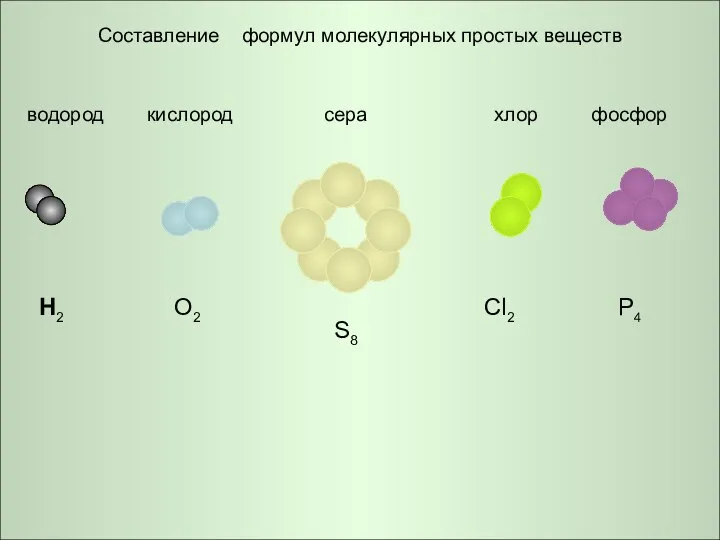 Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Получение витаминов
Получение витаминов Сердечные гликозиды (СГ)
Сердечные гликозиды (СГ) Место реакции Белоусова-Жаботинского в науке
Место реакции Белоусова-Жаботинского в науке Строение и свойства неорганических веществ. Кислоты и основания
Строение и свойства неорганических веществ. Кислоты и основания Химические свойства полимеров
Химические свойства полимеров Обмен белков. (Лекция 16)
Обмен белков. (Лекция 16) Электродные материалы для электрохимических систем
Электродные материалы для электрохимических систем Сера. Свойства серы
Сера. Свойства серы Водород. Генри Кавендиш
Водород. Генри Кавендиш «Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска
«Фосфор как элемент и вещество» урок химии 9 класс Мотайло М.В. учитель химии и биологии МОУ «Головчинская СОШ с УИОП» Белгородска Презентация по Химии "Типы химических реакций в органической и неорганической химии" - скачать смотреть
Презентация по Химии "Типы химических реакций в органической и неорганической химии" - скачать смотреть  Мінеральні добрива
Мінеральні добрива