Содержание
- 2. Этапы урока • Организационный • Усвоение новых знаний • Закрепление новых знаний • Обобщения и систематизации
- 3. Этап -подготовка к восприятию нового материала Вспомните, какие соединения называют оксидами? Что лежит в основе распределения
- 4. -Ну а теперь, вернемся снова в химию: На доске записаны формулы веществ, выберите из них только
- 5. -Правильно отметили – вода – оксид неметалла, почему у вас кроме воды нет других оксидов неметаллов?
- 6. - с какими свойствами оксидов вы познакомились в первой части лабораторной работы, а с какими -
- 8. Скачать презентацию
Слайд 2
Этапы урока
• Организационный
• Усвоение новых знаний
• Закрепление новых знаний
• Обобщения и систематизации
• Информация о домашнем
Этапы урока
• Организационный
• Усвоение новых знаний
• Закрепление новых знаний
• Обобщения и систематизации
• Информация о домашнем
задании
• Подведение итогов
• Подведение итогов
Слайд 3
Этап -подготовка к восприятию нового материала
Вспомните, какие соединения называют оксидами?
Что лежит
Этап -подготовка к восприятию нового материала
Вспомните, какие соединения называют оксидами?
Что лежит
в основе распределения оксидов по группам?
Какие оксиды называют амфотерными? Приведите примеры.
Вспомните, а где еще кроме урока химии мы встречаемся с оксидами
(уч-ся как правило отвечают: вода, углекислый газ, ржавчина, СО
коллекции: горные породы и минералы)
А с перечисленными оксидами как познакомились?
( животные и люди выдыхают СО2, машину проверяют на СО, водой пользуемся, по географии изучали месторождения руд, готовили сообщения, рассматривали минералы)
Но не только на уроках, но и в известных произведениях мы часто встречаемся с описанием оксидов, прочитайте (текст на доске) «Это ярче глаз Багиры»,- сказал Маугли, с восхищением поворачивая рубин …»
– Кто знает- рубин какого цвета? ( это разновидность тугоплавкого минерала корунда, формула которого Al2O3)
А помните у Пушкина: «…во мгле печальной
Гроб качается хрустальный
И в хрустальном гробе том
Спит царевна вечным сном» ( текст на доске)
- Бесцветные кристаллы кварца, которого называют горным хрусталем –SiO2
Какие оксиды называют амфотерными? Приведите примеры.
Вспомните, а где еще кроме урока химии мы встречаемся с оксидами
(уч-ся как правило отвечают: вода, углекислый газ, ржавчина, СО
коллекции: горные породы и минералы)
А с перечисленными оксидами как познакомились?
( животные и люди выдыхают СО2, машину проверяют на СО, водой пользуемся, по географии изучали месторождения руд, готовили сообщения, рассматривали минералы)
Но не только на уроках, но и в известных произведениях мы часто встречаемся с описанием оксидов, прочитайте (текст на доске) «Это ярче глаз Багиры»,- сказал Маугли, с восхищением поворачивая рубин …»
– Кто знает- рубин какого цвета? ( это разновидность тугоплавкого минерала корунда, формула которого Al2O3)
А помните у Пушкина: «…во мгле печальной
Гроб качается хрустальный
И в хрустальном гробе том
Спит царевна вечным сном» ( текст на доске)
- Бесцветные кристаллы кварца, которого называют горным хрусталем –SiO2
Слайд 4
-Ну а теперь, вернемся снова в химию:
На доске записаны формулы веществ,
-Ну а теперь, вернемся снова в химию:
На доске записаны формулы веществ,
выберите из них только оксиды и распределите по группам
H2SO4, CO2, NaOH, SO3, H2O, CuSO4, Al2O3, CH3OH, Ba(OH)2, Na2O, SO2, CO, N2O5, HNO3, P2O3, SiO2, KMnO4
( проверка на доске: оксиды металлов подчеркивает одной чертой, неметаллов – двумя, амфотерные – волнистой)
Практическая часть: Fe2O3, CaO, , CuO, HCl, H2O, стекл. палочки
у вас на столах стоят флакончики с реактивами, выберите из них только оксиды,
рассмотрите их, свои наблюдения занесите в таблицу 1
Физические свойства
H2SO4, CO2, NaOH, SO3, H2O, CuSO4, Al2O3, CH3OH, Ba(OH)2, Na2O, SO2, CO, N2O5, HNO3, P2O3, SiO2, KMnO4
( проверка на доске: оксиды металлов подчеркивает одной чертой, неметаллов – двумя, амфотерные – волнистой)
Практическая часть: Fe2O3, CaO, , CuO, HCl, H2O, стекл. палочки
у вас на столах стоят флакончики с реактивами, выберите из них только оксиды,
рассмотрите их, свои наблюдения занесите в таблицу 1
Физические свойства
Слайд 5
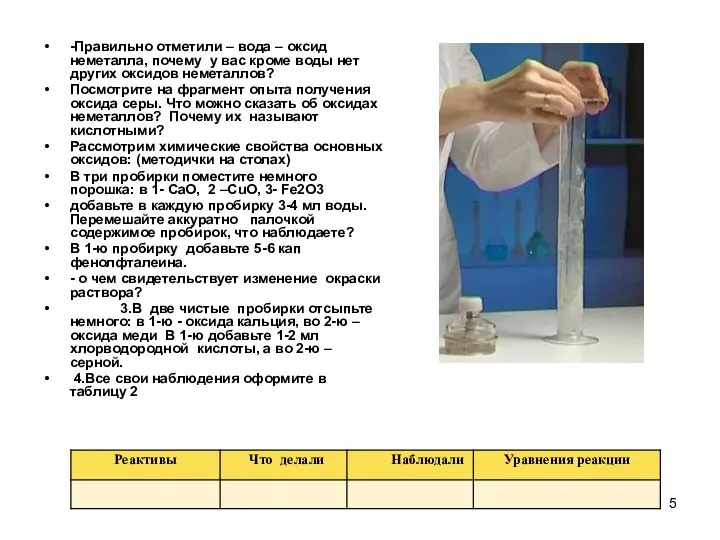
-Правильно отметили – вода – оксид неметалла, почему у вас кроме
-Правильно отметили – вода – оксид неметалла, почему у вас кроме
воды нет других оксидов неметаллов?
Посмотрите на фрагмент опыта получения оксида серы. Что можно сказать об оксидах неметаллов? Почему их называют кислотными?
Рассмотрим химические свойства основных оксидов: (методички на столах)
В три пробирки поместите немного порошка: в 1- CaO, 2 –CuO, 3- Fe2O3
добавьте в каждую пробирку 3-4 мл воды. Перемешайте аккуратно палочкой содержимое пробирок, что наблюдаете?
В 1-ю пробирку добавьте 5-6 кап фенолфталеина.
- о чем свидетельствует изменение окраски раствора?
3.В две чистые пробирки отсыпьте немного: в 1-ю - оксида кальция, во 2-ю – оксида меди В 1-ю добавьте 1-2 мл хлорводородной кислоты, а во 2-ю – серной.
4.Все свои наблюдения оформите в таблицу 2
Посмотрите на фрагмент опыта получения оксида серы. Что можно сказать об оксидах неметаллов? Почему их называют кислотными?
Рассмотрим химические свойства основных оксидов: (методички на столах)
В три пробирки поместите немного порошка: в 1- CaO, 2 –CuO, 3- Fe2O3
добавьте в каждую пробирку 3-4 мл воды. Перемешайте аккуратно палочкой содержимое пробирок, что наблюдаете?
В 1-ю пробирку добавьте 5-6 кап фенолфталеина.
- о чем свидетельствует изменение окраски раствора?
3.В две чистые пробирки отсыпьте немного: в 1-ю - оксида кальция, во 2-ю – оксида меди В 1-ю добавьте 1-2 мл хлорводородной кислоты, а во 2-ю – серной.
4.Все свои наблюдения оформите в таблицу 2
Слайд 6
- с какими свойствами оксидов вы познакомились в первой части лабораторной
- с какими свойствами оксидов вы познакомились в первой части лабораторной
работы, а с какими - во второй? (физические и химические)
- перечислите физические свойства
- перечислите химические свойства оксидов, которые вы наблюдали.
- откройте учебник стр.92 – таблица 9 подумайте, какими еще химическими свойствами обладают оксиды? Составьте свои уравнения реакций, отличные от примеров учебника (взаимопроверка и проверить на доске).
- перечислите физические свойства
- перечислите химические свойства оксидов, которые вы наблюдали.
- откройте учебник стр.92 – таблица 9 подумайте, какими еще химическими свойствами обладают оксиды? Составьте свои уравнения реакций, отличные от примеров учебника (взаимопроверка и проверить на доске).
- Предыдущая
ГрафикаСледующая -
В доме Бурковых


 Вспомогательные устройства для высокоэффективной жидкостной хроматографии (ВЭЖХ)
Вспомогательные устройства для высокоэффективной жидкостной хроматографии (ВЭЖХ) Композиционные материалы, состав и классификация композиционных материалов
Композиционные материалы, состав и классификация композиционных материалов Степень окисления
Степень окисления Алканы. Гомологический ряд
Алканы. Гомологический ряд Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Класса неорганических соединений.
Класса неорганических соединений. Тұздар гидролизі
Тұздар гидролизі Теоретические основы органической химии
Теоретические основы органической химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Комплексные соединения
Комплексные соединения Благородные металлы
Благородные металлы КАЛЬЦИЙ Ca 9 класс
КАЛЬЦИЙ Ca 9 класс Неметаллы IVA и IIIA групп Углерод, кремний , бор
Неметаллы IVA и IIIA групп Углерод, кремний , бор Гидролиз солей.
Гидролиз солей.  Спирт µндіру технологиясы
Спирт µндіру технологиясы Колообіг Карбону в природі Оленченко Катерина, 11-Б
Колообіг Карбону в природі Оленченко Катерина, 11-Б  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химия и экология
Химия и экология Дезактивація радіаційних речовин у зоні ядерного ураження
Дезактивація радіаційних речовин у зоні ядерного ураження Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама
Лабораторные, микробиологические и иммунологические исследования. Окраска препаратов по методу Грама Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate Диаграмма состояния Fe - FeC. Лекция 5 - 6
Диаграмма состояния Fe - FeC. Лекция 5 - 6 Адсорбционные явления. Общая характеристика адсорбции
Адсорбционные явления. Общая характеристика адсорбции Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций
Химическая и электрическая работа систем с химическими реакциями. Устройства для проведения электрохимических реакций Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Волокна
Волокна Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния