Содержание
- 2. Оксигенвмісні сполуки – це похідні вуглеводнів, у молекулах яких один або декілька атомів гідрогену заміщені на
- 3. Карбонові кислоти – органічні сполуки, у складі молекул яких міститься одна або кілька карбоксильних груп. Феноли
- 4. Фізичні та хімічні властивості спиртів та фенолів Залежно від будови вуглеводневого радикалу, розрізняють: а) насичені і
- 5. За систематичною номенклатурою назви спиртів утворюють, додаючи до назви відповідного вуглеводню суфікс – ол. Якщо молекула
- 6. Насичені одноатомні спирти нерозгалуженої будови, які містять від 1 до 11 вуглецевих атомів, за нормальних умов
- 7. Здатність спиртів відщеплювати протон від гідроксильної групи виявляє кислотні властивості спиртів, а здатність приєднувати протон до
- 8. Кислотні властивості гліцерину виражені ще сильніше, ніж в одно – та двохатомних спиртів. Гліцерин також легко
- 9. 5. При дії водовіднімаючих засобів, в залежності від умов, спирти можуть утворювати прості ефіри (етери) або
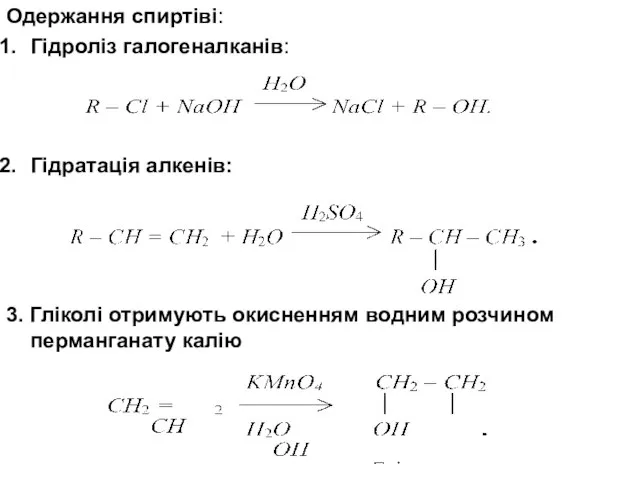
- 10. Одержання спиртіві: Гідроліз галогеналканів: Гідратація алкенів: 3. Гліколі отримують окисненням водним розчином перманганату калію
- 11. 4. Гліцерин добувають омиленням жирів – взаємодією естерів гліцеринів з водним розчином лугу. При цьому утворюється
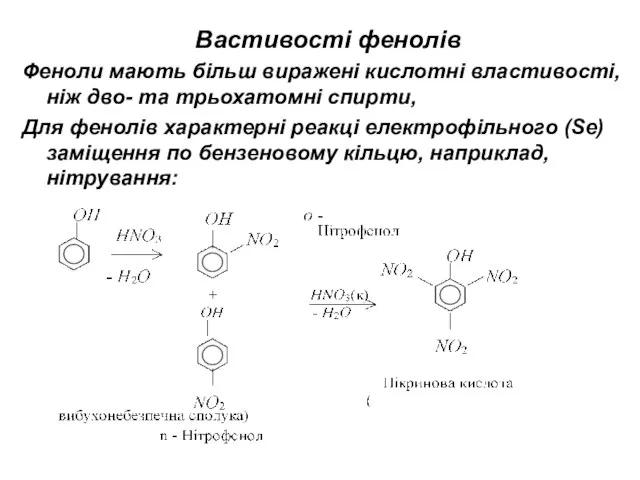
- 12. Вастивості фенолів Феноли мають більш виражені кислотні властивості, ніж дво- та трьохатомні спирти, Для фенолів характерні
- 13. Властивості альдегідів і кетонів Альдегіди і кетони утворюють гомологічні ряди. Мурашиний альдегід (НСОН )– газ, наступні
- 14. Методи синтезу альдегідів і кетонів. 1.Дегідрування спиртів:
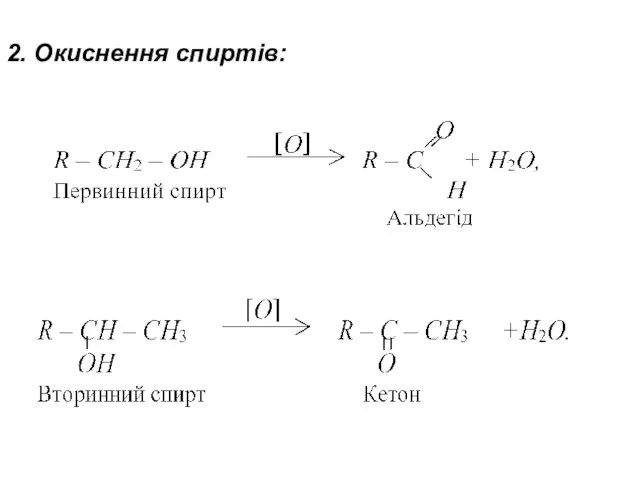
- 15. 2. Окиснення спиртів:
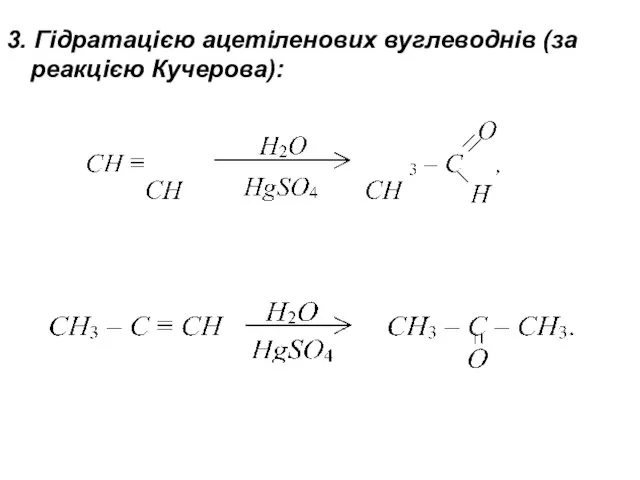
- 16. 3. Гідратацією ацетіленових вуглеводнів (за реакцією Кучерова):
- 17. Альдегіди і кетони вступають у численні реакції приєднання до карбонільної групи, в реакції заміщення атомів гідрогену,
- 18. 2. Реакції сполучення між собою називають “реакціями конденсації”: 3. Альдегіди кетони легко окислюються і перетворюються на
- 19. 4. Реакції горіння альдегідів і кетонів відбуваються до утворення диоксиду вуглецю (II) і води:
- 20. Вуглеводів, широко розповсюджені в живій природі (прості вуглеводи або моносахариди, і складні вуглеводи або полісахариди. Представниками
- 21. Карбонові кислоти – це похідні вуглеводнів, що містять одну або декілька карбоксильних груп, сполучених з алкільною
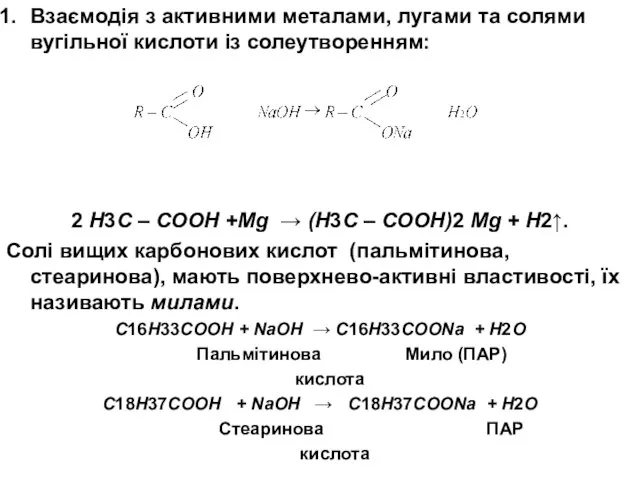
- 22. Взаємодія з активними металами, лугами та солями вугільної кислоти із солеутворенням: 2 Н3С – СООН +Mg
- 23. 2. Взаємодії карбонових кислот зі спиртами – реакція естерифікації (реакція оборотна): Взаємодія карбонових кислот з амоніаком:
- 25. Скачать презентацию

















 Alkali metals
Alkali metals Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Гетероциклические соединения
Гетероциклические соединения Воздух. Свойства воздуха
Воздух. Свойства воздуха Структура ячейки на примере атома железа
Структура ячейки на примере атома железа Пластмассы (пластики)
Пластмассы (пластики) Алкалоиды ряда изохинолина и пурина. (Лекция 10)
Алкалоиды ряда изохинолина и пурина. (Лекция 10) Жер қыртысының заттық және химиялық құрамы
Жер қыртысының заттық және химиялық құрамы Увеличение эффективности печи установки АТ
Увеличение эффективности печи установки АТ Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Презентация по Химии "Йод" - скачать смотреть
Презентация по Химии "Йод" - скачать смотреть  Презентация по Химии "Польза жиров" - скачать смотреть
Презентация по Химии "Польза жиров" - скачать смотреть  Повторение 8 класса. Основные понятия химии
Повторение 8 класса. Основные понятия химии Добування кисню та вивчення його властивостей
Добування кисню та вивчення його властивостей Коллигативные свойства растворов
Коллигативные свойства растворов Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Презентация по Химии "Нові підходи до відходів" - скачать смотреть бесплатно
Презентация по Химии "Нові підходи до відходів" - скачать смотреть бесплатно Реактор для гетерогенного катализа с движущим слоем катализатора
Реактор для гетерогенного катализа с движущим слоем катализатора 6 КАЗ Изохинолин туынд
6 КАЗ Изохинолин туынд Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы
Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы Электродные потенциалы
Электродные потенциалы Задачи в школьном курсе химии
Задачи в школьном курсе химии Презентация по химии Нуклеофильное замещение карбоновых кислот
Презентация по химии Нуклеофильное замещение карбоновых кислот Транскрипция. Биосинтез РНК. (Лекция 7)
Транскрипция. Биосинтез РНК. (Лекция 7) Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Химия и здоровье человека
Химия и здоровье человека Буферные растворы
Буферные растворы ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов