Содержание
- 2. НОМЕНКЛАТУРА
- 3. За замісниковою номенклатурою IUPAC назви оксокислот утворюються з назв відповідних карбонових кислот додаванням префікса оксо-. За
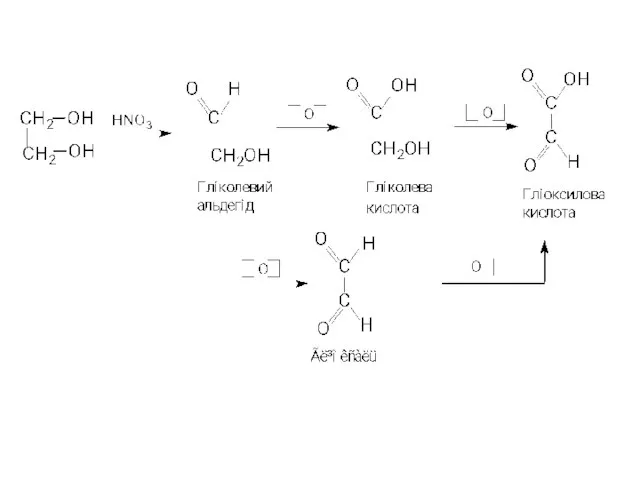
- 4. СПОСОБИ ОДЕРЖАННЯ 1. Гідроліз гемінальних дигалогензаміщених карбонових кислот Дихлороцтова Гліоксилова 2. Окиснення спиртів, гліколів, гідроксикислот
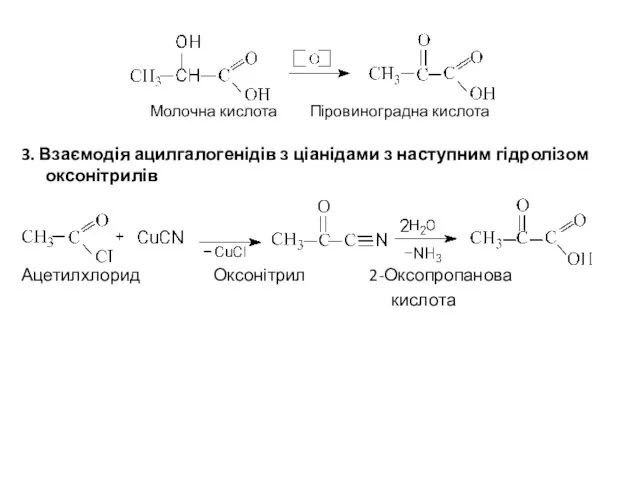
- 6. Молочна кислота Піровиноградна кислота 3. Взаємодія ацилгалогенідів з ціанідами з наступним гідролізом оксонітрилів Ацетилхлорид Оксонітрил 2-Оксопропанова
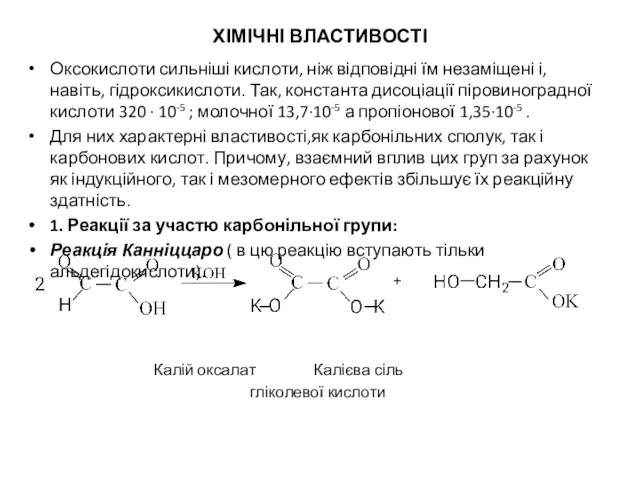
- 7. ХІМІЧНІ ВЛАСТИВОСТІ Оксокислоти сильніші кислоти, ніж відповідні їм незаміщені і, навіть, гідроксикислоти. Так, константа дисоціації піровиноградної
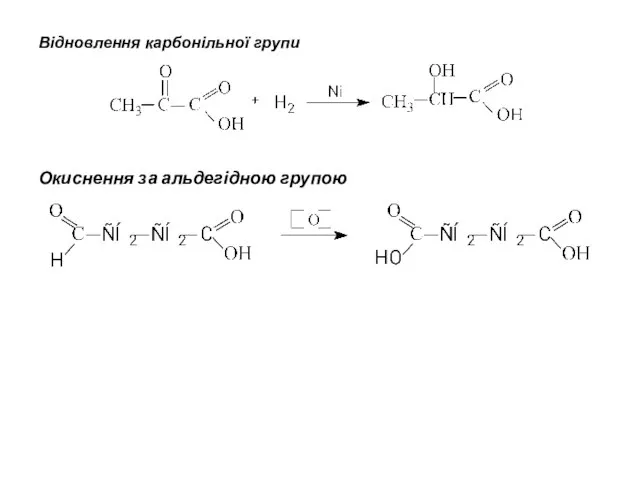
- 8. Відновлення карбонільної групи Окиснення за альдегідною групою
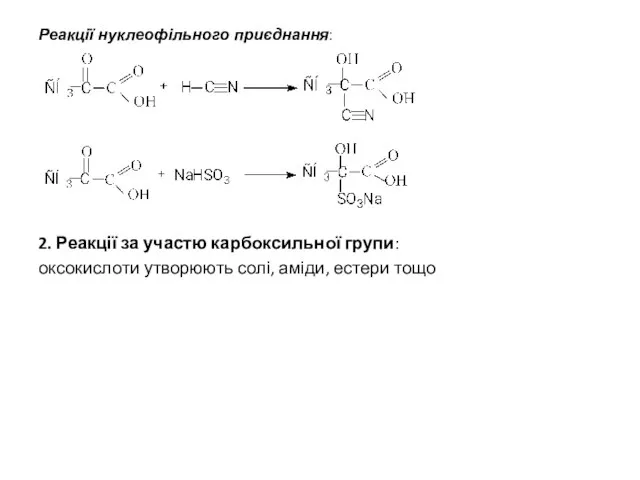
- 9. Реакції нуклеофільного приєднання: 2. Реакції за участю карбоксильної групи: оксокислоти утворюють солі, аміди, естери тощо
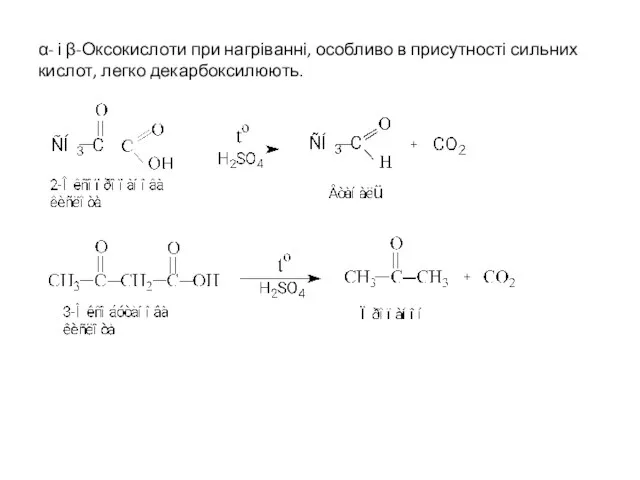
- 10. α- і β-Оксокислоти при нагріванні, особливо в присутності сильних кислот, легко декарбоксилюють.
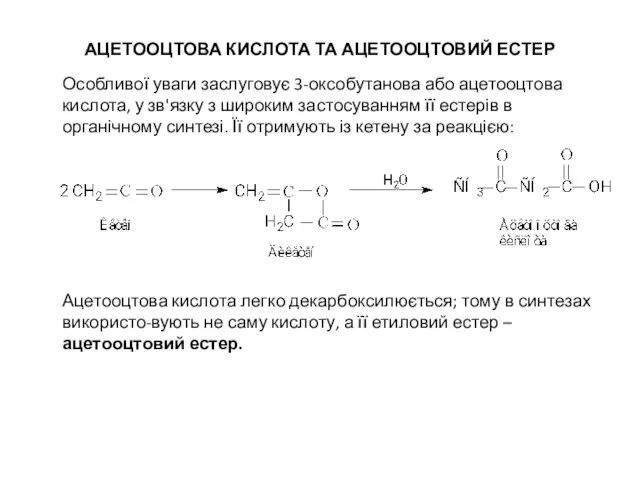
- 11. АЦЕТООЦТОВА КИСЛОТА ТА АЦЕТООЦТОВИЙ ЕСТЕР Особливої уваги заслуговує 3-оксобутанова або ацетооцтова кислота, у зв'язку з широким
- 12. Ацетооцтовий етер (АОЕ) також отримують з дикетену Ацетооцтовий естер Іншою реакцією одержання АОЕ може служити конденсація
- 13. Ацетооцтовий естер завдяки особливостям своєї будови виявляє кето-енольну таутомерію Кетонна форма Енольна форма 90% 10% Як
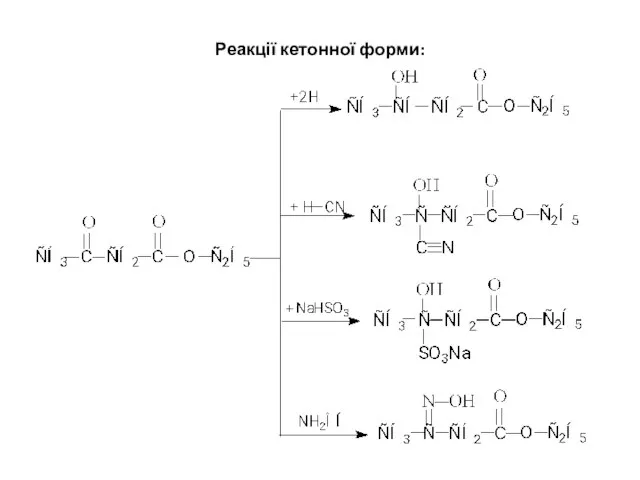
- 14. Реакції кетонної форми:
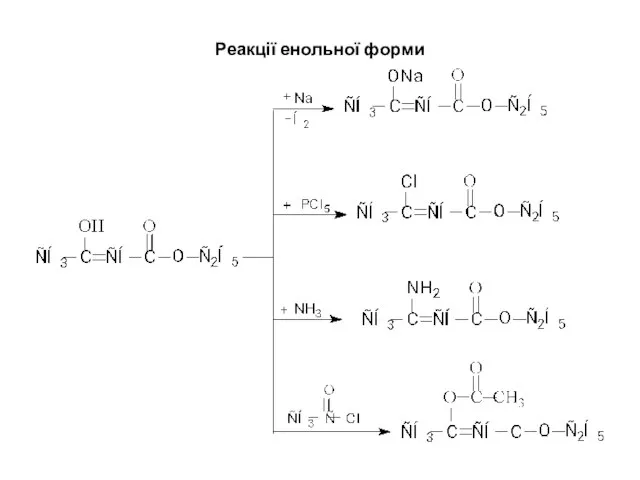
- 15. Реакції енольної форми
- 16. Важливою властивістю АОЕ є його здатність розкладатися при нагріванні з водними розчинами лугів. Причому, напрям розкладання
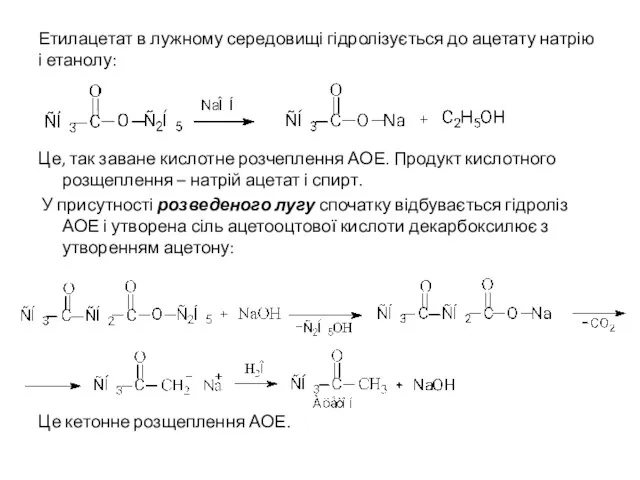
- 17. Етилацетат в лужному середовищі гідролізується до ацетату натрію і етанолу: Це, так заване кислотне розчеплення АОЕ.
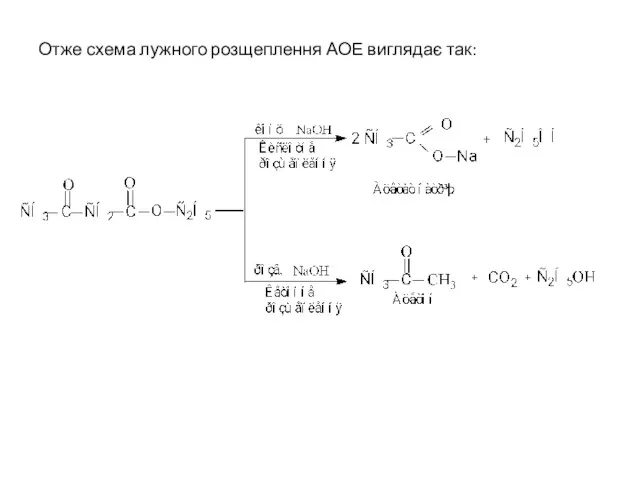
- 18. Отже схема лужного розщеплення АОЕ виглядає так:
- 19. Ще однією особливістю АОЕ є те, що атоми водню метиленової групи протонізовані за рахунок прояву -І-еф.
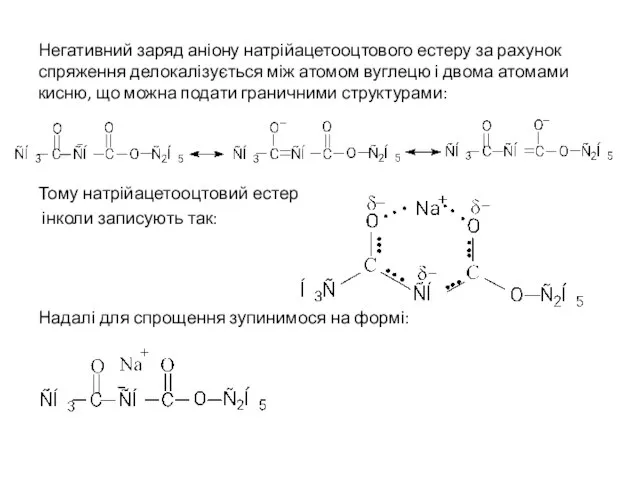
- 20. Негативний заряд аніону натрійацетооцтового естеру за рахунок спряження делокалізується між атомом вуглецю і двома атомами кисню,
- 21. Аніон АОЕ містить спряжену систему з вирівняними зв'язками і делокалізо-ваним негативним зарядом. Отже, у реакціях він
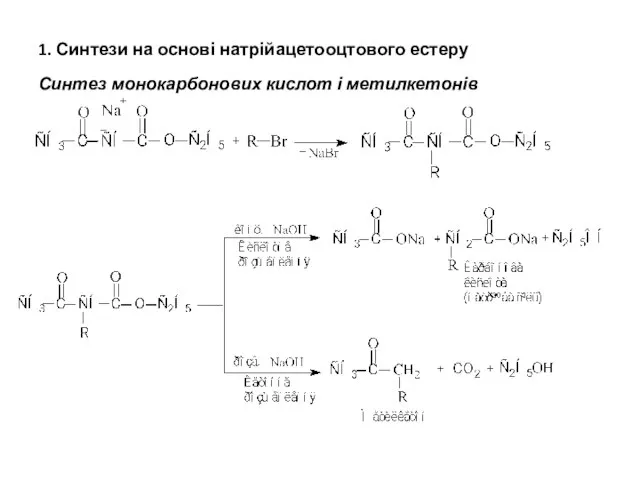
- 22. 1. Синтези на основі натрійацетооцтового естеру Синтез монокарбонових кислот і метилкетонів
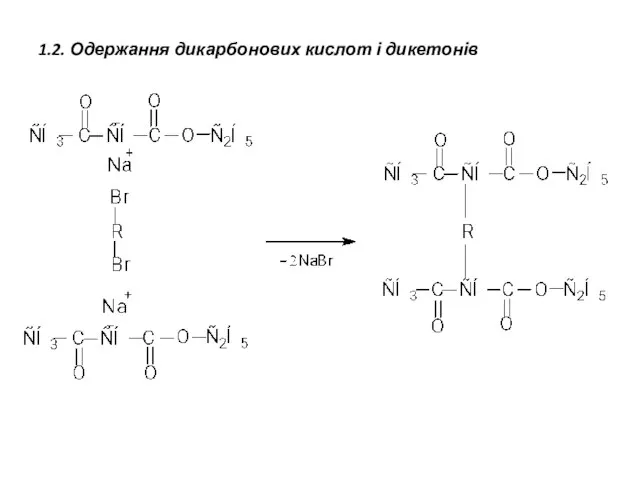
- 23. 1.2. Одержання дикарбонових кислот і дикетонів
- 25. Скачать презентацию








 «Основные соединения серы»
«Основные соединения серы» Металлические стёкла (аморфные металлы)
Металлические стёкла (аморфные металлы) Зміна складу і технологічних властивостей молока під впливом різних факторів
Зміна складу і технологічних властивостей молока під впливом різних факторів Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Характеристика ядов, изолируемых минерализацией в клинической фармации
Характеристика ядов, изолируемых минерализацией в клинической фармации Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Вспененные полимерные материалы. Классификация и принцип действия вспенивателей
Вспененные полимерные материалы. Классификация и принцип действия вспенивателей Окислительно-восстановительные реакции с участием органических веществ
Окислительно-восстановительные реакции с участием органических веществ Строение и функции белков
Строение и функции белков  Презентация по Химии "Неорганические кислоты" - скачать смотреть
Презентация по Химии "Неорганические кислоты" - скачать смотреть  Презентация по Химии "Искусственные полимеры" - скачать смотреть
Презентация по Химии "Искусственные полимеры" - скачать смотреть  Амины учитель: Труженникова Е.А.
Амины учитель: Труженникова Е.А. Пластик, пластмасса
Пластик, пластмасса Виды присадок к моторным топливам (бензин)
Виды присадок к моторным топливам (бензин) Федоренко Катерина
Федоренко Катерина  «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА»  01. Характеристика ХЭ на основании его положения в ПС Д.И. Менделеева
01. Характеристика ХЭ на основании его положения в ПС Д.И. Менделеева Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Презентация по Химии "Спирт" - скачать смотреть бесплатно
Презентация по Химии "Спирт" - скачать смотреть бесплатно Конструкционные и функциональные волокнистые композиты. Органические волокна
Конструкционные и функциональные волокнистые композиты. Органические волокна Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края
Состав воздуха и его загрязненность Отдел образования администрации Тальменского района Алтайского края Природный газ и нефть
Природный газ и нефть Строение газообразных, жидких и твердых тел
Строение газообразных, жидких и твердых тел Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край
Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край Уреидтер және оның маңызы
Уреидтер және оның маңызы Обмен углеводов
Обмен углеводов Алкены
Алкены Аммиак
Аммиак